动物细胞骨架微丝标记与观察综合性实验的探索*
李奇志 杨业秋 夏 姝 杨建国
(1 华中科技大学生命科学与技术学院,国家级生命科学与技术虚拟仿真实验教学中心 湖北武汉 430074 2 江汉大学医学院 湖北武汉 430056 3 武汉大学中南医院心胸外科 湖北武汉 430070)
细胞骨架是指真核细胞质中的蛋白质纤维网架体系,它对于细胞的形状、细胞的运动、细胞内物质的运输、染色体的分离和细胞分裂等起着重要的作用。细胞骨架由微管、微丝和中间纤维组成。其中,由肌动蛋白组成的微丝是真核细胞中含量最丰富的一种蛋白复合体,其动态变化在细胞迁移、胞质分裂、囊泡运输、细胞吞噬等多个过程中发挥至关重要的作用[1-3]。
在细胞生物学本科教学中,细胞骨架往往成为讲解研究技术等的示例,实验教学中更是入选率最高的实验内容[4]。传统的实验教学多选用“考马斯亮蓝染色标记细胞骨架实验”即采用非特异方法显示洋葱细胞内的微丝束。该实验在一定程度上可帮助学生加深对细胞骨架的认识,并了解染色方法和步骤,但存在诸多缺陷,例如,考马斯亮蓝染色法不能对特异性地区分细胞骨架的具体组分。华中科技大学生命科学与技术学院以当前较先进的实验技术为基石,设计了动物细胞骨架微丝标记的综合性实验,在实验设计中考虑到医学生的专业特点,将实验材料洋葱内皮细胞换成体外培养的动物细胞。保留非特异性蛋白质染料考马斯亮蓝染色的同时,增加了用特异性荧光标记的鬼笔环肽荧光探针染色肌动蛋白,并用细胞松弛素B 处理细胞后观察微丝的变化。
(E-mail: zhangji@nwnu.edu.cn)
1 材料与方法
1.1 实验材料 人肝母细胞瘤HepG2(以下简称HepG2)细胞系由华中科技大学生命科学与技术学院基因工程和基因组学联合实验室捐赠、大鼠神经胶质瘤细胞C6(以下简称C6)细胞系由武汉大学中南医院心胸外科教研室捐赠、SD 大鼠新生乳鼠(购于湖北省疾控中心)原代培养细胞(所有动物实验操作均符合华中科技大学实验动物伦理委员会有关条例规定)。
1.2 试剂和仪器 DMEM 高糖培养基、胰蛋白酶和胎牛血清购自HyClone 公司;细胞松弛素B、DAPI、FITC 标记的鬼笔环肽和Cy3 标记的鬼笔环肽购自南京凯基生物公司;新生小牛血清和胎牛血清购自中国杭州四季青生物技术有限公司;其他试剂均为国产分析纯。
6 cm 培养皿(Gibco 公司)、CO2细胞培养箱(ESCO,CCL-170B-8-NF)、倒置显微镜(Nikon,TS-100)、荧光显微镜(Nikon,Ni-U)。
1.3 动物细胞系传代培养 将HepG2 细胞系按104~105个/mL 浓度接种在6 cm 的培养皿中,每个培养皿中加入2 mL 的含8%小牛血清的高糖DMEM 培养基,轻轻吹打使细胞分散均匀,再加入一定体积的上述完全培养基使终体积达到5 mL,在每个培养皿中放入3 片无菌盖玻片(经160℃、2 h 干烤灭菌)作为细胞爬片;培养皿放入37℃、5% CO2湿化培养箱中培养。
C6 细胞系的完全培养基是含10%胎牛血清的高糖DMEM 培养基,操作步骤同上。
1.4 动物细胞原代培养 无菌条件下取大鼠乳鼠皮肤约2 cm2,置于培养皿中,用0.01 mol/L PBS 反复洗涤后,剪成1~2 mm2的小块,0.25%胰蛋白酶中37℃水浴30 min,800 r/min 离心10 min后,以1×105个/mL 细胞接种于6 cm 的培养皿,培养皿中加入含8%小牛血清的高糖DMEM 培养基,并放入无菌盖玻片作为细胞爬片;培养皿在37℃、5% CO2湿化培养箱中培养。
1.5 考马斯亮兰染色法 考马斯亮蓝R250 显示细胞内微丝的方法[5]:吸去培养皿中陈旧的培养基,用0.01 mol/L PBS 洗涤培养皿中长有细胞的爬片后,1% Triton X-100 37 ℃处理30 min,M 缓冲液洗涤细胞爬片,在3 %戊二醇中固定10 min,以0.01 mol/L PBS 洗涤,用滤纸吸去多余液体,0.2%考马斯亮蓝R250 染色15 min,PBS 洗涤,最后将细胞爬片倒置于载玻片上用PBS 液封片并镜下观察。
1.6 FITC-鬼笔环肽荧光标记法[6]大鼠乳鼠原代细胞骨架微丝的荧光染色具体步骤如下:吸去培养皿中陈旧的培养基,用0.01 mol/L PBS 洗涤培养皿中长有细胞的爬片后,3.7%甲醛固定10 min,PBS 洗3 次,每次5 min;0.1% Triton X-100 透化处理15 min,PBS 洗涤;FITC 标记的鬼笔环肽室温避光反应40 min;PBS 洗去未结合的荧光染料,最后,用甘油封片将细胞爬片倒扣置于载玻片上并镜下观察。
1.7 荧光标记的鬼笔环肽和DAPI 分别标记体外培养细胞 HepG2 细胞骨架微丝和细胞核的荧光染色具体步骤如下:吸去培养皿中陈旧的培养基,经0.01 mol/L PBS 洗涤培养皿中长有细胞的爬片后,4%的多聚甲醛固定,用0.1% Triton X-100室温处理5 min,1%的BSA 孵育30 min 后,用5U Cy3 标记的鬼笔环肽于室温暗处理20 min,并100 ng/mL 的DAPI,室温暗处理5 min。PBS 清洗细胞和细胞封片同1.6。
大鼠乳鼠原代细胞骨架微丝的荧光染色同1.6,细胞核荧光染色用100 ng/mL 的DAPI,室温暗处理5 min,PBS 清洗细胞和细胞封片同1.6。
1.8 细胞松弛素B 处理HepG2 细胞 在培养的HepG2 细胞培养皿中加入1 mg/mL(DMSO 配制)的细胞松弛素B 溶液,使终浓度为10 μg/mL,37℃培养箱中孵育30 min,对照组细胞相应用等量生理盐水和DMSO 处理[7],实验组和对照组都在15 min 和30 min 后进行考马斯亮蓝染色。将细胞松弛素B 处理过的细胞爬片用PBS 液洗细胞5 次后,继续培养90 min 后进行考马斯亮蓝染色并观察。
2 结果
2.1 HepG2、C6 细胞系和原代细胞考马斯亮蓝R250 染色(图1)
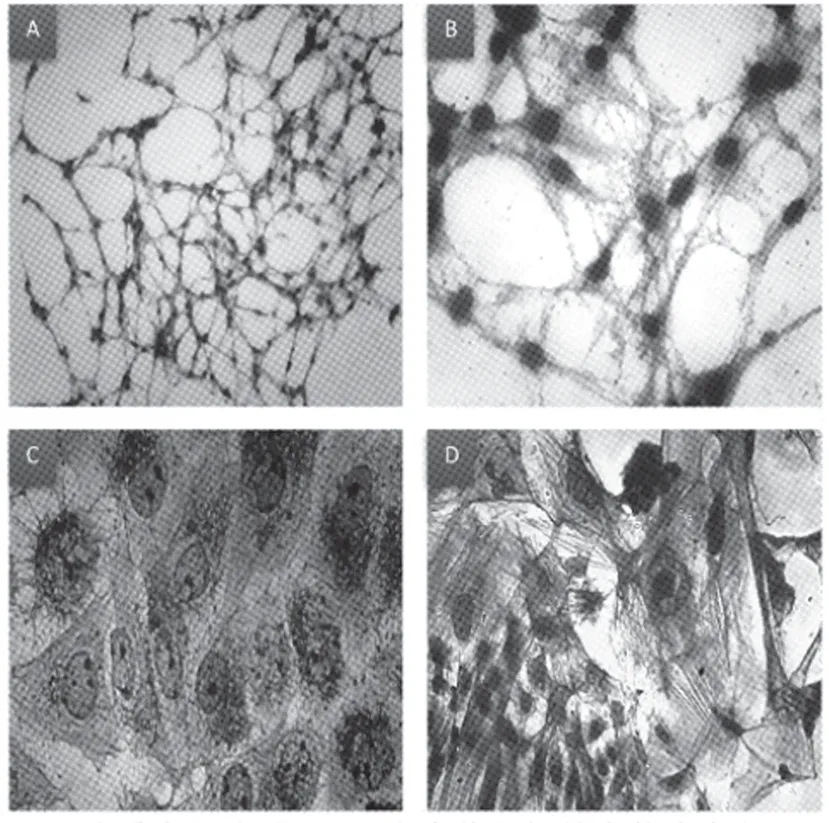
图1 经典方法考马斯亮蓝染液将微丝被染成蓝色
2.2 荧光探针标记原代培养细胞(图2)

图2 FITC-鬼笔环肽标记的肌动蛋白在荧光显微镜下发出绿色荧光
2.3 双荧光探针标记体外培养的原代大鼠皮肤细胞和HepG2 细胞系(图3)

图3 细胞的肌动蛋白和细胞核分别被鬼笔环肽和DAPI 荧光探针标记
2.4 细胞松弛素B 处理细胞前、后微丝的变化和细胞形态学改变(图4)

图4 细胞松弛素B 处理前后HepG2 细胞微丝和细胞形态的变化
3 实验教学探讨
3.1 细胞骨架标记方法的优、缺点比较 在本教学中用2 种方法标记细胞骨架微丝:考马斯亮蓝染色法和鬼笔环肽标记法标记法。考马斯亮蓝R250染色法具有成本低、可用普通光学显微镜观察结果的优点;考马斯亮蓝R250 可染各种蛋白,并非特异染微丝,不能区分骨架蛋白的成分;但在该实验条件下,微管结构不稳定,有些类型的纤维太细,光学显微镜下无法分辨,因此,观察到的主要是由微丝组成的直径约40 nm 应力纤维(图1、图4)。鬼笔环肽标记法中鬼笔环肽与肌动蛋白结合,能特异显示微丝并且灵敏度极高(图2、图3);该方法在处理细胞时用的固定和通透细胞膜没有完全去除细胞膜及其他非骨架成分,维持了骨架形态的完整性,相对真实地反映了骨架的自然状态,也是科学研究的主流方法之一;但由于需要与荧光素结合,观察结果时需要荧光显微镜,且价格相对比较贵,因此在实验教学有时会受到限制。
3.2 根据学情背景不同的教学设计 华中科技大学生命学院每年承担同济基础医学院9 个专业20多个班级的本科生、临床医学8年制及留学生MBBS(Bachelor of Medicine & Bachelor of Surgery)的医学细胞生物学实验教学;同时每年还有生物技术、生物信息和生物科学近10 个班细胞生物学实验教学任务。根据各专业特点开设高质量有专业特色的实验课程是学院课程改革探索的主要重点,该实验项目就是在这样的改革背景下探索实施的。实验内容涉及细胞培养和细胞荧光标记技术,根据各专业的特点在多方面进行了实验优化。例如,细胞培养内容的选择是根据专业特点不同而不同。细胞培养作为细胞生物学实验中最具有代表性的技术,其关键在于无菌操作。因此,根据无菌操作的难易程度,将操作步骤复杂、过程繁多的动物细胞原代培养安排在临床医学8年制的实验中;而临床医学5年制、预防医学等专业选择操作相对简单的传代细胞培养,并且选用体积较大、铺展较好、贴壁牢固的HepG2 或HeLa 细胞系;临床医学6年制选用操作动作要求更加轻柔的C6细胞系;对生物学专业的学生,由于他们比医学生高一年级(医学生和生物学专业学生分别是第2 学期和第3 学期学习细胞生物学的课程)同时动手能力也较强,因此,在实验中将这几种细胞按学生分组全部分配给各组学生培养。教师在上课时展示不同的专业学生培养细胞的结果,探讨不同细胞内微丝的分布特征、微丝的数量及构型在细胞之间的差异,使学生对微丝的理解更加深入和全面,知识面得到很大的拓展。
实验设计还必需考虑由于实验学生人数多会造成实验安全性难以把控、实验者的参与热情和实验的成功率受到影响,因此,选择适合于学生当前学情的实验材料不仅可增加实验的成功率,而且可增加学生的科研训练机会,使学生获得成就感,增加学习的兴趣和自信心。笔者对实验材料进行如下改进。首先,对用于细胞爬片的盖玻片的灭菌方法进行了改进。改进前常规将盖玻片浸泡在医用酒精里,细胞培养接种细胞时将泡在酒精里的盖玻片在酒精灯上烧后再置于培养皿里做细胞爬片。这种方法在操作者不熟练时容易发生起火的安全事故,而且盖玻片在酒精灯上烧的时间不长,在培养时间长达1 周时这种灭菌效果并不理想。因此改进方法是将做细胞爬片的盖玻片在干烤箱里160℃、2 h 灭菌处理,这样既避免了沾有酒精的盖玻片在酒精灯上烧也保证了灭菌效果。其次,实验中将常规用多孔板传代细胞换成每位学生用一个6 cm 的培养皿,在教学中教师讲述粘附细胞生长的特点。粘附细胞在盖玻片上、下面都能贴壁生长,贴附在盖玻片上面的细胞比下面的生长得更快、更好,鼓励学生大胆同时仔细地将2~3 片灭菌盖玻片放在培养皿中,尽量不要重合,即使有重合对实验结果不会有大的影响。这样的实验设计既增加了学生的操作机会,学生也更能理解培养细胞的生长特点,同时还能避免多位学生用一块多孔板可能造成的交叉污染。最后,教学中将学生细胞培养所用的培养基、PBS 和胰蛋白酶等都换成小包装,例如,培养基和PBS 装在可重复利用的10 mL 离心管中,胰蛋白酶装在1.5 mL的EP 管中,每班学生利用课余时间分装这些试剂。这样在很大程度上避免了众多学生参与的细胞培养可能出现的交叉污染,而且能保证每个学生的实验结果都是用自己的材料完成,学生更能获得成就感。
3.3 在实验内容的安排上体现综合实验设计思想 目前,大多数高校本科细胞生物学实验教学每个专业每周开设1 次课,时长为4 学时。学生无法持续地进行实验,因此,实验内容的安排尽量选择能单独设课同时又彼此衔接。基于此,笔者设计出2 个有机联系且逐步递进的实验阶段,让学生能从细胞培养、细胞骨架微丝标记及观察入手,逐步了解细胞骨架微丝在生长过程中的形态表现。第1 阶段进行的是4 学时的动物细胞培养实验内容,实验教学时教师将培养至对数生长期的细胞提供给学生,按每班2 人一组提供3.5 cm 培养皿作为母瓶细胞。该阶段的教学重点在于无菌操作技术、细胞计数和死活细胞的鉴定。学生需在细胞培养室内每2 人一组进行无菌操作,并按照教师要求的浓度进行细胞计数,每位学生都要将细胞接种在6 cm 的培养皿中,无菌的盖玻片也是学生在接种细胞过程中自己置于培养皿中作为爬片细胞。这样既能保证在下一周第2 阶段4 学时实验课细胞的密度,同时,学生又能用自己培养的细胞爬片做细胞骨架微丝标记实验。第2 阶段的实验内容是对培养细胞的细胞骨架微丝进行标记后,在普通光学显微镜和荧光显微镜下进行观察,该阶段教学的重点和难点在于荧光标记和利用荧光显微镜的使用。2 个部分的教学实验涵盖了细胞培养、细胞计数、荧光标记和荧光显微镜检测技术等内容。这种实验内容有机编排和设计增强了学生的学习兴趣和对科学实验系统性和严谨性的认识,又能使学生体会到实验具有高度的连贯性和整体性,极大地提高了学习兴趣和积极性。
3.4 科学前沿性和综合研究性 该实验项目涉及荧光显微镜技术和药物对培养细胞的影响。荧光显微镜不仅是生命学科不可缺少的研究工具,也是多学科发展的综合成果,所涉及的物理学和电子学理论知识深奥繁琐。因此,显微技术实验教学的内容设计应尽量让学生在有限的课堂时间里形象、直观地学习和掌握这门技术。笔者在实验教学中调整并增加了需要使用荧光显微镜的内容,学生2 人一组选择实验内容进行制片与观察,这样极大提高了使用荧光显微镜的机会。本实验教学选用FITC 和Cy3 2 种最常用的荧光素标记的鬼笔环肽,FITC 和Cy3 在相应的激发光下分别发出绿色和红色荧光;同时也用DAPI 标记了细胞核,DAPI 在紫外激发光下发出蓝色荧光(图3)。这样的实验设计让学生熟悉荧光显微镜激发光与荧光波长的关系、滤光片的选择方法。学生在观察到色彩斑斓的细胞世界同时,也能了解荧光显微镜的设计原理、结构功能及使用方法,同时避免让学生仅停留于感性认识阶段,能让学生体验到科技创新成果的优越性和现实存在,还能掌握荧光显微镜数字成像系统采集和处理分析图像等技能,为后期实验教学和科学研究奠定基础。
实验所用的试剂鬼笔环肽和细胞松弛素B 是研究微丝骨架最常用的药物。鬼笔环肽是一种从有毒菌中提取的真菌毒素[6]。鬼笔环肽可特异性与丝状肌动蛋白结合,用荧光标记的鬼笔环肽染色技术是近年来研究固定细胞微丝骨架的传统技术手段,应用这些技术已使得科学家在微丝骨架的研究方面取得了很大进展[8-9]。细胞松弛素B 作为第1 个用于研究细胞骨架的药物,主要作用是促进肌动蛋白丝的解聚及抑制单体肌动蛋白聚集[10-11]。细胞松弛素为真菌的代谢产物,可与微丝正端结合,抑制其聚合,导致微丝解聚,并能抑制各种依赖于微丝的运动,具有抗肿瘤的潜能[3]。在本实验项目中用细胞松弛素B 处理HepG2 细胞,微丝解聚后,镜下观察细胞形态是否皱缩;再用缓冲液洗脱细胞松弛素B 后继续置于培养箱中培养,镜下观察细胞形态是否恢复,如实验结果中图4所示。学生完成整个实验过程也是对教材细胞骨架运动形态的模型“人工再现”,并且对微丝构成细胞支架、维持细胞形态的功能理解得更加深刻。通过这样设计的实验教学改革,让学生了解和掌握高新技术,在一定程度上增强其对科学研究和创新的信心。同时提高了学生的学习兴趣和积极性,加深了对细胞生物学进展相关内容的理解和掌握,培养了学生的创造性思维能力,发挥主观能动性,提高学习效率。

