心脑动脉硬化患者的福音
郭晓强
胆固醇(cholesterol)是一种重要的脂类物质,一方面可构成细胞膜等膜性结构,对于保证细胞功能完整性具有重要意义,另一方面还可转化出多种生物活性物质如胆汁酸、维生素D3、性激素和肾上腺皮质激素等,它们在维持机体内稳态方面具有重要功能。然而,胆固醇也存在两面性,血液中胆固醇过多,容易沉积于血管表面形成斑块,最终引起冠状动脉粥样硬化性心脏病(简称冠心病)或中风。
胆固醇与冠心病
冠心病是一种常见病和多发病,常造成心肌缺血、心肌梗塞等危及生命的情况发生。冠心病是发达国家最重要的死亡原因,随着我国居民生活水平的提高,冠心病的危害性也逐渐显现,寻求治病良药意义重大。
早在19世纪,德国病理学家菲尔绍(R. Virchow)就发现,死于心肌梗死患者的动脉壁上存在斑块,其中含有胆固醇。后又发现,胆固醇可造成动脉壁增厚而发生动脉狭窄,增加高血压和血管闭塞性疾病的风险。1950年代,美国一项大规模流行病学调查显示,冠心病发生与血液高胆固醇含量呈正相关。1961年,美国对5000多名30—62岁间人群进行的一项调查显示,高胆固醇含量是造成心脏损伤的重要因素,血液中胆固醇含量与心血管疾病发生概率呈正相关。
1965—1967年,世界卫生组织对15 745名临床健康的成年男性进行了一次前瞻性试验,结果表明:降低血清胆固醇可有效预防缺血性心脏病[1]。
这些数据不约而同地将胆固醇推到风口浪尖。学术界也逐渐达成一定共识,归纳为一句话就是:高胆固醇有害,降胆固醇有益。
如何降低体内胆固醇呢?首先看胆固醇的来源:它或者从食物直接摄取,或者利用其他营养物质如糖等转化合成。对轻度胆固醇升高而言,通过调整饮食结构即可;但对中度和重度胆固醇升高而言,则需要抑制体内胆固醇合成。
在1950年代单纯通过饮食手段降低冠心病患者血浆胆固醇的希望落空,从而导致1960年代氯贝特、胆甾胺和尼克酸等一系列药物的开发与应用。这些药物具有较强的降胆固醇性能,但因其引起严重不良反应而先后被临床淘汰,亟需新药来填补空缺[2]。
胆固醇合成
胆固醇结构复杂,27个碳原子构成4个环状结构及支链,尽管胆固醇在18世纪后叶就已经发现,但是直到1932年才由德国化学家温道斯(A. O. R. Windaus, 1928年诺贝尔化学奖获得者)解析出其结构。1951年,英国化学家康福思(Sir J. W. Cornforth,1975年诺贝尔化学奖获得者)和罗宾逊(Sir R. Robinson,1947年诺贝尔化学奖获得者)首次实现胆固醇全合成,与此同时美国伍德沃德(R. B. Woodward,1965年诺贝尔化学奖获得者)也取得了同样成果,这被认为是具有里程碑意义的突破。然而,胆固醇的体内合成过程尚未被阐明。
1940年代,德裔美国生物化学家布洛赫(K. E. Bloch)开始系統研究胆固醇合成。布洛赫使用放射性同位素C-14和H-3标记的方法证实胆固醇合成来源为二碳单位(最初认为是乙酸,后被证实应为乙酰辅酶A)。经过10余年的艰苦探索,最终阐明了胆固醇生物合成的复杂酶促过程(从乙酰辅酶开始需经过30多步化学反应才可完成)。布洛赫也因为这一贡献而分享1964年诺贝尔生理学或医学奖。由此看来,胆固醇算得上名副其实的“明星分子”。
在胆固醇的生物合成中,3-羟基-3-甲基戊二酸单酰辅酶A(HMG-CoA)还原酶是限速酶(代谢过程一系列反应中,催化其中一个最慢反应的酶),它催化HMG-CoA生成甲羟戊酸(MVA),MVA进一步生成胆固醇,因此寻找降胆固醇药物就转化为筛选安全、高效、特异的HMG-CoA还原酶抑制剂。这一问题由日本科学家远藤章(A. Endo)于1970年代率先予以解决。
远 藤 章
远藤章出生于日本北部农民家庭,从小对真菌表现出异常的偏爱,最崇拜的人是青霉素发现者弗莱明(A. Fleming,1945年诺贝尔生理学或医学奖获得者),孩提时代就阅读过多本有关弗莱明的传记和青霉素发现的故事,立志将来像弗莱明发现青霉素那样,做出有益于人类健康的重大贡献。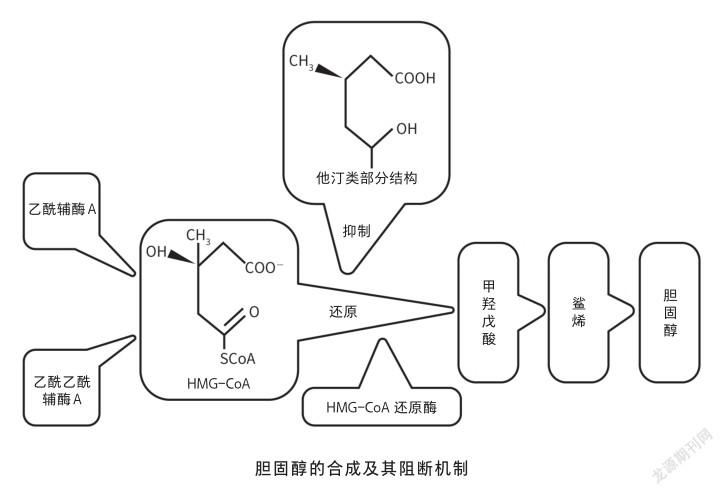
1957年,远藤章从日本东北大学农学院获学士学位,随后加入日本三共制药公司任研究助理。他被安排到应用微生物小组,负责从真菌中寻找新型果胶酶,以除去葡萄酒和苹果酒中的黏果胶,结果顺利完成任务,并由此加强了他对真菌重要性的认识。
1960年代,远藤章开始接触并喜欢上胆固醇研究,不久被1964年布洛赫获奖的消息所打动,立刻向布洛赫写出求职信,希望能获得一个研究职位。遗憾的是他未能如愿,只能于1966年进入纽约爱因斯坦医学院著名生物化学家霍雷克(B. L. Horecker,磷酸戊糖途径发现者)的实验室,跟随罗斯菲尔德(L. I. Rothfield)开展细菌代谢研究,后者发现像胆固醇这样的脂类物质对细菌也具有重要作用。罗斯菲尔德有在纽约大学医院10余年的内科医生经历,远藤章借此熟悉了胆固醇的临床危害。他发现心脏病是美国第一位死亡原因,中风是日本头号杀手,两种疾病不约而同地指向同一原因,那就是高胆固醇。这进一步坚定了他寻找降胆固醇药物的决心[3]。
1968年,学成归国的远藤章回到三共公司,并获得一个良机,可根据个人爱好开展研究。此时,长久兴趣(挚爱真菌研究)和重大需求(寻找降胆固醇药)合二为一。他提出一个非常大胆的想法:从真菌中寻找降胆固醇药物。当时从真菌中寻找抗生素已是常规做法,而抗生素大多通过抑制细菌代谢而发挥生物学活性,远藤章推测:有些抗生素可能会通过影响胆固醇代谢来达到抑菌目的。
美 伐 他 汀
尽管三共公司的主营业务与胆固醇代谢无明显关联,但仍义无反顾地支持远藤章的主张。
远藤章首先构思出一个较为详尽的工作计划。药物筛选是一项耗时、烧钱的工程,为尽量降低花费,他需要对筛选程序进行改进。评价HMG-CoA还原酶抑制剂的强弱就是看HMG-CoA生成MVA的比例,传统方法需要用到同位素标记的HMG-CoA,而这种试剂过于昂贵,开展大规模筛选必然花费巨大而得不偿失。远藤章改为使用同位素标记的乙酸(可生成乙酰辅酶A)为材料,首先筛选抑制乙酸合成胆固醇的化合物(正筛选),随后从中排除抑制MVA合成胆固醇的化合物(负筛选),剩余化合物则抑制乙酸合成MVA,而HMGCoA还原酶是该阶段最关键的酶。
受弗莱明发现青霉素启发,远藤章认为真菌产生的抑制胆固醇合成的化合物应该会分泌到细胞外,因此不需碾碎真菌,只需收集培养基即可。由于胆固醇生物合成主要在肝脏完成,因此選择大鼠肝脏匀浆作为化合物测试体系。万事俱备只欠东风,他接下来需要按部就班地进行筛选,以找到自己心仪的化合物,但随后遇到的困难远超当初预期。
远藤章花费了两年多时间没日没夜地工作,筛选了6000多种真菌的分泌物,却没有找到一种符合预期的新型化合物。不过功夫不负有心人,就在项目终止时间即将到来、这个计划即将以失败告终之际,重大的转机意外地出现了。
1973年3月5日,远藤章从生长在京都附近稻田里的一株桔青霉(Penicillium citrinum)中发现了一丝端倪,这种真菌的培养基中存在强有力的胆固醇生物合成抑制物。他随后利用溶剂提取、硅胶柱层析和结晶的方法,最终把该化合物纯化出来,编号为ML-236B,命名为康百汀(compactin), 就是后来的美伐他汀(mevastatin)[4]。
远藤章通过对美伐他汀的结构分析发现,其与MVA结构具有相似性,推测应为HMG-CoA还原酶的竞争性抑制剂,从而解释了美伐他汀的重要作用机制,推动了其进一步的开发。
1974年,三共公司开启动物实验,验证美伐他汀的体内效果。研究人员为大鼠连续饲喂美伐他汀7天,结果令人失望:大鼠血浆胆固醇未出现下降,这一结果为美伐他汀的将来应用蒙上一丝阴影。尽管远藤章通过深入研究对这一结果做出了合理解释,即美伐他汀诱导了大鼠肝脏HMG-CoA还原酶的表达,但学术界对美伐他汀仍持半信半疑的态度。
不久,远藤章的研究再次出现转机。1976年,病理学家北野北藤(N. Kitano)与三共公司合作,采用母鸡来测试美伐他汀的效果,经过两周的饲喂发现:母鸡血浆胆固醇显著降低(达30%以上)。这一重大利好为远藤章和三共公司带来了巨大信心,又将测试拓展到狗和猴子等动物,最终得到更加令人信服的结果,那就是美伐他汀具有广谱降胆固醇能力[5]。
更大的利好来自临床试验。1977年,大阪大学医院山本秋郎(A. Yamamoto)与远藤章一起,给多名遗传性高胆固醇血症患者使用美伐他汀,结果显示:美伐他汀可明显降低血浆胆固醇含量。这一喜人结果推动三共公司开启正式临床试验,多家医院的结果表明其降胆固醇效果好、安全性高。1981年,一项更大的临床试验也证实了美伐他汀降低血浆胆固醇的高效性和安全性。
进一步的机制研究使大家更加确信美伐他汀的疗效。1970年代,美国生物化学家布朗(M. Brown)和戈尔茨坦(J. Goldstein)合作,证实高血脂伴发低密度脂蛋白(low density lipoprotein, LDL)升高,而肝细胞表面LDL受体通过内吞减少了LDL、降低了冠心病风险。两位科学家由于这一系列发现而分享1985年诺贝尔生理学或医学奖。布朗和戈尔茨坦在获悉远藤章的发现后,决定测试美伐他汀对LDL的影响,结果发现美伐他汀具有升高肝脏中LDL受体含量和减少LDL水平的活性,为美伐他汀的临床应用提供了进一步证据[6]。
就在大家满怀信心,对美伐他汀的将来寄予厚望之时,意想不到的事情发生了。狗的长期、大剂量毒理学实验显示,美伐他汀可增加淋巴瘤患病的风险。这一结果导致三共公司忍痛割爱,最终放弃了美伐他汀的进一步开发[7]。尽管如此,美伐他汀作为第一种他汀类药物,开启了一个全新的药物领域,后续研究都在此基础上展开。
洛 伐 他 汀
与远藤章寻找降胆固醇药物同时,世界多家制药公司也在开展类似的研究,但最终结果大相径庭。
与远藤章的发现几乎同步,英国比查姆制药公司(Beecham Pharmaceuticals, 后并入葛兰素史克公司)的费尔斯(R. Fears)从短密青霉菌(Penicillium brevicompactum)中也筛选到康百汀,但进一步利用大鼠开展降胆固醇实验,遇到和远藤章同样的问题(无法降低胆固醇),因此取消了这一项目[8]。相对于三共公司,比查姆公司的敏锐性显然更差。
1975年,默克公司新上任的研究实验室主任瓦杰洛(R. Vagelo)启动采用生物化学方法筛选天然化合物作为候选药物的计划,并建议生物化学家阿尔伯茨(A. Alberts)负责寻找HMG-CoA还原酶抑制剂。他们得知多家药物公司都在从事这方面研究,尤其是日本三共公司的远藤章已经发现美伐他汀显示出良好的降胆固醇效果。意识到有点落伍的阿尔伯茨决定加快步伐,急起直追。
1978年,阿尔伯茨从土曲霉发酵液中发现一种新的天然产物,其对HMG-CoA还原酶的抑制活性远超过美伐他汀,于是将其命名为美维诺林(mevinolin),这就是后来的洛伐他汀(lovastatin)[9]。几乎同时,远藤章也鉴定出洛伐他汀。
1980年4月,默克公司开启洛伐他汀的临床试验,尽管相对于三共公司略显滞后,但相对大多数制药公司已是遥遥领先。遗憾的是这一项目也命途多舛,不久也被迫中断,原因在于三共公司披露了美伐他汀引起严重不良反应。考虑到两种化合物结构高度相似(洛伐他汀仅比美伐他汀额外多一个甲基),推测洛伐他汀也存在一定的安全风险[10]。
与三共公司不同的是,默克公司并未取消他汀药物的研发。为慎重起见,默克公司进一步开展更加全面的动物毒理实验,在两年的时间里最终确定了洛伐他汀的安全性。即使如此,1983年重启洛伐他汀临床试验,在选择受试人群时,仍仅限于已患有冠心病且总胆固醇和LDL含量高的高危患者,以符合伦理学要求,将洛伐他汀临床风险降到最低。
1987年9月1日,洛伐他汀安全性和有效性被美国食品和药物管理局(FDA)认可,正式批准应用于临床存在高胆固醇血症的患者。洛伐他汀也成为第一种真正意义上的他汀类药物。谨慎起见,默克公司当时仅承认洛伐他汀降胆固醇含量的作用,但不确定患者是否获益。进入1990年代,针对洛伐他汀开展了更为全面的临床测试,进一步证明它具有显著降低冠心病风险和患者总死亡率的效力,且服用者的不良反应极小。1994年,一项大规模试验最终表明,洛伐他汀可以作为动脉粥样硬化症的二级预防策略。
洛伐他汀的巨大成功(年銷售额曾达到10亿美元峰值)引起其他公司纷纷效仿,把大量人力物力投入他汀药物的研发,最终产生多款药物用于临床,如瑞舒伐他汀(crestor)、阿托伐他汀(lipitor)、普伐他汀(pravatin)、氟伐他汀(lescol)、皮塔伐他汀(livalo)和辛伐他汀(zocor)等,从而构成新一类药物。今天,应用最为广泛的是阿托伐他汀,商品名立普妥(lipitor)。
深 远 影 响
今天,降低血浆胆固醇的他汀类药物是世界上使用最广泛的药物之一,使无数高胆固醇和高LDL患者避免了心梗和中风的风险,挽救了他们的生命。他汀类药物已成为预防冠状动脉粥样硬化发生的二级甚至一级预防措施。他汀类药物的发现,推动了高胆固醇血症治疗领域的一场革命,并创造了药物研发史上的又一传奇。
需注意的是,他汀类药物也并非完美无缺,也会造成一定的不良反应,长期服用会带来健康风险。2012年,美国FDA宣告,他汀药物可小概率升高血糖并最终诱发二型糖尿病的发生,还具有损伤认知能力(出现记忆混乱甚至丧失)的潜在风险。
在整个他汀药物开发进程中,远藤章的基础性发现和默克公司的大力推广发挥了至关重要的作用,最终远藤章获得了名,而默克公司获得了利。远藤章并未为他汀申请专利,他认为人类健康远比金钱更重要。远藤章本人也从他汀间接获益:2000年,远藤章被诊断出高胆固醇血症,医生为他推荐他汀药物,最终维护了身体健康,可谓“失之东隅,收之桑榆”。
从学术上讲,远藤章传承了弗莱明的衣钵,再一次把真菌这种“不起眼”的生物发扬光大。如果说1928年弗莱明的发现开创了感染性疾病的治疗史,而在近半个世纪以后,远藤章的发现开创了冠心病的治疗史。
远藤章本人也获得了众多的学术荣誉。2008年远藤章荣获美国著名的拉斯克临床医学奖,2017年又荣获加拿大盖尔德纳奖,2012年还入选美国发明家名人堂。
在新药研发难度越来越大的今天,他汀药物的成就无疑具有里程碑意义,创新性和重要性都毋庸置疑,从这个角度看,不远的将来,远藤章分享诺贝尔奖的概率也非常之大。
[1]Manu P, Rogozea L. The discovery of statins. Am J Ther, 2016, 23(4): e980.
[2]Tobert J A. Lovastatin and beyond: The history of the HMG-CoA reductase inhibitors. Nat Rev Drug Discov, 2003, 2(7): 517.
[3]Stossel T P. The discovery of statins. Cell, 2008, 134(6): 903.
[4]Endo A, Kuroda M, Tanzawa K. Competitive inhibition of 3-hydroxy-3-methylglutaryl coenzyme A reductase by ML-236A and ML-236B fungal metabolites, having hypocholesterolemic activity. FEBS Lett, 1976, 72(2): 323.
[5]Endo A. A gift from nature: The birth of the statins. Nat Med, 2008, 14(10): 1050.
[6]Goldstein J L, Brown M S. A century of cholesterol and coronaries: From plaques to genes to statins. Cell, 2015, 161(1): 161.
[7]Endo A. A historical perspective on the discovery of statins. Proc Jpn Acad Ser B Phys Biol Sci, 2010, 86(5): 484.
[8]Steinberg D. Thematic review series: The pathogenesis of atherosclerosis. An interpretive history of the cholesterol controversy, part V: The discovery of the statins and the end of the controversy. J Lipid Res, 2006, 47(7): 1339.
[9]Alberts A W, Chen J, Kuron G, et al. Mevinolin: A highly potent competitive inhibitor of hydroxymethyl glutaryl-coenzyme A reductase and a cholesterol-lowering agent. Proc Natl Acad Sci USA, 1980, 77(7): 395761.
[10]Vagelos P R. A conversation with P. Roy Vagelos. interview by Ushma S. Neill. J Clin Invest, 2014, 124(6): 2291.
关键词:他汀 胆固醇 HMG还原酶 LDL 动脉粥样硬化 ■

