肺淋巴管系统在间质性肺疾病中作用机制的研究进展
黄怡 陈伟
间质性肺疾病(Interstitial lung disease,ILD)是一组异质性疾病,以弥漫性肺实质的炎症和纤维化为特征[1],其分类繁多,包括间质性肺炎和特发性肺纤维化等疾病[2]。随着2019年新型冠状病毒(COVID-19)的出现,间质性肺炎成为其住院的最常见原因,并可能进一步导致急性窘迫呼吸综合征,难治性呼吸衰竭和死亡[3]。而继发于严重急性呼吸系统综合症冠状病毒(SARS-CoV)-2的肺纤维化,使得早期进行抗纤维化干预,成为临床关注的重点[4-5],已知淋巴管系统在维持液体稳态和机体正常免疫反应方面发挥重要功能,而肺淋巴管系统已被证明在肺损伤和修复,尤其是在慢性肺部炎症性疾病及肺纤维化中具有重要作用[6-8]。但一直以来有关肺淋巴管系统与间质性肺疾病方面的研究较少,随着科学技术的进步与发展,肺淋巴管系统在间质性肺疾病中的作用逐渐被揭示,本文将对肺淋巴管系统在间质性肺疾病中的研究进展进行综述。
肺淋巴管系统的结构、功能及检测方法
一、肺淋巴管结构
淋巴管在肺中分布较为丰富,肺淋巴管由具有不连续基底膜的淋巴管内皮细胞(lymphatic endothelial cells, LECs)组成[9],肺部集合淋巴管具有瓣膜,但缺乏平滑肌细胞(Smooth muscle cells,SMCs)[10]。人肺部淋巴管伴随主要的气道和呼吸细支气管,它们也存在于小叶内小动脉和小静脉附近(图1)。此外,胸膜下淋巴管网络分布在肺胸膜下。在生理条件下,淋巴管通常不延伸至远端肺泡间隙,小叶内淋巴管可进一步细分为:支气管血管周(与支气管血管束相关),血管周(与血管相关),细支气管周(与细支气管相关)和肺泡间(在肺泡间隔中)淋巴管四种,多数小叶内淋巴管单独或在支气管血管束内都与血管紧密接触,少数与细支气管有关,甚至在肺泡间隔中,也存在小淋巴管,似乎独立于血管或细支气管。小叶间隔的淋巴管通常包含瓣膜,通常与肺静脉相关,并与胸膜淋巴管连接,与支气管血管束相关的大型淋巴管,具有与胸膜和小叶间淋巴管相似的特征,可以被认为是传导性血管。在小叶内发现的大量小血管周淋巴管和少数支气管周淋巴管,可能是肺的吸收室,负责保持肺泡间质相对干燥,以提供最小厚度的气血屏障,从而优化气体扩散[11]。

图1 肺部淋巴管分布示意图[9]
二、肺淋巴管的功能
淋巴管系统是除血液循环系统外人体另一个重要的循环系统,其主要的生理功能是维持机体的体液平衡和免疫监视等。在炎症性疾病中,淋巴管系统发挥调控免疫反应和消除炎症性水肿的作用[12]。有研究表明肺淋巴管比肺中的毛细血管更积极地参与间隙清除[13]。生理状态下,淋巴管内运输富含蛋白质、免疫细胞和长链脂肪酸的淋巴液,维持正常组织间液含量(图2)。肺淋巴管可以将液体、细胞和代谢产物经由淋巴结和淋巴干带回循环系统,保持肺部组织液的稳态。病理状态下,淋巴管系统通过淋巴管增殖促进清除功能,加快排出炎症过程中产生的过量组织液、组织碎片、细胞因子等,具有缓解组织水肿和炎症的作用,淋巴管通过运输免疫细胞及可溶性抗原,参与机体的免疫监控[14]。因此,肺淋巴管系统是维持肺脏正常功能的重要基础。
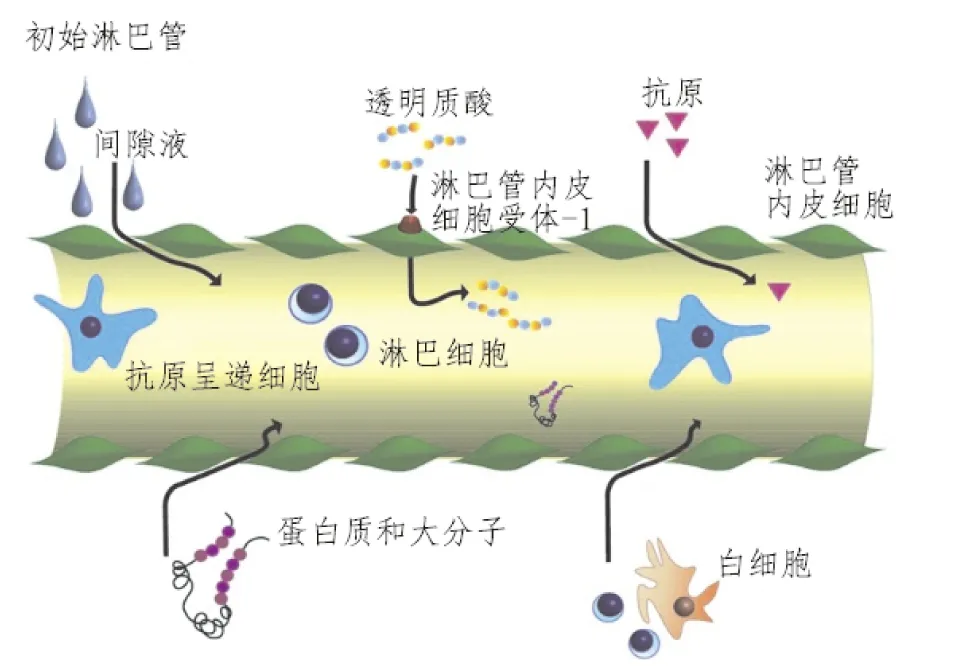
图2 初始淋巴管示意图[9]
三、肺淋巴管检测方法
目前肺部淋巴管的检测方法主要包括免疫组织化学染色技术和淋巴管免疫荧光技术[12]。常用的肺部淋巴管内皮细胞标记物,包括:增强绿色荧光蛋白(Enhanced green fluorescence protein, EGFP)、同源异型盒基因转录因子1(prospero-related homeobox 1,Prox-1)、血管内皮生长因子受体(Vascular endothelial growth factor receptor,VEGFR)-3、趋化因子(CCL)21、神经纤毛蛋白(Neuropilin,NRP)-2、趋化因子诱导受体D6[12-13];Prox1仅存在于淋巴内皮细胞中,是编程淋巴内皮细胞(LEC)表型所需的转录因子。VEGFR -3是血管内皮生长因子(Vascular endothelial growth factor,VEGF)-C和VEGF-D的受体,仅存在于淋巴管中,在血管内皮无法检测到[15]; 研究表明,小鼠肺部淋巴管最有效的标志物是Prox1-EGFP转基因小鼠中的EGFP和VEGFR-3,对小直径淋巴管而言,VEGFR-3的核心受体NRP-2的免疫反应性要强于大淋巴管[8]。在平滑肌细胞中,对α平滑肌肌动蛋白进行染色,可补充淋巴管的染色,可见支气管和大血管的分支结构,平滑肌细胞层在支气管、肺动脉和肺静脉中具有足够的差异,从而可以区分这些结构[16]。淋巴管内皮细胞受体-1(Lymphatic Vessel Endothelial Receptor-1,lyve-1)是透明质酸的CD44同源物和受体,是淋巴管内皮细胞(LECs)的已知表面蛋白,但与其他部位的淋巴管不同的是lyve-1和肾小球足突细胞膜黏蛋白(Podoplanin)被证明不适用于肺淋巴管的染色,因为它们还标记了其他细胞类型[13]。
肺淋巴管系统在间质性肺疾病中的作用
一、肺淋巴管系统在肺间质炎症中的作用
淋巴管生成和淋巴管重塑,是炎症过程中经常出现的复杂生物学过程。肺淋巴管系统作为一个特殊的屏障器官,可通过调控组织液清除率,减少感染等病理性因素所致肺部炎症性渗出的组织浓度,从而保证有效的气体交换与血氧交换。同时,肺淋巴管系统在排出肺间质液方面起关键作用,是肺脏维持正常生理功能的重要基础。当肺部炎症反应加重时,组织液大量的聚集于肺间质,此时肺淋巴管从间质组织中清除组织液和炎症细胞,促使它们通过淋巴管再次回到血液循环,从而减轻肺组织水肿,改善呼吸膜的通透性,改善患者的器官与组织缺氧[17]。在临床研究中,Parra等[18]通过对69例特发性间质性肺炎(Idiopathic interstitial pneumonia, IIP)患者的肺组织进行观察发现IIP患者的肺部有淋巴损伤的发生,且其严重程度根据重塑阶段的进展而增加,因此推断,在IIP患者中浅表淋巴管的破坏,可能会损害肺泡清除,延迟器官修复并导致严重的疾病进展。而肺部淋巴管分布可作为替代标志物,用于识别因IIP死亡风险最大的患者。动物实验研究方面,Reed 等[10]通过对C型凝集素结构域2(C-type lectin-like receptor 2,CLEC2)缺陷型小鼠进行研究发现肺淋巴功能的丧失,会导致肺部出现炎症状态,其特征是第三级淋巴器官(Tertiary lymphoid organs, TLO)的形成,而TLO的形成可能是肺损伤的致病机制,而淋巴功能障碍可能是第三级淋巴器官形成和慢性肺部疾病的发生的机制。因此,肺淋巴管生成,不仅与肺间质炎症症状严重程度密切相关,而且可以显著影响肺间质的炎症过程。
二、肺淋巴管系统在肺纤维化中的作用
肺淋巴管的生成和肺纤维化密切相关,同时肺淋巴管的引流能力是肺纤维化发展的关键。在临床研究中,El-Chemaly等[8]通过对特发性肺纤维化(Idiopathic pulmonary fibrosis, IPF)患者肺组织切片的观察发现,随着疾病严重程度的增加,肺泡淋巴管的平均面积也显著增加,同时发现在患有IPF的受试者的支气管肺泡灌洗液(Bronchoalveolar lavage fluid, BALF)中存在的短片段透明质酸诱导了LECs的迁移和增殖,这是淋巴管形成所必需的过程。Lara等[19]通过图像量化发现,在普通间质性肺炎(Usual interstitial pneumonia, UIP)和非特异性间质性肺炎(Non-specific interstitial pneumonia, NSIP)患者的疾病严重程度及进行性生理功能障碍与肺淋巴管长度增加有关,且肺中淋巴管密度的增加与成纤维细胞网状组织(即组织性和纤维化胶原蛋白)密切相关。Ebina等[20]发现IPF患者肺部胸膜下和小叶间淋巴管均严重受损。在动物实验研究中,Cui等[21]发现在辐射诱发的小鼠肺纤维化模型中,电离辐射后1周,胸膜下和肺间质中淋巴管密度降低,并在第16周开始出现纤维化;Baluk等[7]研究发现肺淋巴管网的扩张可以减少淋巴淤滞,并能够增加液体和细胞(包括纤维化巨噬细胞)的清除率,从而减轻了博来霉素刺激的肺中巨噬细胞的累积,并加速了肺纤维化的恢复。Meinecke 等[22]研究发现在博来霉素诱导的小鼠肺间质纤维化模型中,异常募集到肺淋巴管中的壁膜细胞能够通过阻止淋巴管排出大分子(尤其是肺损伤和修复的关键分子——透明质酸)来影响肺纤维化的进展,因此,淋巴管的引流能力也是肺纤维化发展的关键。
三、肺淋巴管系统在职业和环境因素引起的间质性肺疾病中的作用
淋巴管的生成主要是靠LECs的增殖完成的,LECs的增殖受多种信号通路的调控,其中VEGF-C/VEGFR-3是淋巴管生成的最有效的关键信号途径,VEGF-C是VEGF生长因子家族的成员,在生理和病理状态下,都是淋巴管形成和生长的主要调节剂[23]。Yu等[24]研究发现药物能够通过激活VEGF-C/VEGFR-3信号通路来促进肺淋巴管的生成,改善淋巴管的转运功能,提高气管支气管淋巴结和血清中的硅含量,从而改善矽肺大鼠肺内二氧化硅的淋巴运输,减轻矽肺的病理改变。因此淋巴管系统在职业因素引起的ILD的治疗中起重要作用。
小结与展望
肺间质水肿和肺部结构的纤维化改变是间质性肺疾病最重要的病理特征,其破坏了肺部的有效通气和血氧交换能力,肺淋巴管可以将液体、细胞和代谢产物经由淋巴结和淋巴干带回循环系统,从而保持肺部组织液的稳态[10]。肺淋巴管系统参与了间质性肺疾病炎症到纤维化发生发展的全过程。已有研究表明,在肺部急性和慢性炎症性情况下,淋巴管生成,促进组织水肿的消退和炎症细胞的转运[25-26],从而防止肺纤维化的发生和加重,从肺淋巴管系统入手进行干预有望成为治疗间质性肺疾病,防治肺纤维化的新的治疗手段。

