大黄酸对脑缺血再灌注损伤的影响及潜在机制研究
田庆鑫 张明晓 刘建龙
缺血性脑卒中是世界范围内严重致残和导致死亡的主要原因[1]。脑血流量下降会导致脑缺氧和葡萄糖供应不足,从而导致脑缺血。血液供应恢复会产生过多的活性氧和炎症反应,可能会诱发脑缺血再灌注损伤(cerebral ischemia-reperfusion injury,CIRI),加重脑损伤[2-3]。CIRI包含兴奋毒性、氧化应激、炎症和凋亡等病理过程[4]。有效的抗炎和抗凋亡药物,可以抑制促炎性细胞因子的产生和炎症诱导的细胞凋亡,改善CIRI[5]。大黄酸是一种天然的蒽醌化合物,其从大黄中分离,参与许多生物学活动,包括抑制活性氧、下调细胞内钙浓度、促进微循环功能、抑制中性粒细胞迁移和抗炎作用[6-7]。CIRI期间血脑屏障被破坏,既往研究表明大黄酸能够穿过被破坏的血脑屏障,抑制脑梗死并改善神经功能评分[8]。大黄酸可能在抗CIRI中发挥有益作用。然而,大黄酸对CIRI保护作用的信号传导机制尚未明确。本研究通过大鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)及体外细胞氧-葡萄糖剥夺与恢复(oxygen-glucose deprivation and recovery,OGD/R)模型探讨大黄酸对CIRI的影响及潜在机制,现将结果报道如下。
1 材料和方法
1.1 实验动物和细胞培养 选择SPF雄性SD大鼠60只,8~10周龄,250~280 g,购自上海西普尔必凯实验动物有限公司[许可证号:SCXK(沪)2013-0016]。大鼠饲养于22~24℃恒温,12 h光照/12 h暗循环环境,自由获取标准水和饲料。本研究方案经本院实验动物伦理委员会批准,动物喂养及实验操作均符合国家科学技术委员会颁布的《实验动物管理条例》。人神经母细胞瘤(SH-SY5Y)细胞购于中国科学院细胞库。将SH-SY5Y细胞置于完全培养基(含10%FBS、100 IU/ml青霉素和 100 μg/ml链霉素的 DMEM/F12)中,于37℃、5%CO2环境中培养。
1.2 主要试剂 大黄酸(纯度≥96%)、氯吡格雷、羧甲基纤维素钠(sodium carboxymethyl cellulose,CMCNa)和二甲基亚砜(dimethyl sulfoxide,DMSO)购自国药集团化学试剂有限公司。IL-6、IL-1β和TNF-α ELISA检测试验盒购自南京凯基生物技术公司。磷酸化磷脂酰肌醇-3-羟激酶(phospho-phosphatidylinositol 3-hydroxy kinase,p-PI3K)、磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)、磷酸化蛋白激酶B(phospho-protein kinase B or phospho-AKT kinase,p-AKT)、蛋白激酶B(protein kinase B or AKT kinase,AKT)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、磷酸化哺乳动物雷帕霉素靶蛋白(phospho-mammalian target of rapamycin,p-mTOR)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自细胞信号技术公司。2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)和四甲基偶氮唑蓝(methlthiazoletrazolium,MTT)购自美国Sigma公司。放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解液、二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒购自上海碧云天生物技术有限公司。
1.3 方法
1.3.1 CIRI模型构建 采用随机数字表法将大鼠分为CIRI组、CIRI+氯吡格雷组、CIRI+10 mg/kg大黄酸组、CIRI+20 mg/kg大黄酸组、假手术组(Sham组)5组,每组12只。其中CIRI+氯吡格雷组、CIRI+10 mg/kg大黄酸组、CIRI+20 mg/kg大黄酸组分别给予氯吡格雷7.5 mg·kg-1·d-1、大黄酸 10 mg·kg-1·d-1或 20 mg·kg-1·d-1灌胃,两种药物均溶于0.5%CMC-Na溶液。Sham组和CIRI组给予0.5%CMC-Na溶液灌胃给药。给药频率均为1次/d,连续7 d。除Sham组外,其他组大鼠采用线栓法通过MCAO构建大鼠CIRI模型:麻醉大鼠并手术暴露颈内动脉、右侧颈总动脉和颈外动脉,结扎颈总动脉和颈外动脉,在颈总动脉近分叉处剪口将尼龙线栓插入,直至遇到轻微阻力停止插线,线栓插入深度为18 mm,闭塞右侧大脑中动脉腔内致局灶性脑缺血2 h后,缓慢拔除尼龙线栓,恢复大脑中动脉血供,使血流再灌注24 h。Sham组大鼠采用相同的手术步骤,但不闭塞大脑中动脉。
1.3.2 神经功能缺损评分的比较 缺血再灌注24 h后,采用盲法五分制评分法检测5组大鼠神经功能缺损情况,系统评分如下:无缺损为0分;未能充分伸展手术对侧(左侧)躯干和前肢为1分;被提起尾巴时躯干转向左侧为2分;行走困难,向左侧瘫倒为3分;意识不清,不能自发行走为4分。
1.3.3 大鼠的血清和脑组织中促炎性细胞因子水平测定 所有大鼠采用异氟烷麻醉后摘除一侧眼球取血,血液离心15 min,获得上清液;大鼠脑组织制成10%的匀浆,离心后取上清液待测。采用ELISA法检测大鼠的血清和脑组织中促炎性细胞因子的水平,包括IL-6、IL-1β和TNF-α。操作按ELISA试剂盒说明,在450 nm处测定各反应孔样品的吸光度(optical density,OD)值,IL-6、IL-1β 和 TNF-α 水平与 OD450值之间呈正比,通过绘制标准曲线求出标本中各促炎性细胞因子水平。
1.3.4 大鼠脑梗死区和脑水肿比例的测定 取血后立即采用随机数字表法从5组大鼠中各抽取5只,采用颈椎脱臼法处死,剥离大鼠大脑颅骨,分离出脑组织,放在脑切片模具上,将大鼠大脑冠状面切成2 mm厚切片(除去前端嗅球和后端小脑,每只大鼠大脑缺血再灌注部分可切为5片),以2%TTC在37℃条件下孵育30 min。正常的脑组织被染成红色,而梗死区域的脑组织未被染色,观察染色的脑切片。采用图像处理软件image-pro Plus 6.0标定和计算梗死面积比例,脑梗死面积比例=[左侧大脑半球面积-(右侧大脑半球面积 -梗死灶面积)]/左侧大脑半球面积×100%。采用相同方法从5组大鼠中各再抽取5只并处死,迅速切除大脑并置于冰上,立即称取脑组织湿重(ww),60℃干燥48 h得到干重(dw)。计算脑水肿比例,脑水肿比例(%)=[(ww-dw)/(ww)]×100%。
1.3.5 体外OGD/R模型的建立 将SH-SY5Y细胞分为8组,分别为:OGD/R组、大黄酸给药组(10、20、40、80、160、320 μM 大黄酸组)、对照组(Con组)。将细胞以5×103/孔的密度接种到96孔板中24 h,然后将OGD/R组、大黄酸给药组生长良好的SH-SY5Y细胞置于无血清和无葡萄糖培养基,于37℃、94%N2、5%CO2和1%O2厌氧室中培养6 h。氧糖剥夺处理后,更换完全培养基,于37℃、5%CO2中氧糖恢复培养6 h,其中大黄酸给药组分别加入上述不同浓度的大黄酸溶液孵育。结合文献,造模后细胞存活率在30%~60%,即造模成功[9]。同时,Con组细胞置于完全培养基中,于含有37℃、5%CO2的正常培养箱中培养。
1.3.6 SH-SY5Y细胞活力测定 使用MTT试验测定SH-SY5Y细胞活力。体外OGD/R模型的建立后,96孔板中每孔细胞添加20 μl MTT(5 mg/ml)工作溶液,然后在37℃下再孵育4 h。除去介质,并将染料晶体溶于150 μl DMSO中。用微孔板分光光度计在490 nm处检测每孔细胞的吸光度值。按以下公式计算细胞活力:细胞活力(%)=A/A0×100%(A为实验组吸光度值、A0为Con组吸光度值)。
1.3.7 SH-SY5Y细胞促炎性细胞因子水平测定 收集SH-SY5Y细胞培养上清液,根据ELISA试剂盒说明,采用与上述大鼠的血清和脑组织中促炎性细胞因子水平测定相同步骤,使用ELISA试剂盒检测SHSY5Y细胞中促炎性细胞因子(包括IL-6、IL-1β和TNF-α)的水平。
1.3.8 大鼠脑组织中和SH-SY5Y细胞中PI3K/AKT/mTOR通路相关蛋白水平检测 采用Western blot方法,将大鼠脑组织和SH-SY5Y细胞置于含0.1%苯基甲基磺酰氟的冰冷RIPA裂解液中匀浆提取总蛋白,用BCA蛋白检测试剂盒测定蛋白浓度。用10%含十二烷基硫酸钠的变性聚丙烯酰胺凝胶电泳分离蛋白并转移至聚偏二氟乙烯(polyvinylidenefluoride,PVDF)膜,室温下在5%脱脂牛奶中封闭2 h。然后将PVDF膜与一抗 p-PI3K(1∶500稀释)、PI3K(1∶500稀释)、p-AKT(1∶1 000 稀释)、AKT(1∶1 000 稀释)、p-mTOR(1∶5 000 稀释)、mTOR(1∶5 000 稀释)和 GAPDH(1∶2 000稀释)在4℃下孵育过夜。用含有 0.1%Tween-20的Tris缓冲盐溶液 [Tris-buffered saline(TBS)containing 0.1%Tween-20,TBST]洗涤 3次后,将 PVDF膜与辣根过氧化物酶缀合的山羊抗兔免疫球蛋白G二抗(1∶1 000稀释)在室温下孵育1 h。免疫反应条带与增强的化学发光试剂盒相互作用,并在凝胶成像系统上可视化。
1.4 统计学处理 采用SPSS 20.0统计软件。计量资料以表示,组间比较采用单因素方差分析,两两比较采用Tukey事后检验。P<0.05为差异有统计学意义。
2 结果
2.1 5组大鼠神经功能缺损评分比较 CIRI组大鼠神经功能缺损评分为(3.42±0.51)分,高于Sham组(0.00分),差异有统计学意义(P<0.01)。CIRI+氯吡格雷组、CIRI+10 mg/kg大黄酸组和CIRI+20 mg/kg大黄酸组神经功能缺损评分分别为 (1.50±0.52)、(1.92±0.67)、(1.58±0.51)分,均低于 CIRI组,差异均有统计学意义(均 P<0.01)。
2.2 5组大鼠血清和脑组织中的促炎性细胞因子水平比较 见表1。
由表 1可见,CIRI组血清和大脑中IL-1β、IL-6和TNF-α水平均高于Sham组,差异均有统计学意义(均P<0.01)。CIRI+氯吡格雷组、CIRI+10 mg/kg大黄酸组、CIRI+20 mg/kg大黄酸组血清和大脑中IL-1β、IL-6和TNF-α水平均低于CIRI组,差异均有统计学意义(均 P<0.05)。
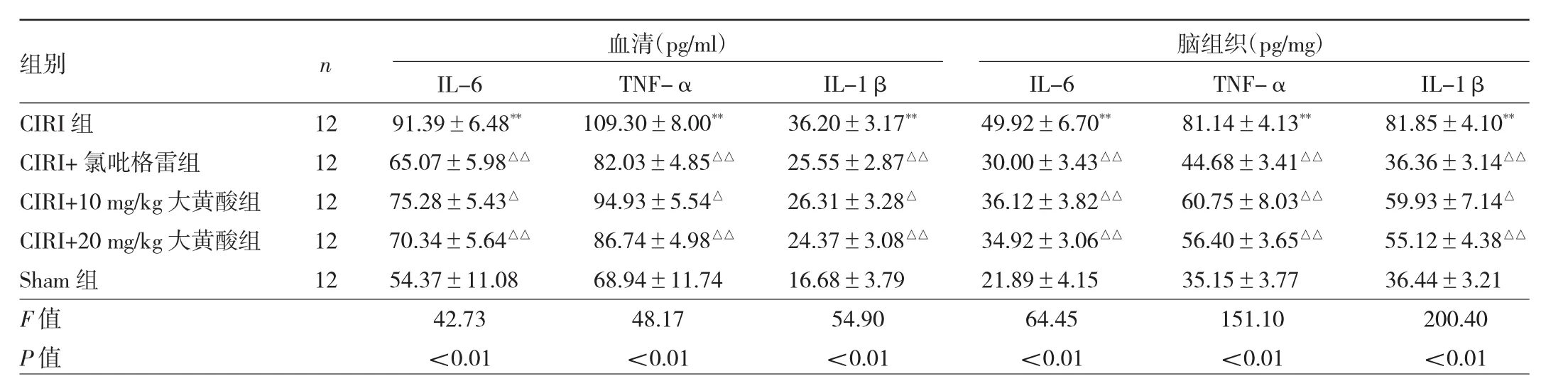
表1 5组大鼠血清和脑组织中的促炎性细胞因子水平比较
2.3 5组大鼠脑梗死区面积和脑水肿比例比较 见表2。
由表2可见,CIRI组大鼠的脑梗死区面积百分比和脑水肿比例均高于Sham组,差异均有统计学意义(均P<0.01)。CIRI+氯吡格雷组、CIRI+10 mg/kg大黄酸组、CIRI+20 mg/kg大黄酸组脑梗死面积和脑水肿比例低于CIRI组,差异均有统计学意义(均P<0.05)。5组大鼠脑梗死切片比较见图1。
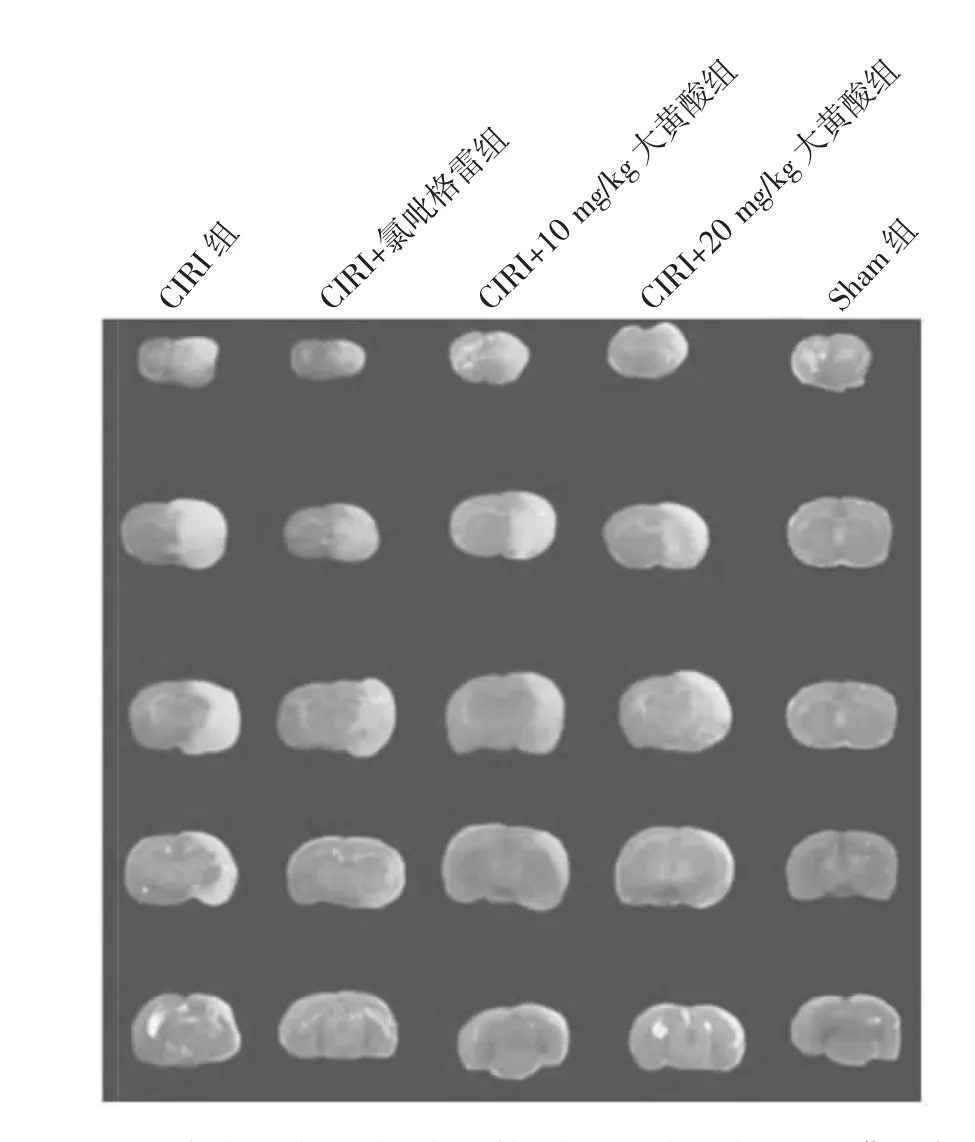
图1 5组大鼠脑梗死切片比较(CIRI为脑缺血再灌注损伤;Sham为假手术)

表2 5组大鼠脑梗死区面积和脑水肿比例比较(%)
由图1可见,Sham组大鼠脑组织被染为均匀红色,未见明显梗死区域;其他各组均出现不同程度的梗死区域,其中CIRI组大鼠的脑组织梗死区域最大。CIRI+氯吡格雷组、CIRI+10 mg/kg大黄酸组、CIRI+20 mg/kg大黄酸组脑梗死区域均小于CIRI组。
2.4 SH-SY5Y细胞的细胞活力比较 OGD/R组SHSY5Y细胞活力为(49.50±7.67)%,低于 Con组(102.90±4.59)%,差异有统计学意义(P<0.01)。10、20 和 40 μM大黄酸组SH-SY5Y细胞的细胞活力分别为(71.53±4.99)% 、(83.93±3.12)%、(83.80±5.47)%,均高于OGD/R 组,差异均有统计学意义(均 P<0.01)。80、160和320 μM大黄酸组SH-SY5Y细胞的细胞活力分别为(64.13±3.29)%、(63.43±3.55)%及(61.74±3.61)%,与OGD/R组比较,差异均无统计学意义(均P>0.05)。故选择浓度为10、20、40 μM的样品进行体外细胞实验。
2.5 5组SH-SY5Y细胞上清液中促炎性细胞因子水平比较 见表3。

表3 5组SH-SY5Y细胞上清液中促炎性细胞因子水平比较(pg/ml)
由表3可见,OGD/R组 IL-6、TNF-α和 IL-1β水平均高于Con组,差异均有统计学意义(均P<0.01);10、20、40 μM 大黄酸组 IL-6、TNF-α 水平均低于OGD/R 组,20、40 μM 大黄酸组 IL-1β 水平均低于OGD/R组,差异均有统计学意义(均P<0.05)。
2.6 5组大鼠脑组织和SH-SY5Y细胞中PI3K/AKT/mTOR通路相关蛋白表达比较 见图2。
由图2可见,CIRI组大鼠p-PI3K、p-AKT和 pmTOR蛋白表达水平均较Sham组下调,CIRI+10 mg/kg大黄酸组、CIRI+20 mg/kg大黄酸组p-PI3K、p-AKT和p-mTOR蛋白表达水平较CIRI组上调。OGD/R组的SH-SY5Y细胞p-PI3K、p-AKT和p-mTOR蛋白表达水平均较Con组下调。10、20、40 μM大黄酸组SHSY5Y细胞p-PI3K、p-AKT和p-mTOR蛋白表达水平较OGD/R组上调。
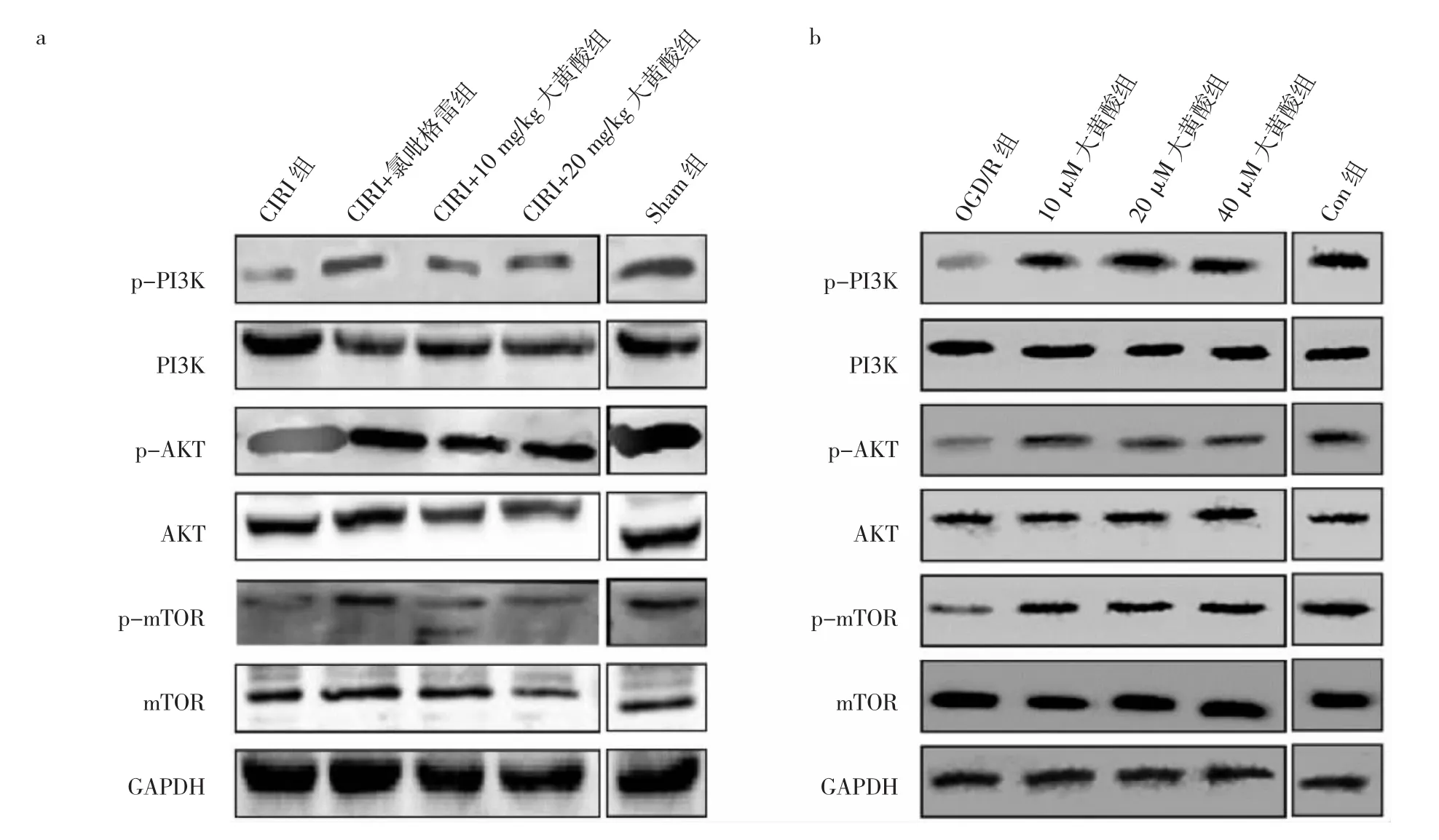
图2 5组大鼠和人神经母细胞瘤(SH-SY5Y)细胞中磷脂酰肌醇-3-羟激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(PI3K/AKT/mTOR)通路相关蛋白表达比较[a:5组脑缺血再灌注损伤(CIRI)大鼠脑组织中PI3K/AKT/mTOR通路相关蛋白表达电泳图;b:5组SH-SY5Y细胞中的PI3K/AKT/mTOR通路相关蛋白表达电泳图;Sham为假手术;p-PI3K为磷酸化磷脂酰肌醇-3-羟激酶;p-AKT为磷酸化蛋白激酶B;p-mTOR为磷酸化哺乳动物雷中的霉素靶蛋白;GAPDH为内参;OGD/R为氧-葡萄糖剥夺与恢复;Con为对照]
3 讨论
近年来,越来越多证据表明,脑缺血会引发炎症反应[10]。脑缺血后,缺血损伤区存在多种细胞因子表达、炎性细胞浸润和氧自由基反应,可加速缺血后细胞损伤[7,10]。灌注不足和局部缺血后脑循环的恢复可能导致内皮功能障碍和神经功能受损,本研究选择MCAO模型模拟大鼠CIRI,先前研究显示MCAO模型中神经系统评分和脑梗死体积增加[11]。本研究发现大黄酸可减轻缺血大鼠的神经功能缺损,减小脑梗死面积和脑水肿比例,提示大黄酸可能可以减轻CIRI,这与先前的研究一致[12]。
大黄酸作为大黄的一种生物活性化合物,已用于治疗脑损伤,但其药理机制仍不清楚[12-13]。近期研究提示大黄酸在神经炎症体外模型中显著降低了炎症因子的表达,包括 TNF-α、IL-1β、IL-6、IL-12 和诱生型一氧化氮合酶[13]。有研究表明,促炎性细胞因子如TNF-α、IL-1β和IL-6可能刺激许多下游的氧自由基、细胞因子、溶酶体酶和其他炎症介质,并导致CIRI[11]。越来越多证据表明,促炎性细胞因子(如TNF-α、IL-1β和IL-6)的含量在缺血再灌注后升高,表明炎症在缺血再灌注损伤中起着至关重要的作用[14]。本研究证明了大黄酸可以抑制MCAO诱导的大鼠或OGD/R诱导的SH-SY5Y细胞中大量产生的IL-6、IL-1β 和 TNF-α。
本研究评估了关键的神经炎症相关信号通路来探讨大黄酸潜在的抗神经炎症机制。已有研究表明,PI3K/AKT/mTOR信号传导途径是关键的神经保护信号通路之一,PI3K/AKT信号通路在炎症和氧化应激等多种生理过程中发挥重要作用[15]。同时,先前已有研究表明,PI3K/AKT/mTOR通路的激活对炎症起关键作用[16]。PI3K/AKT可抑制NF-κB的活化,从而最终防止炎症的发生,因为促炎性细胞因子TNF-α、IL-1β、IL-6和IL-8的合成是由NF-κB介导的[17]。PI3K/AKT通路的激活已被证实可减少炎症基因,进而保护血管功能,其在脑缺血中的神经保护作用已被广泛研究[18]。活化的AKT可快速激活mTOR等多种分子功能,mTOR是一个多功能的收集点,可调节细胞营养、能量供应并促进蛋白质合成。考虑到PI3K/AKT通路的神经保护作用,推测脑缺血后PI3K/AKT/mTOR通路可能失活。在本文中,大黄酸可激活MCAO大鼠或OGD/R诱导的 SH-SY5Y细胞中的 p-PI3K、p-AKT和 pmTOR,提示大黄酸对神经炎性介质产生的调节可能是通过激活PI3K/AKT/mTOR通路完成的。
综上所述,本研究提示,大黄酸在体内和体外有效地减弱了CIRI,其潜在机制可能与PI3K/AKT/mTOR通路参与抗炎作用有关。这些结果表明,大黄酸可能可作为脑缺血再灌注损伤的潜在治疗药物。

