miR-30a对脂多糖诱导人脐静脉血管内皮细胞自噬的影响
王丽君 赵瑜 胡烨 郭君平 张炜
miRNAs是一类广泛存在于真核生物体的非编码小RNA分子,其生物学效应广泛,参与人体的生长发育、炎症、免疫和肿瘤发生、发展等各个方面,是近年来的研究热点[1]。miR-30a是miRNAs家族中的一员,在细胞生长和凋亡等多方面发挥重要的调节作用,与自噬关系尤为密切[2],但目前miR-30a相关研究主要集中于肿瘤相关领域[3],而对于其在炎症模型中的作用却知之甚少。在之前的研究中,笔者发现自噬在脂多糖(lipopolysaccharide,LPS)诱导血管内皮细胞(vascular endothelial cell,VEC)炎症模型的炎症调控中扮演了重要角色[4],而关于miR-30a是否也参与其中以及又是如何调控的,目前尚不清楚。因此,本研究探究miR-30a对LPS诱导人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVEC)自噬的影响及其可能机制,现报道如下。
1 材料和方法
1.1 实验材料 LPS购自美国Sigma公司;DMEM/F12培养基和FBS均购自美国Gibco公司,细胞转染载体Lipofectamine 2000和总RNA提取试剂Trizol均购自美国Invitrogen公司,反转录试剂盒与荧光定量PCR试剂盒均购自大连宝生物有限公司,细胞转染质粒miR-30a-mimic和miR-30a-NC均购自广州锐博生物公司,CCK-8试剂盒、BCA试剂盒均购自上海碧云天科技有限公司;兔抗人自噬相关基因(autophagy related gene 3,Atg3)抗体、泛素结合蛋白p62抗体、自噬蛋白微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)抗体、β-actin抗体和羊抗兔二抗均购自英国Abcam公司;绿色荧光点-LC3(green fluorescence point-LC3,GFP-LC3)慢病毒质粒购自上海汉恒生物科技有限公司,HUVEC细胞购自上海奥赛尔斯生物技术有限公司。
1.2 细胞培养、分组和转染 细胞培养:使用含10% FBS和1%双抗的DMEM/F12培养基处理HUVEC细胞,细胞置于37℃、5% CO2恒温培养箱中,每隔24 h至于倒置光学显微镜下观察细胞的生长,取对数生长期的细胞用于实验。实验分组:(1)LPS组:HUVEC细胞给予LPS 20 μg/ml刺激 24 h(模拟炎症,激活自噬);(2)NC组:HUVEC细胞加入miR-30a-NC转染后再给予LPS 20 μg/ml刺激 24 h;(3)mimics 组:HUVEC 细胞加入miR-30a-mimics转染后再给予LPS 20 μg/ml刺激24 h;(4)正常对照组(Control组):HUVEC细胞不予任何处理。细胞转染:HUVEC细胞以每孔2×105个接种于6孔板中,培养至细胞密度70%左右,NC组和mimics组应用Lipofectamine 2000分别转染miR-30a-NC和miR-30a-mimics,转染方法参考试剂盒说明书,转染后细胞继续常规培养。
1.3 细胞增殖能力检测 采用CCK-8法。取对数生长期的HUVEC细胞,按3 000个/孔接种于96孔板,待细胞完全贴壁后,更换培养液并按分组处理继续培养24 h,每孔加入10 μl CCK-8工作液,培养1 h后用酶标仪测定在450 nm处的光密度(OD)值,并计算细胞存活率。细胞存活率(%)=(实验组OD值-空白孔OD值)/(空白组OD值-空白孔OD值)×100%。
1.4 miR-30a相对表达量检测 采用qRT-PCR法。将处理后的各组HUVEC细胞收集,采用Trizol法提取总RNA,测定总RNA浓度,取等量RNA反转录合成cDNA,采用SYBR Green进行 qRT-PCR,参照 qRT-PCR试剂盒配置相应的体系进行扩增,其中引物序列如下:miR-30a上游引物:5'-CACTCTCATGTAAACATCCTCGAC-3',下游 引 物 :5'-TATGGTTTTGACGACTGTGTGAT-3',内参U6上游引物:5'-CTCGCTTCGGCAGCACA-3',下游引物:5'-AACGCTTCACGAATTTGCGT-3',扩增条件如下:95℃30 s预变性(1个循环),95℃5 s,60℃30 s共40个循环,实验完成后用2-ΔΔCt法计算miR-30a的相对表达量。
1.5 Atg3、p62、LC3-Ⅱ/LC3-Ⅰ等自噬相关蛋白表达水平检测 采用Western blot法。收集实验处理后的各组细胞,细胞充分裂解后提取总蛋白,BCA法测定总蛋白含量,聚丙烯酰胺凝胶电泳分离蛋白,湿法转移至PVDF膜上,5%脱脂奶粉室温下封闭1 h,TBST充分洗涤后加入一抗(Atg3、p62、LC3、β-actin,1∶1 000)4 ℃摇床过夜,TBST充分洗涤后加入二抗(1∶5 000)室温孵育1 h,ECL化学发光法检测蛋白的表达情况,再用ImageJ软件进行定量分析。
1.6 免疫荧光观察细胞自噬小体形成 各组细胞用GFP-LC3慢病毒质粒转染细胞24 h,更换培养液按分组处理继续培养24 h,在激光共聚焦荧光显微镜下观察细胞内自噬小体情况。
1.7 统计学处理 采用SPSS 24.0统计软件。计量资料以表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 LPS刺激后两组细胞存活率和miR-30a相对表达量比较 LPS组细胞存活率明显低于Control组,miR-30a相对表达量明显低于Control组,差异均有统计学意义(均 P<0.05),见表 1。
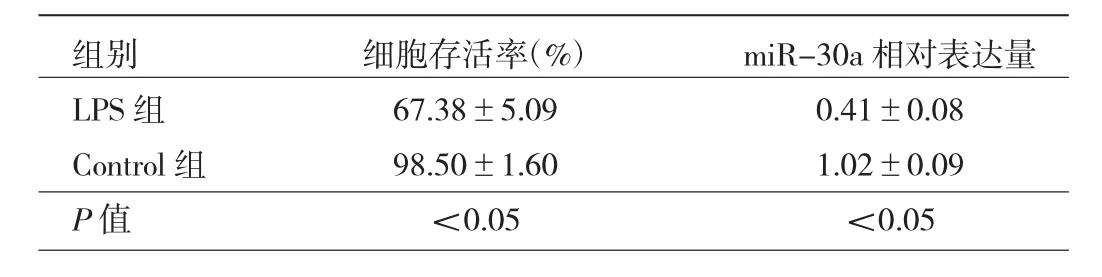
表1 LPS刺激后两组细胞存活率和miR-30a相对表达量比较
2.2 LPS刺激后两组细胞自噬相关蛋白表达水平比较 与Control组比较,LPS组细胞p62蛋白表达水平降低,Atg3蛋白表达水平升高,LC3-Ⅱ/LC3-Ⅰ比值升高,差异均有统计学意义(均P<0.05),见图1、表2。
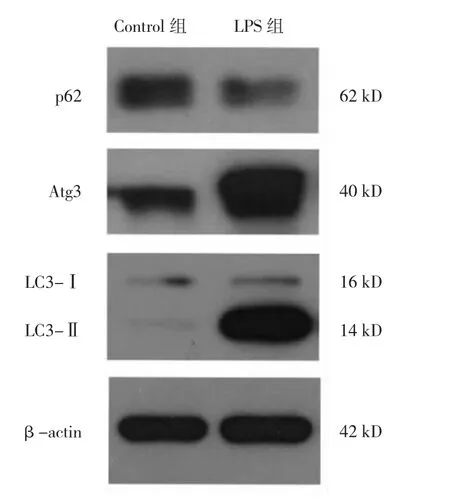
图1 脂多糖(LPS)刺激后两组细胞自噬相关蛋白表达的电泳图(Atg3为自噬相关基因3;LC3为自噬蛋白微管相关蛋白1轻链3)

表2 LPS刺激后两组细胞自噬相关蛋白表达水平比较
2.3 转染miR-30a后LPS刺激3组细胞存活率和miR-30a相对表达量比较 转染miR-30a后,与LPS组比较,mimics组细胞存活率明显升高,miR-30a相对表达量明显上升,差异均有统计学意义(均P<0.05),见表3。

表3 转染miR-30a后LPS刺激3组细胞存活率和miR-30a相对表达量比较
2.4 转染miR-30a后LPS刺激3组细胞自噬相关蛋白表达水平比较 转染miR-30a后,与LPS组比较,mimics组细胞p62表达水平升高,LC3-Ⅱ/LC3-Ⅰ比值和Atg3表达水平降低,差异均有统计学意义(均P<0.05),见图 2、表 4。

图2 转染miR-30a后3组细胞p62、自噬相关基因3(Atg3)、自噬蛋白微管相关蛋白1轻链3(LC3)-Ⅱ和LC3-Ⅰ蛋白表达的电泳图

表4 转染miR-30a后3组细胞p62、Atg3、LC3-Ⅱ和LC3-Ⅰ蛋白表达水平比较
3 讨论
VEC是覆盖于血管内膜表面的单层细胞,能通过分泌多种血管活性物质对各种信号作出反应,对维持心血管系统稳态也具有十分重要的意义[5]。当VEC受到各种刺激或损伤时,细胞会产生适应性自噬,并通过溶酶体吞噬降解受损细胞器和异常蛋白质,为细胞提供营养物质,维持血管稳态[6],这种程度的自噬往往是有益的;但当刺激持续存在或刺激强度过大时,细胞可能会发生过度的自噬而导致细胞死亡和细胞凋亡,血管稳态失衡[7],这种自噬往往是有害的,因此调控自噬有可能成为动脉粥样硬化治疗的新靶点。miRNAs广泛参与基因表达调控,可通过调控自噬过程中关键蛋白的表达,进而参与动脉粥样硬化的发病过程,具有重要调节作用[7]。
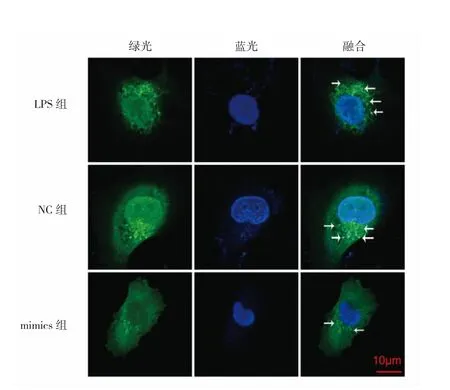
图3 转染miR-30a后3组细胞自噬小体(箭头所示绿色荧光点)变化的激光共聚焦图(LPS为脂多糖)
miR-30a是与自噬关系最为密切的miRNAs之一。在多种肿瘤细胞模型中,miR-30a能通过靶向调控自噬相关基因Beclin1表达影响肿瘤细胞自噬活性,从而影响肿瘤的增殖、侵袭和耐药等各个方面[8-9];在哮喘模型中,miR-30a能通过下调自噬相关基因5来抑制自噬,在气道重塑中发挥抗纤维作用[10];在急性肺损伤炎症模型中,miR-30a能通过靶向调控人类runt相关转录因子2减轻LPS诱导的A549损伤和小鼠肺损伤[11]。本实验结果显示,LPS处理后HUVEC细胞miR-30a相对表达水平下降,细胞活力降低,自噬水平增加(自噬的选择性底物p62蛋白表达水平降低),说明LPS诱导HUVEC炎症模型中存在过度自噬,与之前报道文献相一致[12];而进一步用miR-30a-mimics过表达处理上调miR-30a水平后,发现这种LPS诱导的过度自噬明显被抑制,细胞活力明显回升,提示miR-30a能通过抑制过度自噬来减轻LPS诱导HUVEC损伤。
细胞自噬激活后主要受Atg调控[13]。其中Atg3是一个调控自噬的类泛素化的蛋白基因,主要参与自噬体延伸过程中的第2个泛素样通路,促进LC3和脂分子磷脂酰乙醇胺的结合,并在LC3-Ⅱ的形成中发挥重要作用[14],LC3-Ⅱ是自噬标志性蛋白,其含量与自噬泡数量呈正相关,LC3-Ⅱ/LC3-Ⅰ也是评估自噬水平高低的经典指标[15];此外Atg3也参与了自噬蛋白的翻译后磷酸化、乙酰化等多种修饰过程[16]。在非小细胞肺癌细胞模型中,沉默Atg3可减轻自噬活性,通过上皮细胞间质转化影响肿瘤侵袭[17];而在乳腺癌细胞模型中,过表达Atg3能够通过细胞自噬抑制盐霉素诱导的乳腺癌细胞凋亡[18];在肝癌细胞模型中,miR-30a可靶向调控Atg3介导的自噬抑制肝癌细胞的侵袭和转移[19]。本实验结果显示,LPS作用于HUVEC后,Atg3蛋白表达水平增加,LC3-Ⅱ/LC3-Ⅰ比值升高;而进一步用miR-30a-mimics过表达处理上调miR-30a水平后,Atg3蛋白表达下降,LC3-Ⅱ/LC3-Ⅰ比值降低,GFPLC3单荧光自噬体系也直观的发现自噬小体明显减少,提示miR-30a能抑制自噬来减轻LPS诱导HUVEC损伤。但由于自噬受多种基因和蛋白的调控,miRNA只是众多可能的调节因素之一,其他如lncRNA和circRNA等诸多因素都可能牵涉其中[20],具体miR-30a是如何调控自噬,以及是否还有其它的具体调控因素和潜在机制都还有待进一步研究证实。
综上所示,过表达miR-30a能抑制LPS诱导HUVEC产生的过度自噬,从而减轻细胞损伤。因此,miR-30a可能是用于调控血管内皮炎症损伤的新治疗靶点。

