马铃薯茎段和叶片再生体系建立
张冬梅,修志君,冯亚艳,杨春芳,王丽玮,刘 洁,张笑宇
(1.内蒙古农业大学 园艺与植物保护学院,内蒙古 呼和浩特 010020;2.包头市园林绿化事业发展中心,内蒙古 包头 014000)
马铃薯(Solanum tuberosumL.)是一年生草本植物,是仅次于水稻、小麦、玉米的第四大粮食作物[1].我国作为世界马铃薯生产第一大国,随着马铃薯产业的快速发展,急需特色、优质的新品种[2].传统育种方法,很难达到产量、品质和抗性的大幅度提高[3],以改良基因、创造新品种为战略目标的植物基因工程技术越来越受重视,使马铃薯基因的遗传改良和育种工作取得质的飞跃,为培育马铃薯新品种提供了可能[4-5].
植物基因工程中,组织培养再生是遗传转化体系的建立、突变体的筛选、优良种苗的快速繁殖及体细胞杂交等技术的前提和基础[5].马铃薯再生体系要经过愈伤组织的诱导和分化过程,易受基因型[6-7]、外植体种类[8]、植物激素种类及浓度[9-10]影响,同时光照时间、温度等外界环境因素也会不同程度地影响愈伤组织形成及其再分化[11-12].马铃薯组织培养再生是一个十分复杂的过程,没有可普遍应用的再生体系,不同马铃薯品种遗传转化之前都要先建立相应的再生体系[13],再生体系对农杆菌介导的有效遗传操作和获得稳定表达的转基因株系均具有重要的理论和实践意义.目前存在马铃薯的再生诱导率低、质量不稳定、试验重复性差等问题[8],因此,对于马铃薯的愈伤组织诱导及再生体系还需进一步优化.
笔者以大西洋脱毒试管苗为试验材料,对其茎段和叶片的再生体系进行研究,筛选愈伤组织形成及芽诱导培养基,优化最佳激素配方,以期获得高效愈伤组织诱导率和分化率的培养体系,为建立大西洋再生体系和马铃薯遗传转化体系奠定理论基础,为马铃薯的基因工程育种、品种改良、基因功能研究提供技术基础.
1 材料与方法
1.1 试验材料
供试马铃薯材料为培养28 d生长良好的大西洋(Atlantic)脱毒试管苗,是经茎尖剥离、病毒检测的无毒组培苗,保存在内蒙古农业大学园艺与植物保护学院植物病理实验室.
供试培养基为Murashige and Skoog(MS)培养基:硝酸钾(KNO3)1.9 g,硝酸铵(NH4NO3)1.65 g,磷酸二氢钾(KH2PO4)0.17 g,硫酸镁(MgSO4·7H2O)0.37 g,无水氯化钙(CaCl2)0.332 g;碘化钾(KI)0.008 3 g,硼酸(H3BO3)0.062 g,硫酸锰(MnSO4·4H2O)0.223 g,硫酸锌(ZnSO4·7H2O)0.086 g,钼酸钠(Na2MoO4·2H2O)0.002 5 g,硫酸铜(CuSO4·5H2O)0.002 5 g,氯化钴(CoCl2)0.000 25 g;乙二胺四乙酸二钠0.037 3 g,硫酸亚铁0.278 g;肌醇10 g,甘氨酸0.02 g,盐酸硫胺素0.001 g,盐酸吡哆醇0.005 g,烟酸VB5或VPP 0.005 g,蔗糖30 g·L-1,琼脂8 g·L-1,蒸馏水1 000 mL,pH 5.8~6.0.
试验试剂:6-苄氨基嘌呤(6-BA)、α-萘乙酸(NAA)、赤霉素(GA3)均购于北京索莱宝科技有限公司;玉米素(ZT)购自北京百灵威科技有限公司.
1.2 试验方法
1.2.1 试管苗扩繁
将带腋芽的茎段接种于MS培养基进行扩繁,培养条件为温度23~25 ℃,光照时间为16/8 h,光照强度为2 000~3 000 lx.3~4周苗龄的试管苗用于试验.
1.2.2 诱导愈伤组织形成的培养基筛选
1.2.2.1 诱导愈伤组织形成的培养基制作
配制不同浓度的激素:0.25、1.50、2.50、5.00 mg·L-16-BA和0.10、0.20、0.30、0.40 mg·L-1NAA,用无菌0.22 μm过滤器过滤除菌,分装于50 mL灭菌离心管中,4 ℃保存.经高压灭菌后的MS培养基冷却到50 ℃左右时,按表1中的配比加入激素,制成不同激素浓度的培养基.
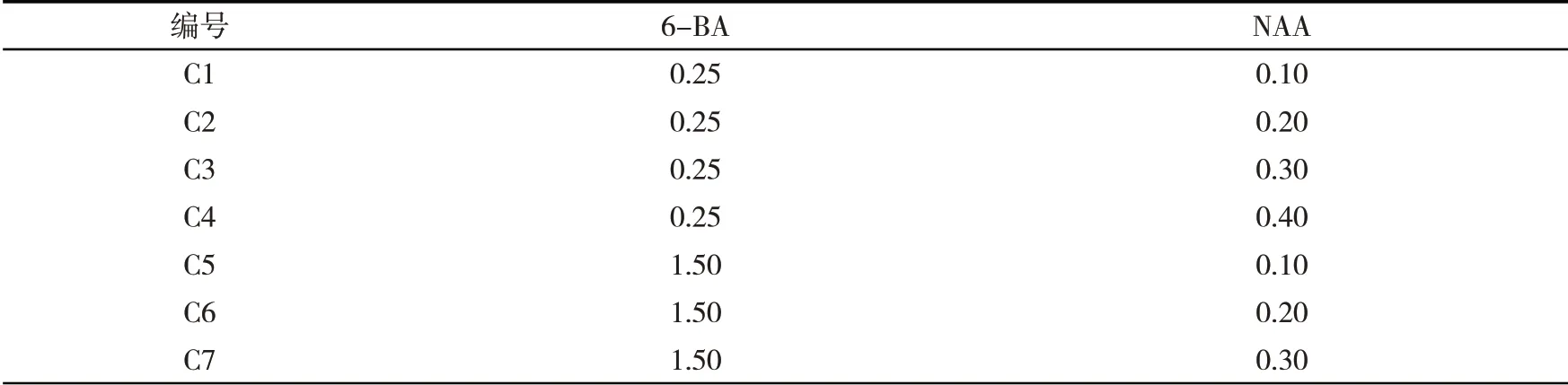
表1 愈伤组织诱导培养基Tab. 1 Callus induction medium mg·L-1

续表1
1.2.2.2 试验设计
无菌操作剪取0.5~1.0 cm长不带腋芽和叶片的培养好的大西洋脱毒试管苗茎段及切掉部分叶尖保留叶柄的健壮叶片.将茎段和叶片分别移入配制好的各种诱导愈伤组织形成的培养基中.1个培养皿中放置茎段20个、叶片15个,试验设3次重复,按1.2.1中的培养条件培养14 d,根据愈伤组织生长情况统计愈伤组织诱导率.
愈伤组织诱导率=产生愈伤组织的茎段或叶片/茎段或叶片总数×100%
1.2.3 不定芽分化培养基筛选
1.2.3.1 不定芽分化培养基的制备
配制不同浓度激素:1.00、2.00、3.00、5.00 mg·L-16-BA,0.05、0.10、0.20、0.30 mg·L-1NAA,0、1.00、2.00、3.00 mg·L-1ZT和0、2.50、5.00、10.00 mg·L-1GA3,用无菌0.22 μm过滤器过滤除菌,分装于50 mL灭菌离心管中,4 ℃保存.经高压灭菌后的MS培养基冷却到50 ℃左右时,按表2中的配比加入激素,制成不同激素浓度的芽分化培养基.
1.2.3.2 试验设计
将在C4(MS+0.25 mg·L-16-BA+0.40 mg·L-1NAA)和C15(MS+5.00 mg·L-16-BA+0.30 mg·L-1NAA)培养基中形成的茎段和叶片愈伤组织再分别移入不同激素浓度的不定芽分化培养基(表2)中,试验设3个重复,按1.2.1中的培养条件培养,观察芽分化情况,40 d统计芽分化率.

表2 不定芽分化培养基配比Tab. 2 Ratio of adventitious bud differentiation medium mg·L-1
芽分化率=分化出不定芽茎段或叶片/茎段或叶片总数×100%
1.2.4 数据统计
采用Microsoft Excel 2010和SPSS 25.0对数据进行统计和分析,在0.05水平上进行差异显著性分析.
2 结果与分析
2.1 不同激素配比对大西洋愈伤组织形成的影响
将茎段或叶片接到愈伤组织诱导培养基上,生长7 d左右时,茎段两端切口处开始膨大变粗,并逐渐向中部扩展;叶片切割边缘慢慢卷曲,开始出现膨大增殖现象,叶柄的伤口处也逐渐膨大.生长至14 d左右时,叶片、叶柄及茎端切口处均会长出肉眼可见的愈伤组织(图1).
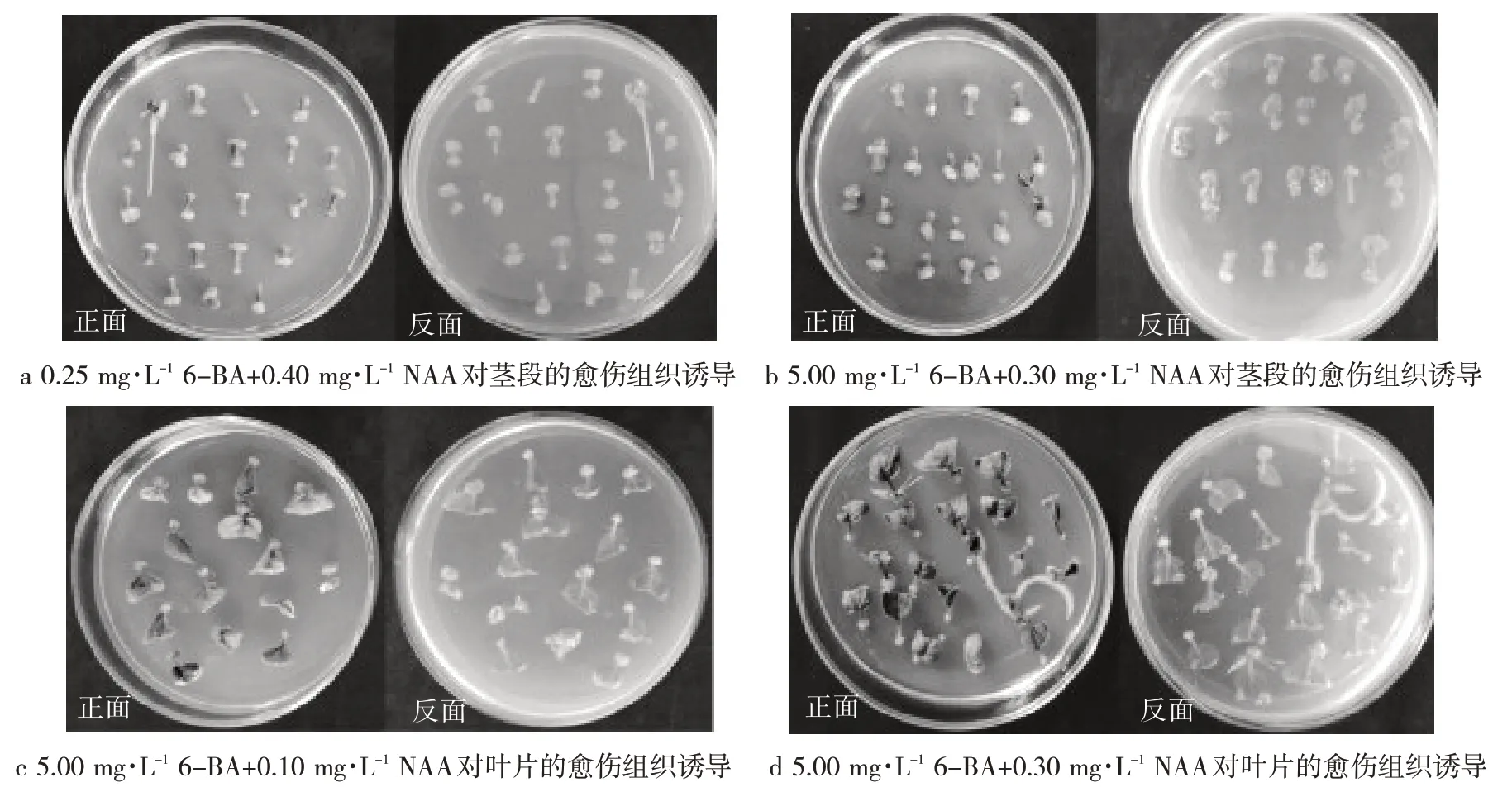
图1 最佳培养基对愈伤组织的诱导培养(14 d)Fig. 1 The best medium for callus induction culture(14 d)
不同激素配比的16 种培养基对茎段愈伤组织的诱导结果表明,茎段在C1(MS+0.25 mg·L-16-BA+0.10 mg·L-1NAA)、C2(MS+0.25 mg·L-16-BA+0.20 mg·L-1NAA)、C3(MS+0.25 mg·L-16-BA+0.30 mg·L-1NAA)、C4(MS+0.25 mg·L-16-BA+0.40 mg·L-1NAA)、C15(MS+5.00 mg·L-16-BA+0.30 mg·L-1NAA)和C16(MS+5.00 mg·L-16-BA+0.40 mg·L-1NAA)这6种培养基上的愈伤组织诱导率均在90%以上,生长量较好,淡绿色,米粒状(表3).通过试验发现,在C3和C4培养基上已生根,而在其他培养基上则无生根.由此可知,诱导茎段愈伤组织最佳培养基为C4.
不同培养基对叶片愈伤组织的诱导结果表明,在愈伤组织诱导率、组织量、颜色和形状等方面,叶片在C2(MS+0.25 mg·L-16-BA+0.20 mg·L-1NAA)、C3(MS+0.25 mg·L-16-BA+0.30 mg·L-1NAA)和C4(MS+0.25 mg·L-16-BA+0.40 mg·L-1NAA)这3个培养基上的愈伤组织诱导率最低,均在45%以下,愈伤组织生长量较差,愈伤组织呈乳白色,小突起;在C13(MS+5.00 mg·L-16-BA+0.10 mg·L-1NAA)、C15(MS+5.00 mg·L-16-BA+0.30 mg·L-1NAA)和C16(MS+5.00 mg·L-16-BA+0.40 mg·L-1NAA)培养基中的诱导率分别为85.93%、77.04%和80.74%,生长量最好,淡绿色,米粒状(表3).通过试验发现,虽然叶片在C13和C16培养基上的诱导率均大于C15,但在C13和C16培养基上无生根,而C15培养基上已生根.因此,叶片愈伤诱导的最佳培养基为C15.
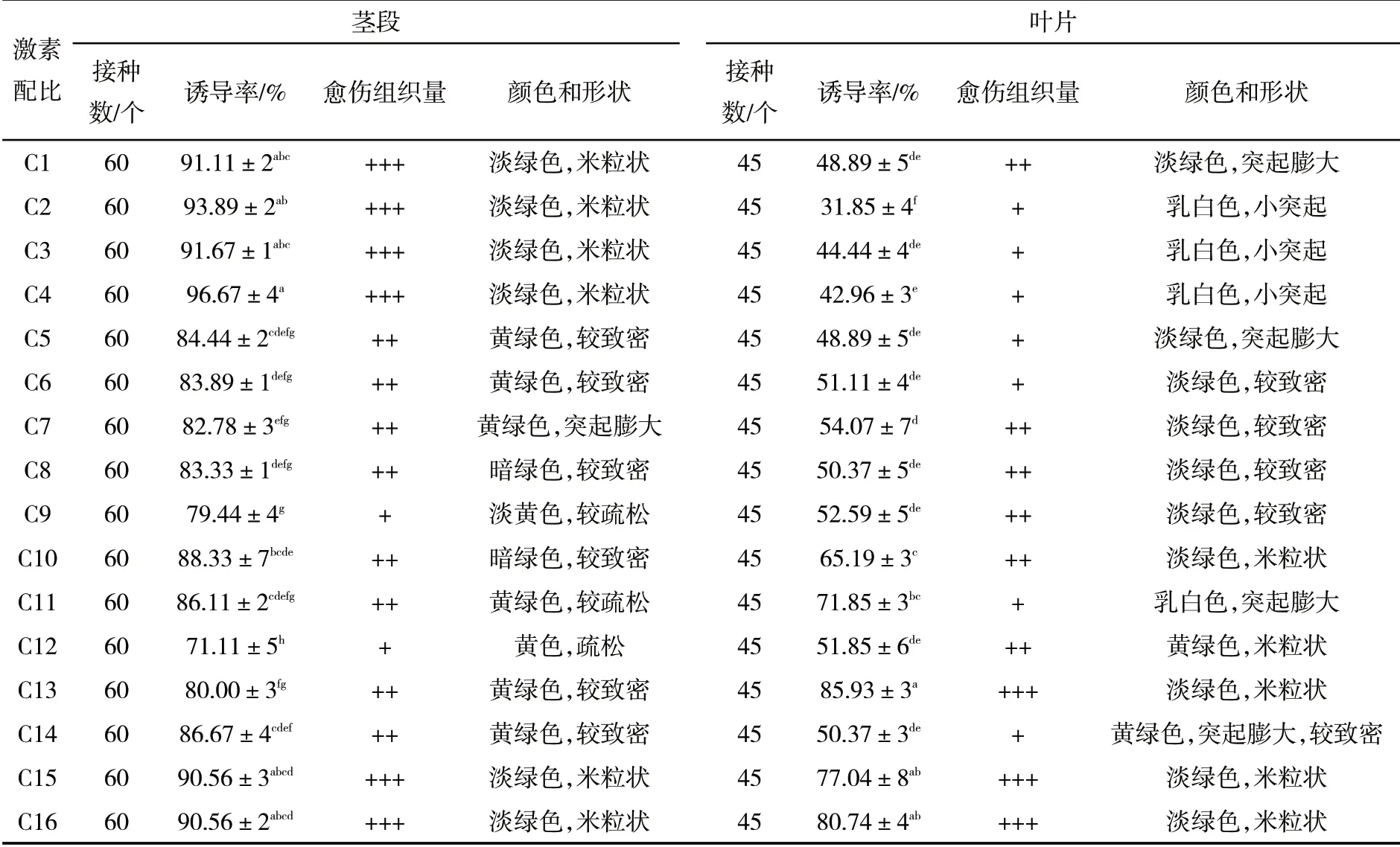
表3 不同激素配比对大西洋茎段和叶片愈伤组织诱导Tab. 3 The effect of different hormone ratios on Atlantic stem and leaf callus induction
2.2 不同激素配比对大西洋愈伤组织不定芽分化的影响
将茎段和叶片愈伤组织转到以6-BA、NAA、ZT 及GA3组合配比的16 个分化培养基上,观察结果表明,生长3周左右开始形成绿色芽点,5周左右慢慢长出肉眼可见的小芽(图2).
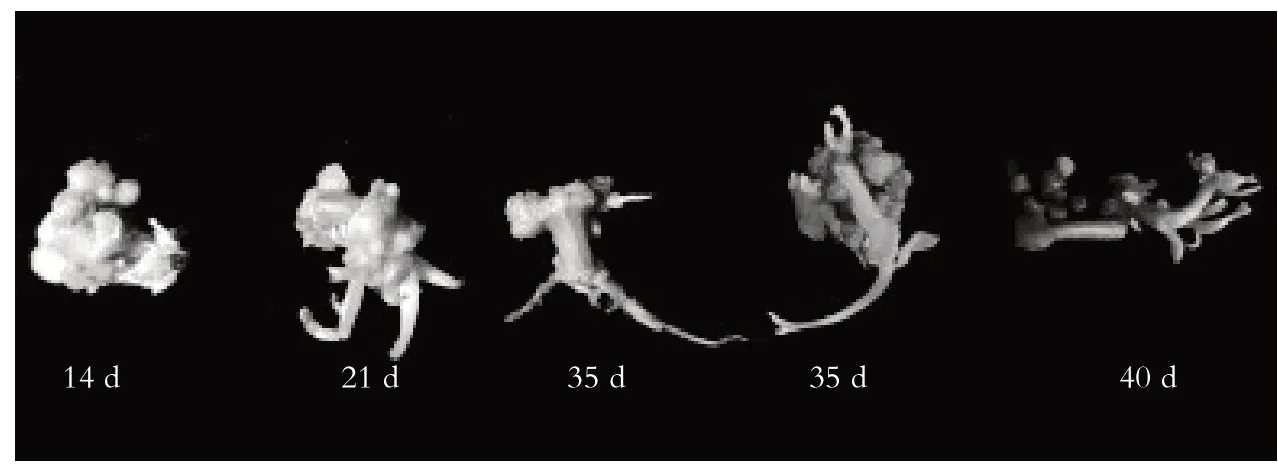
图2 不同培养时间的茎段不定芽分化Fig. 2 Adventitious bud differentiation of stem at different culture time
比较不同培养基上茎段愈伤组织不定芽分化率和长势,最佳培养基为D14(MS+5.00 mg·L-16-BA+0.10 mg·L-1NAA+10.00 mg·L-1GA3),分化率为41.11%,芽多且粗壮;其次为D5(MS+2.00 mg·L-16-BA+0.05 mg·L-1NAA+5.00 mg·L-1GA3),分化率为31.11%,芽多且粗壮;其他培养基上的分化率较低,长势较差;在D1(1.00 mg·L-16-BA+0.05 mg·L-1NAA)培养基上生长最差,分化率为6.11%,芽弱小(表4).
比较叶片愈伤组织不定芽分化率和长势,最佳培养基为D14(MS+5.00 mg·L-16-BA+0.10 mg·L-1NAA+10.00 mg·L-1GA3),分化率为40.00%,芽多且肥厚;其次是D7(MS+2.00 mg·L-16-BA+0.20 mg·L-1NAA+1.00 mg·L-1ZT)和D15(MS+5.00 mg·L-16-BA+0.20 mg·L-1NAA+1.00 mg·L-1ZT)培养基,分化率均为30.37%;其他培养基较差;最差的是D1(1.00 mg·L-16-BA+0.05 mg·L-1NAA)培养基,叶片愈伤组织基本不分化成芽,只出现愈伤组织增大且老化现象(表4).
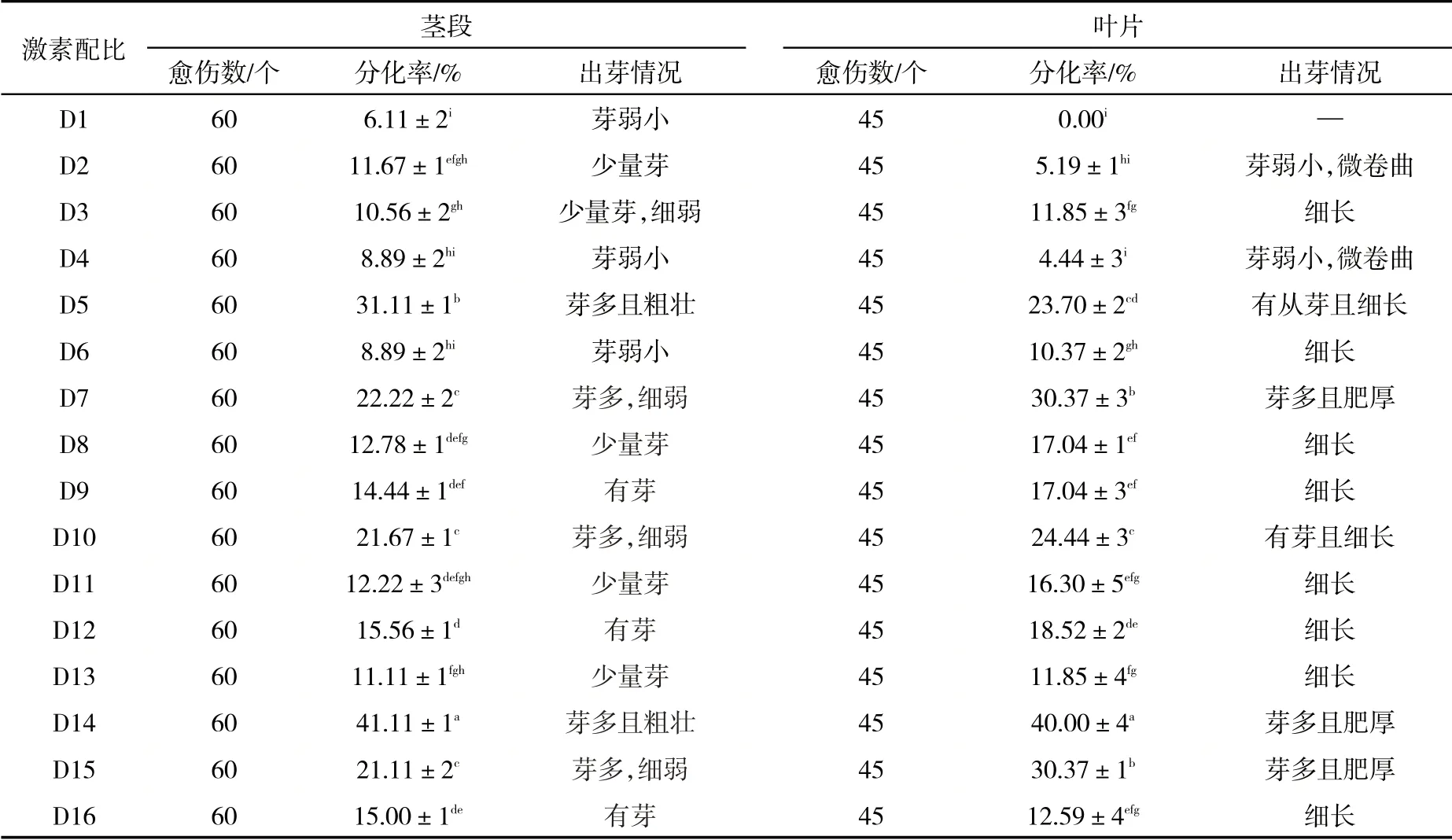
表4 不同激素配比对大西洋茎段和叶片不定芽诱导Tab. 4 Different hormone ratios on adventitious bud induction in Atlantic stem segments and leaves
总之,诱导茎段和叶片愈伤组织不定芽分化的最佳培养基均为D14,其分化率均达40%.
3 讨论与结论
适宜的外植体应具备幼年型、增殖能力强、再生能力强及遗传稳定性好的特点.目前,不带腋芽的茎段[14]、叶片[15]或试管薯[16]作为马铃薯外植体用于再生体系研究中,幼苗的苗龄[17]、接种方式[18]和培养条件[19-20]均对马铃薯的再生有一定影响.激素的种类和浓度是影响马铃薯愈伤组织形成的关键因素.马铃薯愈伤组织形成只有在合适配比的细胞分裂素和生长素类激素的组合中才可以取得较好的诱导效果[21].本试验中选用不同浓度的6-BA和NAA激素组合配比对茎段和叶片的愈伤组织进行诱导,茎段诱导最佳培养基为MS+0.25 mg·L-16-BA+0.40 mg·L-1NAA,叶片诱导的最佳培养基为MS+5.00 mg·L-16-BA+0.30 mg·L-1NAA,其诱导率分别为96.67%、77.04%,愈伤组织为淡绿色,结构较致密呈米粒状,且均可生根,结果与张之为等[22]研究一致.不同激素浓度对愈伤组织形成有很多影响.本试验研究发现,6-BA浓度为0.25 mg·L-1和5.00 mg·L-1时,茎段愈伤组织形成情况差别不大,但使用0.25 mg·L-16-BA配合0.40 mg·L-1NAA进行诱导时,会促进茎段愈伤组织的根生长.杨明贺等[13]研究得出不一致的结果,认为6-BA的最适浓度为2.00 mg·L-1,降低或者升高,茎段愈伤组织诱导率均大幅度下降.
不同浓度的激素对马铃薯茎段和叶片的愈伤组织不定芽分化存在影响.已有研究表明,GA3是提高愈伤组织不定芽分化阶段的关键激素,可促进茎的伸长生长,促进细胞分裂和分化[23-24].本试验结果显示,诱导茎段和叶片愈伤组织不定芽分化的最佳培养基均为MS+5.00 mg·L-16-BA+0.10 mg·L-1NAA+10.00 mg·L-1GA3,其诱导率均可达40%.张之为等[22]利用MS+2.00 mg·L-16-BA+0.20 mg·L-1NAA+1.00 mg·L-1ZT可使大西洋的愈伤组织分化出芽,分化率为18.18%,这和本试验的结论一致,不加GA3激素,适当添加ZT激素,也会促使愈伤组织的不定芽分化.

