毛蚶抗癌蛋白主要组分的分离纯化及作用研究
梁桓熙 王子依 李晶哲 马琰岩 刘长振 孙震晓


摘要 目的:对毛蚶抗癌蛋白(ASAP)进行了分离纯化,并研究分离后毛蚶抗癌蛋白主要组分的抗癌作用。方法:依次利用阴离子交换层析、疏水作用层析、凝胶过滤层析对ASAP进行分离;联合p53基因表达激活及CCK-8细胞活力测定检测分离组分的抗癌活性;CCK-8细胞活力测定法检测毛蚶抗癌蛋白主要组分对人结直肠癌Colo205、HT-29、人肺癌A549、人慢性髓性白血病K562细胞活力的影响;Annexin-V/PI双染结合流式细胞术检测细胞凋亡;Western Blotting法检测细胞凋亡相关蛋白:Mcl-1、Bcl-2、Bax、procaspase-3的表达情况。结果:从ASAP中分离得到的毛蚶抗癌活性蛋白主要组分C6在24~72 h内对Colo205、HT-29、A549、K562的细胞活力均有不同程度的抑制作用,其中对Colo205细胞的抑制作用最明显,作用72 h时IC50为5.7 μg/mL;C6可以诱导Colo205细胞凋亡且呈一定剂量依赖性;C6可以抑制抗凋亡蛋白Mcl-1和Bcl-2的表达,上调凋亡蛋白Bax的表达,引起凋亡蛋白caspase-3前体procaspase-3下降。结论:毛蚶抗癌蛋白主要组分C6对人多种癌细胞活力具有抑制作用,可诱导人结直肠癌Colo205细胞发生caspase通路依赖的细胞凋亡。
关键词 毛蚶抗癌蛋白主要组分C6;层析分离;Colo205;HT-29;A549;K562;细胞凋亡;Caspase
Abstract Objective:In this study,the anticancer protein(ASAP) of the larvae was isolated and purified,and the anticancer effects of the main components of the anticancer protein of the larvae were studied.Methods:We separated ASAP by anion exchange chromatography,hydrophobic interaction chromatography,and gel filtration chromatography; combined p53 gene expression activation and CCK-8 cell viability assay to track the anticancer activity of the separated components; the CCK-8 cell viability assay detected the effects of the main components of the anti-cancer protein of ASAP on the viability of human colorectal cancer Colo205,HT-29,human lung cancer A549,and human chronic myelogenous leukemia K562; Annexin-V/PI double staining combined with flow cytometry was used to detect cell apoptosis.Results:C6,the main component of the anticancer active protein isolated from ASAP,can inhibit the cell viability of Colo205,HT-29,A549,and K562 to varying degrees within 24 to 72 hours.Among them,it has the most inhibitory effect on Colo205 cells.Obviously,the IC50 was 5.7 μg/mL at 72 h; C6 can induce Colo205 cell apoptosis in a dose-dependent manner; C6 can inhibit the expression of anti-apoptotic proteins Mcl-1 and Bcl-2,and up-regulate the apoptotic protein Bax expression and cause the decrease of the apoptotic protein caspase-3 precursor procaspase-3.Conclusion:C6,the main component of the anti-cancer protein of ASAP,has an inhibitory effect on the viability of a variety of human cancer cells,and can induce caspase pathway-dependent apoptosis in human colorectal cancer Colo205 cells.
Keywords Main component of ASAP C6; Chromatographic separation; Colo205; HT-29; A549; K562; Apoptosis; Caspase
中图分类号:R73-36+2文獻标识码:Adoi:10.3969/j.issn.1673-7202.2021.20.009
毛蚶(Arca subcrenata Lischke)为软体动物门瓣鳃纲列齿目蚶科毛蚶属海洋生物,其药用历史悠久,其壳为中药瓦楞子(Arcae Concha)来源之一[1],《医林纂要·药性》记载其能“攻坚破瘀。去一切痰积,血积,气块,破症瘕,攻瘰疬”,据《食疗本草》记载,其肉有“利五脏、温中、消食”等功效。
本课题组前期进行了毛蚶水提物体外抗癌作用筛选和抗癌蛋白的分离、纯化及抗癌机制研究,发现毛蚶水提物在体外对人红白血病细胞K562、人乳腺癌细胞MCF-7以及人肺腺癌细胞A549具有显著的抑制作用[2],从毛蚶中获得毛蚶抗癌蛋白(Arca subcrenata Antitumor Protein,ASAP)研究发现,ASAP可诱导细胞凋亡,激活p53表达[3-5]。p53荧光素酶报告基因系统为常用的荧光素酶报告基因系统之一,利用该系统可方便地进行影响p53表达的内外因素的研究[6-8]。本研究利用多种层析方法对ASAP进一步分离,联合p53激活作用及体外细胞毒测定追踪ASAP中可能的抗癌活性组分,并对其抗癌作用机制进行了研究。
1 材料与方法
1.1 材料
1.1.1 毛蚶
秋冬季节鲜毛蚶,产地中国大连,购自北京望京海鲜大市场,经北京中医药大学生命科学学院生物制药系孙震晓教授鉴定为毛蚶(Arca subcrenata Lischke)。
1.1.2 细胞株
结合本课题组前期研究,实验选用人结直肠癌细胞Colo205、HT29、人肺癌细胞A549、人慢性髓性白血病细胞K562,以上细胞系均保存于中国中医科学院医学实验中心免疫学实验室。以上细胞系均使用RPMI-1640培养基于37 ℃,5% CO2培养箱中培养。
1.1.3 试剂与仪器
RPMI1640培养基(HyClone公司,美国,货号:SH30027.01)、胰酶(HyClone公司,美国,货号:SV30037.01),胎牛血清(Gibco公司,美国,货号:10099),DMSO(Sigma公司,美国,货号:D2650)。CCK-8试剂盒(Dojindo同仁公司,日本,货号:K1018),Annexin V-FITC细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司,货号:KGA107),Pierce BCA蛋白定量试剂盒(Thermo公司,美国,货号:23227)。兔抗人Caspase 3单克隆抗体、兔抗人Mcl-1单克隆抗体、兔抗人Bcl-2单克隆抗体、兔抗人Bax单克隆抗体(Abcam公司,美国,货号:ab32151、ab32087、ab32124、ab32503),山羊抗兔IgG二抗、兔抗人GAPDH单克隆抗体(CST公司,美国,货号:14708、5174)。
快速蛋白质纯化色谱系统(AKTA公司,瑞典,型号:Avant25),预装柱(GE Healthcare公司,美国,型号:DEAE FF 5 mL、Phenyl FF 5 mL、SuperdexTM200 10/300 GL),高速控温离心机(Hettich公司,德国,型号:UNIVERSAL 320),水平离心机及大容量离心机(Beckman Coulter公司,美国,型号:Allegra X-15R、Avanti J-26 XPI),全温振荡器(太仓豪诚实验仪器制造有限公司,型号:THZ-D),酶标仪、化学发光仪(Biotek公司,美国,型号:Eon、Synergy2),化学发光成像系统(Syngene公司,英国,型号:GeneGnome),超微量紫外分光光度计(Thermo公司,美国,型号:NanoDrop One),蛋白电泳仪(Bio-Rad公司,美国,型号:1658001),流式细胞仪(BD公司,美国,型号:Accuri C6)。
1.2 方法
1.2.1 毛蚶抗癌蛋白ASAP的分离纯化
参考文献[3-4]方法,通过低溫水提及硫酸铵沉淀等步骤制得ASA。层析纯化方法参考文献[9],依次利用阴离子交换层析、疏水作用层析、凝胶过滤层析对ASAP进行分离,使用ASAP浓度为6 mg/mL。DEAE阴离子交换层析使用A液(0.05 mol/L磷酸盐缓冲液(Phosphate Buffered Saline,PBS)+5 mmol/L NaCl,pH=8.0)上样,10%、30%、100% B液(0.05 mol/L PBS+1 mol/L NaCl,pH=8.0)洗脱,分别收集洗脱峰,机器自动编号A1、A3、A5;Phenyl疏水层析作用使用C液(0.05 mol/L PBS+1 mol/L(NH4)2SO4,pH=8.0)上样,0%、50%、100% A液洗脱,根据预实验结果分别收集洗脱峰,编号B1、B3、B5;使用Superdex200凝胶过滤层析法分离活性组分,50%C液+50%A液上样,PBS(pH=7.4)洗脱,每1 mL为1个组分分别收集,编号为C1-C9。将得到的蛋白组分置于4 ℃透析、除盐,然后超滤浓缩后进行后续实验。
1.2.2 p53荧光素酶报告基因系统测定各分离组分的p53激活活性
荧光素酶报告基因系统是将转录因子在DNA上的作用位点与报告基因连接,报告基因的表达程度与活化的转录因子数量呈线性关系,可直观展示转录因子的活性状态[11-13],也可以高效灵敏地检测基因的表达[14-15]。本实验根据前期发现毛蚶水提物可激活转录因子p53表达,使用本课题组前期构建好的PP-P53-NLuc-A549细胞系通过检测各组分对p53表达的影响筛选活性组分。
选取对数期A549细胞接种96孔板中,每孔加入1×104个细胞,设空白组、ASAP阳性对照组、蛋白组分低、中、高剂量处理组,每组3个复孔,每孔加入100 μL完全培养基。培养24 h后弃去培养基,空白组加入100 μL完全培养基,ASAP阳性对照组加入含100 μg/mL ASAP RPMI完全培养基100 μL,A1、A3、A5蛋白组分按10、20、40 μg/mL浓度,B1、B3、B5蛋白组分按1、2、4 μg/mL浓度,C1-C9蛋白组分按1、2、4‰(V/V)浓度,各组分均由RPMI1640完全培养基配制,每孔均加入100 μL,5% CO2培养箱中37 ℃培养48 h后弃旧培养基,PBS洗2次,换上新鲜培养基,2 h后分别取上清液测其荧光值,每次取20 μL/孔,添加含有3 μmol/L腔肠素CTZ的PBST(1 L PBS+500 μL吐温-20)100 μL,于化学发光仪中进行检测,每个样品检测重复3次。
1.2.3 CCK8法检测各分离组分细胞毒活性
参考文献[16],选用对数期K562细胞接种于96孔板中,按照细胞密度5×103个/mL每孔加入100 μL RPMI1640完全培养基,设对照组、ASAP阳性对照组、蛋白组分低、中、高剂量处理组,每组3个复孔。培养24 h后除去旧培养基,培养24 h后弃去培养基,对照组加入100 μL RPMI1640完全培养基,阳性对照加入ASAP浓度400 μg/mL,根据预实验结果,分别选取蛋白组分A1、A3、A5浓度10、20、40 μg/mL,B1、B3、B5浓度1、2、4 μg/mL,C1-C9组分1、2、4‰(V/V),以上组分由RPMI1640完全培养基配制,每孔均加入100 μL,于5% CO2培养箱中37 ℃培养24、48、72 h,弃去旧培养基,加入100 μL/孔含有10%(V/V)CCK-8试剂的培养基,测定吸光度并计算细胞活力。
细胞活力(%)=A(加药)-A(空白)/A(0)-A(空白)×100%,其中A(加药)指各观察组细胞的吸光值,A(0)指空白组细胞的吸光值,A(空白)指不含细胞、只有CCK8培养基的背景吸光值。
1.2.4 Annexin V-FITC/PI双染进行凋亡检测
参考文献[16],Colo205细胞以5×105/孔接种至6孔细胞培养板中,24 h后弃去旧培养基,加入C6组分10、20、40 μg/mL,处理24 h。收集细胞,预冷PBS洗2次。加入500 μL结合缓冲液,5 μL PI染液,10 μL Annexin V染液,混匀,室温避光15 min。300目尼龙网过滤,上流式检测,使用软件Image Lab分析结果。
1.2.5 Western Blotting法分析C6对Colo205细胞凋亡相关蛋白表达水平的影响
细胞处理方法同上,参照文献[17]中描述的方法,离心收集细胞,加入细胞裂解液30 μL冰浴中裂解30 min。11 100×g,离心10 min,上清液移至新EP管,BCA法测定各样品上清液蛋白浓度,样品12%SDS-PAGE电泳分离后,湿转到聚偏氟乙烯(PVDF)膜上,室温下封闭1.5 h,加入Caspase 3、Mcl-1、Bcl-2、Bax一抗,4 ℃孵育过夜,TBST洗3次膜,10 min/次。加入IgG抗兔二抗,在37 ℃温育2 h,TBST洗膜3次,10 min/次,ECL显色。以GAPDH作为内参分析目标蛋白的表达,并通过Image Lab分析每种蛋白在各组中的表达量。
1.3 统计学方法
采用SPSS 20统计软件进行数据分析,计量资料均数以均数±标准差(±s)表示,多样本均数的比较采用单因素方差分析,两样本均数比较采用q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 毛蚶抗癌蛋白ASAP进一步分离纯化
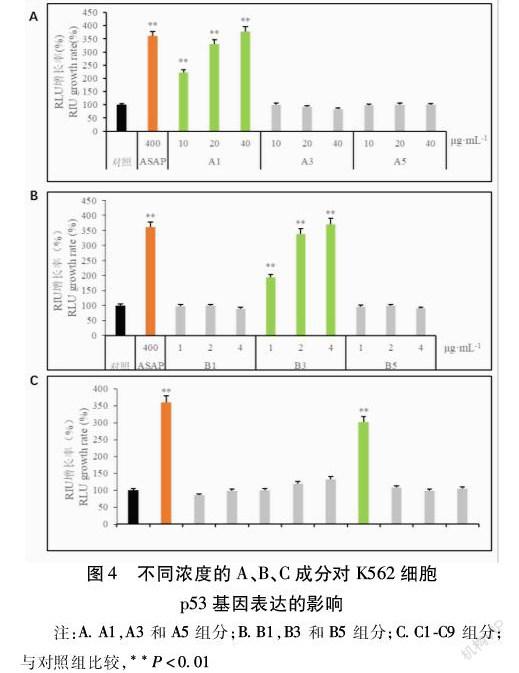
毛蚶ASAP经DEAE阴离子交换层析分离的FPLC图,共3个洗脱峰,仪器自动编号依次命名为A1、A3、A5组分。见图1。A1组分经Phenyl疏水层析分离的FPLC图,共有3个洗脱峰,仪器自动编号依次命名为B1、B3、B5组分。见图2。B3组分经Superdex200凝胶过滤层析分离的FPLC图,每毫升为1个组分,共洗脱出9个组分,按洗脱顺序分别命名为C1、C2、C3、C4、C5、C6、C7、C8和C9。见图3。
2.2 p53荧光素酶报告基因系统配合CCK-8法筛选活性组分
采用联合p53激活及细胞活力抑制2个指标筛选各分离组分抗癌活性。
2.2.1 p53荧光素酶报告基因系统检测结果
使用p53荧光素酶报告基因系统对组分A1、A3、A5的活性进行验证,与对照组比较,在不同浓度下,作用48 h后,只有A1组分对p53活性有较强的促进作用,且作用呈浓度依赖性;与阳性对照比较,A1组分在浓度为40 μg/mL作用48 h后达到了阳性对照类似的p53促进作用。见图4A。使用p53荧光素酶报告基因系统对组分B1、B3、B5的活性进行验证,与对照组比较,在不同浓度下,作用48 h后,只有B3组分对p53活性有较强的促进作用,且作用呈浓度依赖性;与阳性对照比较,B3组分在浓度为4 μg/mL作用48 h后达到了阳性对照类似的p53促进作用。见图4B。使用p53荧光素酶报告基因系统对组分C1-C9的活性进行验证,与对照组比较,作用48 h后,组分C6对p53表达的促进作用最为明显;与阳性对照比较,C6组分在作用48 h后达到了阳性对照类似的p53促進作用。见图4C。
2.2.2 CCK8法检测结果
使用CCK-8方法对组分A1、A3、A5作用于K562的抑制率进行检测,与对照组比较,在不同浓度作用24、48、72 h后,仅A1组分对K562有显著抑制作用,故选取A1组分进行下一步分离。见图5A。使用CCK-8方法对组分B1、B3、B5作用于K562的抑制率进行检测,与对照组比较,在不同浓度下,作用24、48、72 h后,B1组分仅在2、4 μg/mL作用24 h时有抑制作用,只有B3组分在不同浓度及作用时间下均对K562有显著抑制作用,因此选取B3组分进行下一步分离。见图5B。使用CCK-8方法对组分C1-C9作用于K562的存活率进行检测,与对照组比较,组分C5、C6在作用24、48、72 h后均对K562有较强的抑制作用,且作用均呈时间依赖性。结合p53荧光素酶报告基因系统测定结果,我们选择C6组分做进一步抗肿瘤机制研究。见图5C。
2.3 C6对不同肿瘤细胞系的作用
使用C6对不同肿瘤细胞处理后,可见对K-562、A549、HT-29和Colo205细胞均有不同的抑制作用。其中对K-562和HT-29细胞在24 h时抑制率均较低,而在48 h和72 h时抑制率均较高且无明显差异。且C6组分对K-562和HT-29细胞在不同浓度下的抑制作用无明显差异。C6对A549细胞和Colo205细胞的抑制均呈浓度依赖性,其中对A549细胞的作用在低浓度时呈非时间依赖性。C6对Colo205细胞的抑制作用同时呈时间和浓度依赖性。见图6。
2.4 C6诱导Colo205细胞凋亡情况
使用流式细胞术结合Annexin V-FITC/PI双染法检测不同浓度C6组分对Colo205细胞的凋亡作用,可以看出随C6组分浓度的增高,Colo205总的凋亡率及早期凋亡率上升。见图7,表1。
2.5 Western Blotting检测Colo205细胞中凋亡相关蛋白表达
Western Blotting检测显示C6组分10 μg/mL作用于Colo205细胞0、6、12、24、36、48 h凋亡相关蛋白表达结果,随着药物作用时间的延长,凋亡抑制蛋白Bcl-2表达量显著降低,凋亡蛋白Bax的表达量显著升高,凋亡抑制蛋白Mcl-1在6~24 h表达量升高,36 h后表达量降低,48 h与未加药组比较表达量显著降低;凋亡蛋白caspase-3前体procaspase-3表达量下调,48 h时显著降低。见图8。
3 讨论
本研究通过p53荧光素酶报告基因系统联合细胞活力测定,对毛蚶抗癌蛋白ASAP经阴离子交换层析、疏水作用层析、凝胶过滤层析分离后得到的组分进行抗癌活性筛选,对有显著体外细胞毒活性并明显激活p53基因表达的毛蚶抗癌蛋白主要组分C6体外抗肿瘤活性进行了筛选,选择了抑制作用具有时间和剂量依赖性的人结肠癌细胞Colo205进行了机制的研究。结果表明C6可以诱导Colo205细胞凋亡,与我们之前报道的毛蚶水提物和毛蚶抗癌蛋白ASAP的作用一致[2-5]。本研究检测了常规与细胞凋亡相关蛋白如Bcl-2、Bax、Mcl-1、procaspase-3的表达情况,发现C6可诱导Colo205细胞发生caspase-3依赖的细胞凋亡。
关于毛蚶提取物中抗癌多肽或蛋白的分离纯化已有一些研究报道,如有研究发现毛蚶多肽组分P2可抑制7种癌细胞的增殖并促进胞内ROS的高表达,激活细胞凋亡,抑制细胞周期蛋白B1/cdc2复合体的表达并促进P21表达,引起细胞周期阻滞[17-18];毛蚶多肽H3对人宫颈癌HeLa、人肝癌HepG2和人结直肠癌HT-29细胞均有显著的增殖抑制作用[19];分离的小分子蛋白G-4-2对HeLa细胞、人早幼粒白血病HL-60的增殖有显著抑制作用;小分子蛋白G-6对HL-60细胞的增殖有显著抑制作用[20]。本研究发现毛蚶抗癌蛋白主要组分C6可显著激活人肿瘤细胞P53蛋白活性,诱导人结肠癌Colo205细胞caspase-3依赖的细胞凋亡,丰富了毛蚶抗癌活性成分的抗癌机制研究。
近年来,随着海洋生物资源的大量开发利用,多种不同功能的海洋生物活性物质被提取分离,不断有新的海洋抗癌活性物质被发现,其中海洋软体动物中抗癌活性蛋白及多肽在其中占据了重要位置[21]。毛蚶蛋白或多肽是开发抗癌新药的潜在资源,在目前毛蚶抗癌蛋白研究基础上,结合其转录组、质谱分析数据,借助虚拟筛选和蛋白原核或真核表达技术,可加快活性成分的发现和鉴定,为抗癌新药研发奠定基础。
参考文献
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:70.
[2]冯婷,田佳鑫,李子木,等.毛蚶水提物对人肿瘤细胞生长的抑制作用研究[J].中国海洋药物,2013,32(3):40-48.
[3]付莹,赵晨,常振战,等.毛蚶抗癌蛋白对人乳腺癌细胞MCF-7的生长抑制作用[J].癌变·畸变·突变,2015,27(6):415-420.
[4]付莹,冯婷,赵晨,等.毛蚶蛋白抗肿瘤活性研究[J].癌变·畸变·突变,2014,26(6):412-418.
[5]赵晨,付莹,林华英,等.毛蚶抗癌活性蛋白对K562细胞增殖和凋亡的影响[J].中国药理学与毒理学杂志,2016,30(3):221-228.
[6]胡琳珊,张海波,童英,等.筛选p53靶向药物的细胞模型的构建[J].四川大学学报:自然科学版,2013,50(4):849-855.
[7]Wang W,Kim SH,El-Deiry WS.Small-molecule modulators of p53 family signaling and antitumor effects in p53-deficient human colon tumor xenografts[J].Proc Natl Acad Sci U S A,2006,103(29):11003-11008.
[8]Huang C,Zhang XM,Tavaluc RT,et al.The combination of 5-fluorouracil plus p53 pathway restoration is associated with depletion of p53-deficient or mutant p53-expressing putative colon cancer stem cells[J].Cancer Biol Ther,2009,8(22):2186-2193.
[9]Lv S,Gao J,Liu T,et al.Purification and partial characterization of a new antitumor protein from Tegillarca granosa[J].Mar Drugs,2015,13(3):1466-1480.
[10]孫震晓.一种改进的β淀粉样蛋白的电泳分离方法[J].生物技术,2004,20(6):43-44.
[11]Yang B,Shen JW,Zhou DH,et al.Precise discovery of a STAT3 inhibitor from Eupatorium lindleyanum and evaluation of its activity of anti-triple-negative breast cancer[J].Nat Prod Res,2019,33(4):477-485.
[12]郭志兰,车路阳,李晶哲,等.NF-κB荧光素酶报告基因系统的构建及验证[J].生物工程学报,2016,32(10):1465-1473.
[13]许丰雯,徐丹,李森,等.以荧光素酶为报告基因定量检测原型泡沫病毒的指示细胞系的建立[J].南开大学学报:自然科学版,2011,44(3):80-84.
[14]Marin M,Du Y,Giroud C,et al.High-Throughput HIV-Cell Fusion Assay for Discovery of Virus Entry Inhibitors[J].Assay Drug Dev Technol,2015,13(3):155-166.
[15]羅天霞,樊红琨,芮丹丹,等.SK2和JPH2双基因重组真核表达载体的构建及在HEK293细胞中的表达[J].郑州大学学报:医学版,2016,51(5):580-583.
[16]王子依,张露露,孙震晓,等.氟达拉滨与TRAIL联用诱导肺癌细胞凋亡及其作用机制[J].癌变·畸变·突变,2019,31(3):203-207.
[17]Hu X,Song L,Huang L,et al.Antitumor effect of a polypeptide fraction from Arca subcrenata in vitro and in vivo[J].Mar Drugs,2012,10(12):2782-2794.
[18]Hu X,Zhang Z,Liu T,et al.Polypeptide Fraction from Arca subcrenata Induces Apoptosis and G2/M Phase Arrest in HeLa Cells via ROS-Mediated MAPKs Pathways[J].Evid Based Complement Alternat Med,2015,2015:930249.
[19]Chen L,Song L,Li T,et al.A new antiproliferative and antioxidant peptide isolated from Arca subcrenata[J].Mar Drugs,2013,11(6):1800-1814.
[20]Song L,Ren S,Yu R,et al.Purification,characterization and in vitro anti-tumor activity of proteins from Arca subcrenata Lischke[J].Mar Drugs,2008,6(3):418-430.
[21]Chen JW,Wu QH,Rowley DC,et al.Anticancer agent-based marine natural products and related compounds[J].J Asian Nat Prod Res,2015,17(2):199-216.
(2020-12-23收稿 责任编辑:杨觉雄)

