肿瘤标记物microRNA-21在胰腺癌中的表达及意义
冯志林 李紫宣 崔大鹏 孔令霞 赵茜
恶性肿瘤发生因素多种多样,大致可分为外源性因素和内源性因素两种。其中,起源于上皮组织的恶性肿瘤统称为癌,如胰腺癌(PC)便是其中一种常见类型。PC恶性程度很高,5年生存率<1.00%,治愈率极低。结合当前PC的流行病学与临床研究结果,其发病率和死亡率上升明显,男性高于女性,二者之比为(1.5~2)∶1[1]。研究发现,虽然男性PC患者较女性PC患者比例更高,但绝经后的女性PC患者占比却与男性相仿[1]。核糖核酸(ribonucleic acid,RNA)作为一种常见的遗传信息载体,诱导蛋白质合成是其主要使命,它不仅广泛存在于健康生物细胞中,同时在部分病毒、类病毒中也可寻见其踪影。而MicroRNAs(miRNAs)作为靶基因相关信号通路调控者,主要由一类长18~27个核苷酸的单链RNA分子构成,有较好的抑癌基因或癌基因功能。而miR-21作为miRNAs之一,在胃、肺、肝、食管等[2]器官或组织的多种癌症中均处于高表达状态,故而成为一种新型肿瘤标志物,其异常表达与癌的发生发展、转归等过程息息相关。本文将通过对照试验的方式对PC患者循环miR-21表达水平现代实验检测,探析其表达及临床意义。
1 资料与方法
1.1 一般资料 对象纳入时间为2017年1月至2019年1月,共53例PC患者,就诊科室为肿瘤科。PC患者全部由病理切片明确诊断,纳入与排除标准均符合《胰腺癌综合诊治指南(2018年版)》[4]相关要求,且通过本院伦理委员会审核后执行。性别:男37例,女16例;年龄52~80岁,平均年龄(64.23±5.28)岁。按美国癌症联合会(Alternate Joint Communications Center,AJCC)制定的TNM及病理分期系统(第7版)评估:T1/2期15例,T3/4期38例;淋巴结转移:N0/1者:19例,N2/3者34例;病理分型:有淋巴结转移8例,无淋巴结转移45例。签署《知情同意书》和各项基础资料全部有效,课题均符合《赫尔辛基宣言》(世界医学会)中的医学研究伦理原则。
1.2 方法
1.2.1 主要仪器与试剂:仪器操作步骤及注意事项,试剂的操作规范、步骤及注意事项等均按具体使用说明书或根据检测师实际需求而定。仪器:微量冷冻离心机(4℃)Centrifuge 5415R Eppendorf公司;显微镜成像系统 ECLIPSE 51i 日本尼康公司;电热恒温水浴箱 HHW 21Cu 600 中国南通科学仪器厂;100 mm细胞培养皿 Coring公司;流式细胞分选仪 Facs-AriaI Beton Dickinson公司;PCR仪 TAKARA 上海皓嘉科技仪器制造有限公司;恒温磁力搅拌机 78HW-1型 杭州仪表电机厂;超净工作台 YG-875B型 苏州医疗设备厂;酶标仪 Model 550型 BIO/RAD公司;酸度计 3505型 英国JENWAY公司。试剂:RNA提取试剂盒 北京天恩泽基因科技有限公司;RIPA细胞裂解液 碧云天公司;细胞核蛋白与细胞浆蛋白提取试剂盒 碧云天公司;型兔抗人SPRY-2多克隆抗体 美国Proteintech公司;RT-PCR试剂盒 TransGen Biotech公司;胰蛋白酶、链霉素等 美国Sigma Chemical公司;肿瘤细胞分离提取试剂盒(DPI、LPS)Panomics公司;型兔抗人AEG-1多克隆抗体 美国Proteintech公司;胎牛血清 Hyclone公司;磷酸缓冲盐溶液(PBS)吉诺公司;普通质粒答大提试剂盒 TIANGEN公司;总RNA提取盒 BD Bioscience公司;Human MiR-21 mimics、inhibitor RiboBio公司;Human MiR-21 vector、shRNA OriGene公司。
1.2.2 实验方法:将PC组术中切除的肿瘤组织按肿瘤细胞分离提纯试剂盒具体使用说明书剪切成小块并置入实验容器,加入5 ml组织细胞消化液将其制成细胞悬液,将细胞悬液轻轻滴在事先加入了5 ml分离液(分离管)上层,在37℃条件下放置(垂直)120 min后吸出上层悬液并离心处理(离心速率:2 200 r/min,离心时间8 min,离心环境温度4℃)下层分离液,重复此步骤(≥2次)直至得到提纯肿瘤细胞。将原代肿瘤细胞和AsPC-1、BxPC-3、Capan-1、Capan-2、CFPAC-1等胰腺癌细胞株配制成浓度为2×106/ml的待培养液,并将上述细胞株置入洛斯维·帕克纪念研究所(Roswell Park Memorial Institute,RPMI)研发的RPMI-1640培养液(含硫酸链霉素100 mg/ml,青霉素 100 U/ml,胎牛血清10%)中培养,培养环境温度:37℃,培养箱浓度:5%二氧化碳(CO2)。
1.2.3 癌组织与癌旁组织的RNA提取:从冻存处取出癌及癌旁组织并切取100 mg后,用PBS冲洗液(1%)冲洗后放入无RNA酶的试管(5 ml)中,接着加入TRIZOL提取剂(5 ml)并进行高速匀浆处理,直至团块消失。然后将其转移至EP试管(1.5 ml)后加入氯仿(200 μl)反复颠倒(40次左右)直至混匀再进行离心(离心速率:12 000 G/min,离心时间:15 min,离心环境温度:4℃)处理。转移上清至EP试管(1.5 ml)后加入550 μl异丙醇混匀并静置5 min,离心(离心速率:12 000 G/min,离心时间:15 min,离心环境温度:4℃)处理,并去上清(共分a、b、c等三步)。接着定量并将RNA浓度调至0.5 μg/μl。采用紫外分光光度仪检测并读取RNA的光密度(optical density,OD)值,将RNA反转录成cDNA(步骤按陈剑[5]执行)并计算此步骤中反应结束后各反应管的Ct值(重复实验条件:复孔间的Ct值之差>1)。见表1。

表1 弃去上清步骤
1.2.4 QR-PCR检测:取3个EP管(0.2 ml)并分别标记成以下三种应标本号:β-肌动蛋白(β-actin)、SPRY-2、AEG-1,β-actin为内参。接着将RNA逆转录成cDNA,步骤共2步。第一步反应体系的反转录仪的运行条件为70℃,反转录时间5 min,保存条件4℃。第一步结束后接着进行第二步逆转录反应,即将40 μl体系中前5中反应物震荡混匀和离心(离心1 000 g,1 min)处理放置于冰上设置反转录仪条件(37℃条件下60 min,95℃条件下5 min),4℃条件下恒定时将EP管置于反转录仪上进行反转录反应。Spry2、AEG-1的QR-PCR反应:均在96孔板中进行PCR扩增。反应结束后在此计算各反应管的Ct值(重复实验条件与上述相同)。见表2、3。
表2 RNA逆转录成cDNA步骤

表3 引物序列
1.2.5 结果判断:病理图像分析均由≥2名经验丰富的病理科医师评估,分析PC患者机体中的miR-21、SPRY-2、AEG-1在癌组织和癌旁组织中的表达,阳性细胞数平均百分比:该切片阳性细胞百分比(Percentage of positive cells,PPC),共4个等级:0≤PPC(0分)≤5%,6%≤PPC(1分)≤25%,26%≤PPC(2分)≤50%,51%≤PPC(3分)≤75%,PPC(4分)>75%,观察视野范围:每张切片随机观察5个中倍视野(*200),每个视野计数100个细胞;根据染色强弱分4个等级:无染色=0分,弱染色=1分,中等强度染色=2分,强染色=3分,积分方式为二者相加:阴性(-)<2分,2分<弱阳性(+)≤3分,4分≤阳性(++)≤5分,6分≤强阳性(+++)≤7分。QR-PCR中的miR-21表达量采用N=2-△Ct*10 000表示,配对的正常组织变换倍数采用N=2-△△C表示(肿瘤组织miRNA表达),△Ct、△△Ct计算公式:
△△Ct=(CtmiR-21-Ctβ-catein)肿瘤-CtmiR-21-Ctβ-catein)癌旁组织
△Ct=CtmiR-21-Ctβ-catein
1.3 统计学分析 应用SPSS 21.0统计软件,组间配对时的T、P检验采用PRISM6.0软件处理,双变量相关采用Spearman检验,两个相关样本、独立样本分别采用Wilcoxon检验、Mann-Whitney U检验,PC患者癌组织中的相对表达量为非正常分布,癌旁组织中参数表达则用非参数分析,P<0.05为差异有统计学意义。
2 结果
2.1 2组患儿临床有效率比较 通过QR-PCR仪绘制的熔解与扩增曲线来看,PC患者癌组织(浸润、转移癌组织及不典型增生组织)的miR-21表达水平显著高于癌旁组织,差异有统计学意义(P<0.05)。见表4,图1。
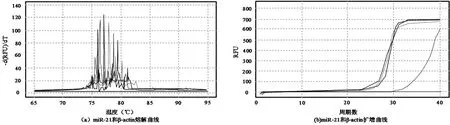
图1 miR-21和β-actin的熔解和扩增曲线

表4 不同癌变组织与癌旁组织中的miR-21表达
2.2 miR-21在PC细胞株中的表达及转染pre-miR-21/inhibitor对miR-21表达的影响 经QR-PCR法检测结果来看,PC患者细胞株AsPC-1、BxPC-3、Capan-1、Capan-2、CFPAC-1中的miR-21表达水平均处于异常增高,且以AsPC-1表达最高,较正常胰腺导管上皮细胞更高(P<0.05),提示PC患者癌细胞中的miR-21呈高表达。将上述表达水平最高的AsPC-1进行转染(48 h)实验后再次用QR-PCR法检测后发现,pre-miR-21转染组的miR-21表达显著高于anti-miR-21对照组,miR-21 injibotor转染组的miR-21表达缺显著低于anti-miR-NC对照组(P<0.05)。见表5。

表5 miR-21在PC细胞株中的表达及转染pre-miR-21/inhibitor对miR-21表达
2.3 miR-21表达对PC细胞增殖的影响 经Cell Counting Kit-8 细胞计数试剂(CCK-8)法检测发现,PANC-1细胞增殖能力上调与miR-21表达上调呈正比(P<0.05),同理MIAPaCa-2细胞的增殖能力下降时,miR-21表达也随之下调(P<0.05),提示PC癌细胞的增殖能力受miR-21的调控。见图2。

图2 miR-21表达与PC细胞增殖的关系
2.4 抑制NADPH氧化酶减弱PC细胞转移能力 原代细胞DPI培养(12 h)检测发现,原发性PC的侵袭能力受DPI的抑制效果与药物浓度呈正比(P<0.05),PC肿瘤细胞转移能力受DPI的抑制效果与药物治疗同样呈正比(P<0.05)。通过图3检测及DPI给药结果均证实,DPI给药可明显的降低PC患者原代肿瘤细胞内的活化氧簇(Reactive oxygen species,ROS)表达能力(P<0.05);而为降低PC原代肿瘤细胞的侵袭能力,本文还进行了阻断实验。结果发现,利用Mito-TEMP 0(ROS清除剂)阻断后的四甲基哌啶(ROS的类似物)表达显著下降(P<0.05)。见图3、4。
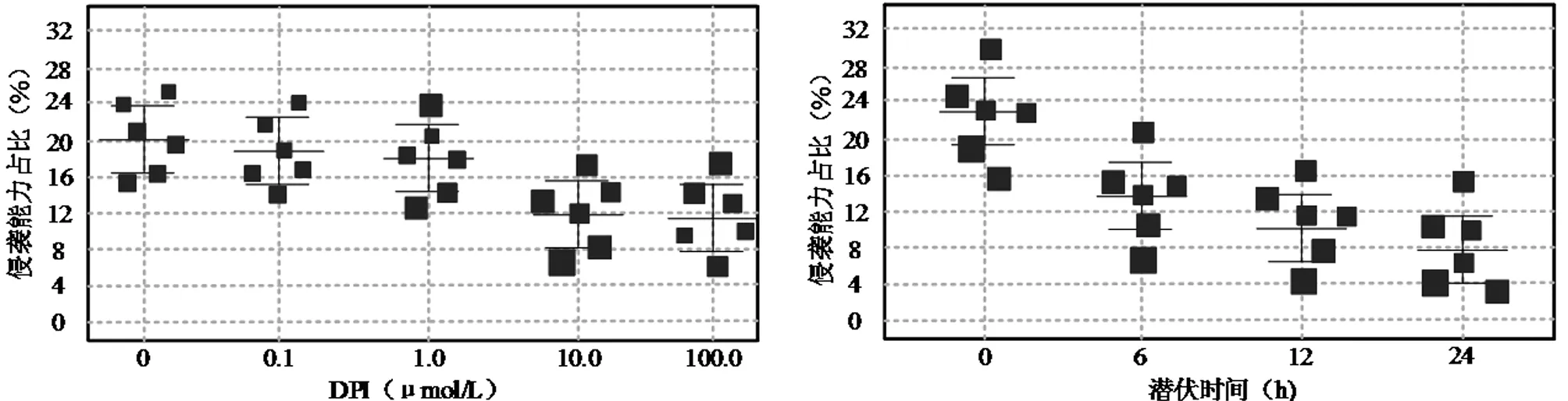
图3 DPI对PC肿瘤细胞的侵袭能力抑制剂药物浓度关系
2.5 MiR-21与SPRY-2和AEG-1 mRNA关系 经Person相关系数检测发现,SPRY-2和AEG-1 mRNA表达与miR-21之间的相关系数分别为-0.375和-0.365,P=0.033、0.041,提示PC癌组织中的miR-21与SPRY-2和AEG-1 mRNA表达呈负相关(P<0.05)。见图5。

图4 DPI给药下的ROS表达及阻断表达

图5 MiR-21与SPRY-2和AEG-1 mRNA关系散点图
2.6 经Spearman秩相关分析表明,PC患者癌组织中的SPRY-2蛋白表达与miR-21呈负相关(P<0.05),而AEG-1蛋白表达与miR-21无相关性(P>0.05)。见表6。
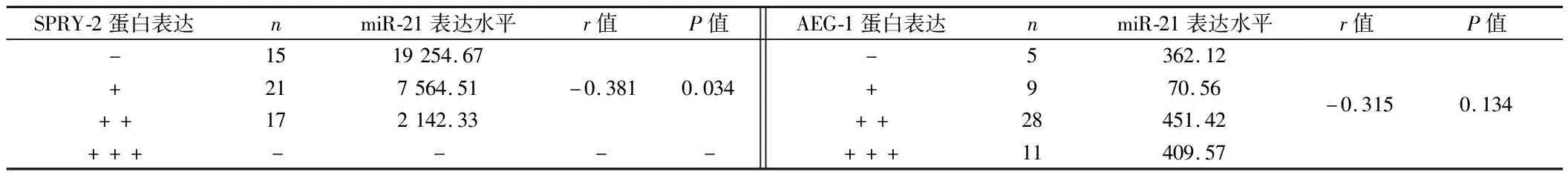
表6 PC癌组织中的SPRY-2、AEG-1蛋白表达与miR-21的Spearman秩相关
3 讨论
通常而言,miR-21是高度保守的。作为一种现代医学(动物实验、临床试验)研究最多的microRNA(非编码小分子RNA)之一,其参与细胞病变的过程主要是对靶基因mRNA翻译调节靶基因的表达进行降解与抑制,这就是它对机体生物学进程进行有影响的关键。越来越多的研究[5,6]证实,miR-21在各种肿瘤的增殖、转移、预后等过程均关系密切,且多呈高表达状态,当然也包括PC人群。据统计,PC的发病率、病亡率依旧处在增高态势,欧美国家近30年来PC发病率、病死率位居肿瘤发病率和恶性肿瘤病死率的第10、4位,而国内分别位居第7、4位,是世界范围内病死率极高的一种重要恶性肿瘤,预计在2030年左右可能成为癌症相关死亡的第二大常见、多发原因[6]。miRNA-RISC对靶基因的mRNA的作用主要有三种,第一种是对mRNA分子进行切断,第二种是对靶基因的翻译进行抑制,第三种是结合抑制,而上述三种方式作用的好坏,主要取决于miRNA-RISC与靶基因转录体序列互补的程度。故研究miR-21与PC的关系,是有望成为该病及相关并发症诊断与治疗的靶点之一的。
细胞的癌基因和抑癌基因表达异常,是导致癌症的关键因素。从目前掌握的流行病学相关研究来看,miR-21在各种癌症及肿瘤中均有参与,如前列腺癌、非小细胞肺癌、胶质母细胞瘤等,当然在PC中也有与miR-21相关的各种研究报道。既往研究发现,PC组织中呈高表达的不仅是miR-21,还有miR-222、miR-211、miR-155等[7]。17q23染色体FR17B的脆性区域是miR-21的定位范围,极易发生断裂与缺失,高保守性和具有组织转录单位是其主要特征。故当机体细胞组织中的的癌基因和抑癌基因表达异常时,miR-21常呈现出高表达状态,即表达失调。本文通过QR-PCR法检测发现,miR-21在53例PC患者的癌组织与癌旁组织中异常,且癌组织的miR-21表达显著高于癌旁组织(P<0.05),而结合既往相关的分子生物学研究来看,miR-21在PC发生发展、预后等过程中均发挥了重要作用,因此探析其与PC癌基因与抑癌基因的分子机制举足轻重。AsPC-1、BxPC-3、Capan-1、Capan-2、CFPAC-1、HPAC、HPAF-Ⅱ、Hs766T、MIA Paca-2、PANC-1、SU.86.86等是几种常见的PC细胞,功能各不相同,表达各异。通过QR-PCR法检测发现,PC患者的AsPC-1、BxPC-3、Capan-1、Capan-2、CFPAC-1细胞中的miR-21表达水平均处于异常增高状态,其中最高的是AsPC-1表达,较正常胰腺导管上皮细胞更高(P<0.05),AsPC-1主要来源于胰头癌原发肿瘤,分泌黏蛋白和癌胚抗原(carcinoembryonic antigen,CEA),有明显的转移倾向。AsPC-1转染(48 h)后pre-miR-21转染组miR-21表达高于anti-miR-21对照组,miR-21 injibotor转染组的miR-21表达低于anti-miR-NC对照组(P<0.05)。CCK-8法检测下PANC-1细胞增殖能力上调与miR-21表达上调呈正比,MIAPaCa-2细胞的增殖能力下降与miR-21表达下调成正比(P<0.05),说明PC癌细胞的增殖能力受miR-21的调控。还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)是最终电子受体NADP+接受电子后的产物[8],是产生活性氧的酶家族成员之一,在当前的临床医学中业已证明其在多种细胞类型中均有所表达。如有学者研究证实,肿瘤细胞中产生的高水平ROS表达水平不仅与癌症的进展相关,且与NADPH氧化酶活性关系密切[9]。抑制NADPH氧化酶对肿瘤细胞中的与miR-21表达有较好的调控作用。故本文将53例PC患者肿瘤组织中分离出来的原发细胞进行不同浓度的NOX氧化酶抑制剂(Diphenyleneiodonium Chloride,DPI)培养(12 h)与检测,结果发现,原发性PC的侵袭能力受DPI的抑制效果与药物浓度呈正比,PC肿瘤细胞转移能力受DPI的抑制效果与药物治疗呈正比(P<0.05)。同时DPI给药后PC患者原代肿瘤细胞内的ROS表达能力显著降低(P<0.05),且Mito-TEMP 0(ROS清除剂)阻断后的四甲基哌啶(ROS的类似物)表达显著下降(P<0.05)。上述研究均证实,抑制NADPH氧化酶可降低PC患者肿瘤细胞内的miR-21表达。
既往研究证实,SPRY-2在一些肿瘤细胞中呈现出明显的异常表达,如Xu等[10]证实SPRY-2作为一种新型的受体络氨酸激酶信号通路的抑制物,在胃癌癌组织中的表达显著偏低,且与5年生存率呈正比;如Shukla等[11]证实,慢性淋巴性白血病(chronic lymphocytic leukemia,CLL)的细胞组织中的SPRY-2表达依旧显著下调。AEG-1是常见的一种原癌基因,在多种肿瘤组织中均普遍表达,如余长云等[12]头颈部鳞状细胞癌组织中的上皮-间质转化便受AEG-1介导,参与癌细胞的浅析、转移;宋恩霖等[13]的子宫颈癌研究同样证实,AEG-1表达与该病患者的微血管生成关系密切。故本文针对SPRY-2、AEG-1在PC患者癌组织中的表达水平进行了Person相关系数和Spearman秩相关分析,结果发现,PC患者癌组织中的SPRY-2蛋白表达与miR-21呈负相关(P<0.05),而AEG-1蛋白表达与miR-21之间无相关性(P>0.05)。提示SPRY-2参与了PC患者的miR-21表达调控,这与既往研究中的SPRY-2能逆转PC癌组织中的MiR-21诱导的细胞增殖和迁移相近[14]。反之,miR-21可通过下调SPRY-2表达来促进PC患者肿瘤细胞的增殖与迁移。而Person相关系数和Spearman秩相关分析发现,AEG-1则不参与miR-21表达调控,故不赘述。
综上所述,PC患癌组织中的miR-21表达水平呈显著的高表达状态,抑制NADPH氧化酶可降低PC患者肿瘤细胞内的miR-21表达。miR-21与SPRY-2呈负相关,可通过下调SPRY-2表达来促进PC患者肿瘤细胞的增殖与迁移。可将其视作PC诊断的一种新型标志物。

