静脉-动脉血二氧化碳分压差和静脉血氧饱和度监测在感染性休克中的临床价值
倪世姣
江西省景德镇市第二人民医院内科,江西景德镇 333000
感染性休克多由脓毒症引起循环衰竭和细胞代谢异常的一种急性发作严重全身性疾病,致死率极高[1]。目前国内外对感染性休克患者诊断流程多以监测包括血压心率及脉搏呼吸等生命体征以支持感染诊断[2]。静脉血氧饱和度(central venous oxygen saturation,ScvO2)指血氧在静脉血中所占比例,可用于指导感染性休克患者液体复苏水平[3]。当患者存在低氧代谢、血流动力学异常时,便会出现组织存在低灌注而ScvO2水平却升高现象,因此,单纯ScvO2水平并不能有效监测指导医护人员对患者进行相关治疗[4]。静脉-动脉血二氧化碳分压差[difference of partial pres sure of carbon dioxide in venous-arterial blood,P(cv-a)CO2]是血气分析的一项重要指标,指物理溶解在动脉血中的二氧化碳(CO2)分子所产生张力,能有效反映感染性休克患者组织缺血缺氧程度,一定程度能作为反映患者组织器官灌注水平指标[5]。本研究探讨[P(cv-a)CO2]和ScvOb 监测在感染性休克的临床价值。
1 资料与方法
1.1 一般资料
选取2018年10月至2020年10月景德镇第二人民医院收治的86 例感染性休克患者作为研究对象,采用随机数字表法分为对照组(43 例)和治疗组(43 例)。对照组中,男21 例,女22 例;年龄17~86岁,平均(43.27±7.54)岁;病程3~17 h,平均(7.13±2.24)h。治疗组中,男19 例,女24 例;年龄17~86 岁,平均(44.91±8.03)岁;病程2~19 h,平均(8.45±2.97)h。两组的一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:①符合《实用临床治疗学》[6]中相关诊断标准者;②感染性休克时间≤24 h;③未合并恶性肿瘤等疾病者。排除标准:①合并心、肝、肾等重要器官疾病者;②患有血液及免疫系统功能疾病者;③预测24 h内死亡者。本研究经医院医学伦理委员会批准,患者及家属知情并签署知情同意书。
1.2 方法
两组常规放置中心静脉导管,对照组以患者个体ScvO2水平为指导目标进行液体复苏,液体复苏中平均动脉压(mean arterial pressure,MAP)65~90 mmHg(1 mmHg=0.133 kPa),中心静脉压(central venous pres sure,CVP)8~12 mmHg,尿液量每小时≥1.5 ml/kg,治疗全程ScvO2水平不低于70%。治疗组以患者个体ScvO2水平联合P(cv-a)CO2水平为指导目标进行液体复苏,并在对照组的治疗方案上每小时计算1 次P(cv-a)CO2水平,当P(cv-a)CO2水平≥6 mmHg 时患者需重新进行滴定治疗。两组均在复苏6 h 后持续观察28 d。
1.3 观察指标及评价标准
比较两组的治疗情况、液体复苏前及液体复苏6 h 后生理指标及乳酸清除率和预后情况。①两组治疗情况的比较,记录两组的去甲肾上腺素用量和住院时间。②两组液体复苏前及液体复苏6 h 后生理指标及乳酸清除率的比较,记录两组液体复苏前及液体复苏6 h 后的CVP、MAP、ScvO2水平,计算两组液体复苏6 h 后的乳酸清除率。乳酸清除率=(液体复苏前乳酸水平-复苏6 h 后乳酸水平)/液体复苏前乳酸水平×100%。③两组预后情况的比较,统计两组的液体复苏6 h 后肺水肿发生率及28 d 内病死率。
1.4 统计学方法
采用SPSS 13.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用t 检验,计数资料用率表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组治疗情况的比较
治疗组的住院时间短于对照组,去甲肾上腺素用量少于对照组,差异均有统计学意义(P<0.05)(表1)。
表1 两组治疗情况的比较(±s)
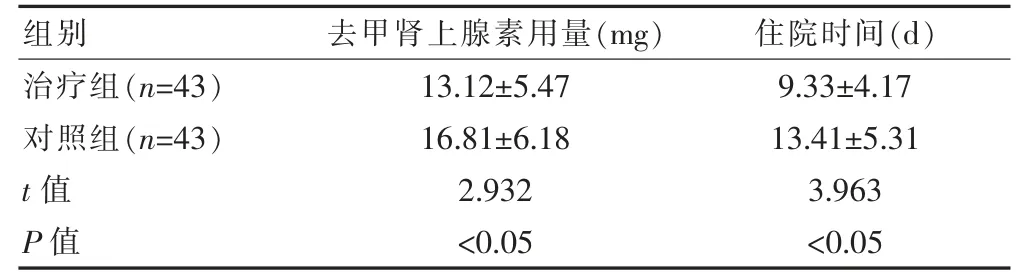
表1 两组治疗情况的比较(±s)
组别 去甲肾上腺素用量(mg) 住院时间(d)治疗组(n=43)对照组(n=43)t 值P 值13.12±5.47 16.81±6.18 2.932<0.05 9.33±4.17 13.41±5.31 3.963<0.05
2.2 两组液体复苏前与液体复苏6 h 后生理指标及乳酸清除率的比较
两组液体复苏前的生理指标及乳酸清除率比较,差异无统计学意义(P>0.05);两组液体复苏6 h 后的CVP、MAP、ScvO2水平高于液体复苏前,且治疗组的CVP、ScvO2水平及乳酸清除率高于对照组,差异均有统计学意义(P<0.05);液体复苏6 h 后两组的MAP水平比较,差异无统计学意义(P>0.05)(表2)。
表2 两组生理指标及乳酸清除率的比较(±s)
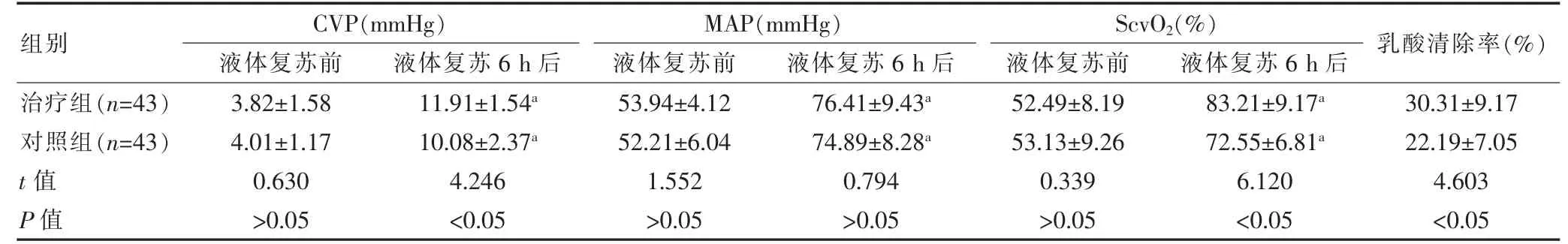
表2 两组生理指标及乳酸清除率的比较(±s)
与本组液体复苏前比较,aP<0.05
组别 CVP(mmHg)液体复苏前 液体复苏6 h 后MAP(mmHg)液体复苏前 液体复苏6 h 后ScvO2(%)液体复苏前 液体复苏6 h 后 乳酸清除率(%)治疗组(n=43)对照组(n=43)t 值P 值3.82±1.58 4.01±1.17 0.630>0.05 11.91±1.54a 10.08±2.37a 4.246<0.05 53.94±4.12 52.21±6.04 1.552>0.05 76.41±9.43a 74.89±8.28a 0.794>0.05 52.49±8.19 53.13±9.26 0.339>0.05 83.21±9.17a 72.55±6.81a 6.120<0.05 30.31±9.17 22.19±7.05 4.603<0.05
2.3 两组预后情况的比较
两组的肺水肿发生率及28 d 内病死率比较,差异无统计学意义(P>0.05)(表3)。
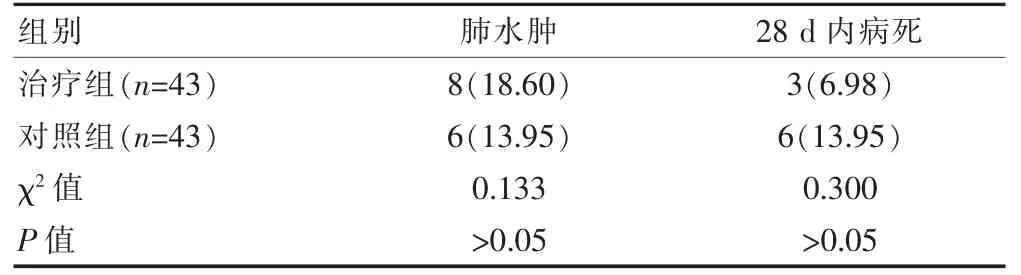
表3 两组预后情况的比较[n(%)]
3 讨论
感染性休克为高动力性休克,其病死率高达40%以上[8]。目前,国内外对感染性休克的诊断流程多以监测患者生命体征并判断感染部位进行诊断[9]。当ScvO2低于70%时,则代表感染性休克患者仍存在供氧失衡情况,可用于作为液体复苏时的指导指标[10]。但有时感染性休克患者微循环出现严重循环障碍,使机体ScvO2水平已达标,但组织仍存在血流动力学异常、低氧代谢等症状。因此单纯ScvO2水平无法有效指导医护人员对感染性休克患者进行液体复苏[11]。
P(cv-a)CO2为反应机体血流量循环指标,能有效反映感染性休克患者机体组织缺血缺氧程度,反应患者液体治疗后组织器官灌注情况[12]。本研究结果显示,治疗组的CVP、ScvO2水平及乳酸清除率高于对照组(P<0.05),提示ScvO2联合P(cv-a)CO2指导感染性休克患者液体复苏有利于医护人员临床治疗开展,与牛杏果等[13]研究结果一致。感染性休克为常见危重症,其致死率极高,且有效循环状态血容量不足为临床病理生理抢救重点。P(cv-a)CO2能有效表达血液灌注时二氧化碳分压情况,监测患者抢救时循环状态血容量情况。本研究结果显示,治疗组的住院时间短于对照组;去甲肾上腺素用量少于对照组(P<0.05),提示ScvO2联合P(cv-a)CO2指导感染性休克患者液体复苏能有效提高液体复苏治疗质量,促进患者愈合,与罗真春等[14]研究结果一致。感染性休克患者出院1年后病死率依旧远超出其他疾病的病死率,从远期预后来看,患者常出现认知功能障碍及体能下降等后遗症[15]。以P(cv-a)CO2联合联合ScvO2监测指标用于指导感染性休克患者临床液体复苏,其质量有进一步提高可能性。本研究结果显示,两组的肺水肿发生率及28 d 内病死率比较,差异无统计学意义(P>0.05),尚无法证实ScvO2联合P(cv-a)CO2检测指导感染性休克患者液体复苏无法降低其病死率,安全性高,与顾晓蕾等[16]研究结果一致。
综上所述,P(cv-a)CO2联合ScvO2作为监测指标指导感染性休克患者进行液体复能有效提高液体复苏质量,提升治疗效果,缩短住院时间,减少相关用药量,且患者液体复苏后肺水肿发生率并未升高,但相关数据尚需进一步研究证实,有临床推广与应用价值。

