白术腋芽离体快繁技术初探
李红英,陈菲菲,殷红清,覃大吉,孙举志,杨永康,向极钎,李亚杰
(1.恩施土家族苗族自治州农业科学院,湖北 恩施 445000;2.湖北省富硒产业技术研究院,湖北 恩施 445000)
白术(Atractylodes macrocephalaKoidz.)是一种名贵中药材,具有健脾益气、燥湿利水、止汗安胎等功效[1-7]。近年来,白术药材应用广泛,市场需求大,但白术品种严重退化,生产周期长,土壤不能连续利用,只能轮作,给栽培带来许多困扰。导致白术药材产量与质量严重下降,无法满足市场需求。鉴于此,本试验采用无菌优良白术种苗(生产上表现好的一类型Ⅱ[8])为外植体,开展组培快繁技术与提纯复壮研究工作,得到一种优良、稳定、健壮的新品种,促进了白术次生代谢产物的研究与开发[9,10],进一步缩短了生产周期,扩大繁殖系数,改善白术药材的生产现状,为白术新品种选育技术奠定了一定的基础。
1 材料与方法
1.1 材料
以无菌培养体系中白术优势种群、优良单株、健壮、幼嫩的白术苗为外植体,根据外植体的大小和腋芽的多少将其修剪成1.0~2.5 cm长的一叶一芽的小腋芽,每株可修剪成3~5个小腋芽,置于培养皿中。
1.2 方法
1.2.1 丛生芽分化诱导液体培养基的筛选 使用经过高压灭菌的医用镊子、医用剪刀,将处理好的小腋芽按每瓶一个直接接种到装有丛生芽分化诱导液体培养基支撑垫(腋芽托,其中所用培养瓶为圆柱形的300 mL玻璃瓶,每瓶装60~80 mL液体培养基,液面上加一个支撑垫,接种时支撑垫的一半浸在丛生芽分化诱导液体培养基中。下同)上:1/2 MS、1.0~2.0 mg/L 6-BA、0.4~0.8 mg/L NAA、0.1~0.5 mg/L IBA、0.2~0.6 mg/L GA3、35~50 g/L蔗糖,pH 5.8~6.0,并于光照时间10~20 h/d,光照度1 500~2 000 lx,温度(24±2)℃的培养室中培养10~15 d,应用L(934)正交试验统计结果。
1.2.2 对分化诱导形成的丛生芽进行生长培养 在超净工作台上,将分化诱导形成的丛生芽培养到1~2 cm后,将原有培养基吸出,灌入生长液体培养基:MS+20~40 g/L蔗糖,每瓶装80~100 mL,支撑垫的一半浸在液体生长培养基中。培养11~15 d即可长满瓶。
1.2.3 对生长培养的丛生芽进行生根诱导液体培养基筛选 在超净工作台上,将培养的丛生芽修剪成1~2 cm长的小腋芽,按每瓶1~5芽转接到生根诱导液体培养基中:1/4 MS、0.1~0.7 mg/L NAA、0.2~0.5 mg/L IBA,蔗糖30~50 g/L,pH 5.8~6.0。于光照时间10~20 h/d,光照度1 500~2 000 lx,温度(24±2)℃的培养室中培养7~12 d后,以30株为一组,每组3次重复,统计试验结果。
1.2.4 对生根诱导培养的丛生芽进行壮苗培养 在超净工作台上,待新根长出0.5~1.5 cm时,将丛生芽诱导生根液体培养基吸出,再灌入壮苗液体培养基:MS+20~40 g/L蔗糖,pH 5.8。并于光照时间10~20 h/d,光照度1 500~2 000 lx,温度(24±2)℃的培养室中培养7~10 d。
1.3 炼苗移栽
对通过壮苗培养的丛生芽进行炼苗处理(敞瓶炼苗、基质炼苗);将生根壮苗培养基置于炼苗室常温闭瓶炼苗0~3 d,旋松生根培养基的培养瓶盖0~2 d,全开瓶盖1~3 d;敞瓶炼苗完成后将白术苗置于清水中,洗去根部培养液,捞出,移栽至装有泥炭土∶珍珠岩按2∶1比例配成的混合物穴盘基质中,每2 d喷水1次,3 d后喷施1 g/L的多菌灵或甲基托布津,隔5 d再喷施1次以防病菌。15 d后逐渐减少喷水的次数,并定期喷施一次组分为1/8 MS的营养液,生长20~30 d,待有新生根系将基质包裹,形成稳定的根系基质系统,即可定植于富含腐殖质的沙质土壤中。以300株为一组,分为5组,培养20 d后分别统计成活率。成活率为95%以上。
1.4 苗圃移栽和管理
生产白术栽子(白术种苗):将4—6月移栽至苗圃的白术丛生芽苗,返青期间(移栽30~40 d)进行适当遮阳,10 d浇水一次,15 d喷施一次1 g/L多菌灵以防病菌,返青期后,去掉遮阳设备,在白术丛生芽苗的行间施一定量的农家肥,进行人工除草,按照白术种苗生产技术规程(DB42/T 328—2005)的要求进行栽培管理。10月下旬到11月上旬起挖根茎,勿伤主芽和根状茎表皮,置室内通风处摊放5~10 d,待外皮发白时,贮藏待种。以50株为一组,分别以5组试验为对比,分析白术组培苗与种子苗的产量。
1.5 白术栽子进行分级和包装
将所得典型白术优势种群的种苗,依据白术种苗等级标准,按根茎重、根数、根茎直径和感观指标分为一、二、三等。进行分级和包装。
2 结果与分析
2.1 白术腋芽分化诱导液体培养正交试验结果
正交试验因素和水平及结果见表1和表2,腋芽分化诱导培养4~10 d后,观察到腋芽开始生长分化;经分化诱导25 d后,平均每瓶可长出3.0~5.5个丛生芽,每个丛生芽可修剪成3~5个小腋芽,增殖倍数为9.0~27.5。由R1的大小可知,影响白术丛生芽增殖率依次为B>D>C>A,由R2的大小可知,影响白术丛生芽增值倍数依次为D>B>C>A;9组试验中只有第四组试验所得白术丛生芽增殖率与增殖倍数最佳。因此,得到最优白术腋芽分化诱导液体培养基的植物生长素为A2B1C2D3,即1/2 MS+1.5 mg/L 6-BA+0.4 mg/L NAA+0.3 mg/L IBA+0.6 mg/L GA3为白术腋芽分化诱导较为理想的培养基。此条件下白术腋芽丛生芽增殖率高达97.3%,增殖倍数为16。

表1 正交试验因素和水平 (单位:mg/L)
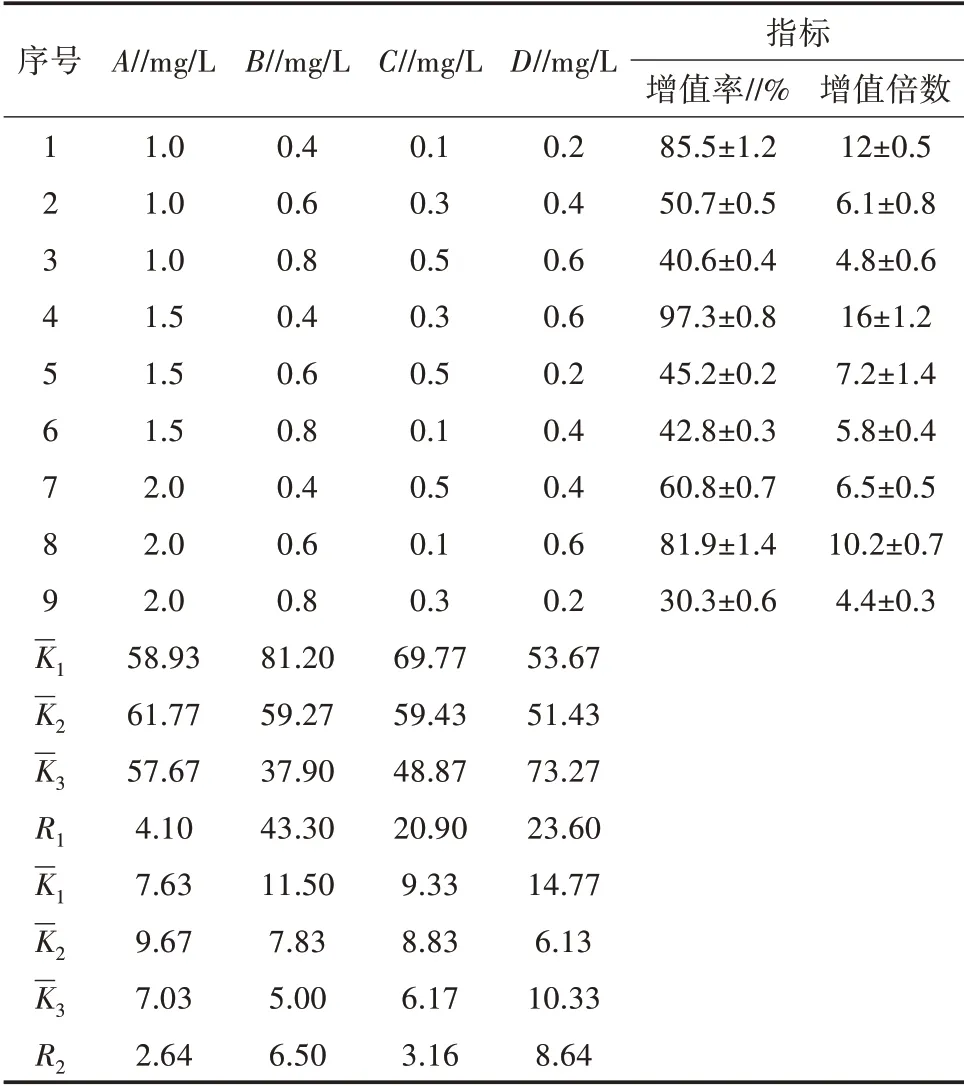
表2 正交试验结果及分析
2.2 丛生芽生根诱导液体培养基筛选结果
结果见表3,将培养到2 cm左右的白术丛生芽剪切后转到生根培养基中,培养4~6 d后,观察到新根长出。4~10 d后观察到根和芽开始生长,培养20 d后,平均生根数为6~8根/芽,生长素NAA和IBA共同作用能促进白术试管苗快速生根,但是生长素浓度大小差异明显,生根效果以1/4 MS+0.2 mg/L IBA+0.4 mg/L NAA最佳,浓度过高时根容易形成饼状畸形,浓度过低生根时间较长,生根率较低。

表3 植物生长素诱导丛生芽生根效果,以1/4 MS为基础
2.3 移栽试验结果
试管苗移栽较适空气湿度保持在75%~85%,遮光率40%,环境温度控制在20~26℃,定期喷施营养液,并加强移栽后管理,定时喷施杀菌剂,做好防霉防病工作。4—6月常温下均可移栽,20 d后,统计成活率为94%以上。
2.4 白术栽子苗与种子栽子苗的比较
通过对组培苗规范性管理,所得的白术无性种苗大小均匀,皆是典型白术优势种群Ⅱ的种苗类型,无畸形,组培苗一年生种苗平均单株重是咸丰白术种子种苗的3.37倍,明显优于种子种苗(表4)。

表4 白术种子种苗与组培苗产量比较(单位:g)
2.5 对苗圃生产的白术栽子进行分级和包装
按照白术种苗等级标准,将白术栽子划分为一、二、三等,其中一等为80%,二等为15%,三等为5%。可见组培苗生产出的白术栽子80%以上为上等,大大提高了种苗的质量与产量。增加了育苗的新途径,加大了种苗的育种进程。
3 小结
白术类型Ⅱ作为优良单株繁殖的无菌体系,不仅在试管苗阶段既能保持较好的遗传品质和母体遗传的稳定性,又能将优良品种应用到实际生产中,因此,白术类型Ⅱ可选为无菌体系外植体。
6-BA、NAA、IBA、GA34种植物生长调节素相互作用共同促进白术腋芽诱导分化的形成培养,加上运用植物液体培养条件,大大提高了白术的繁殖系数和缩短了白术扩繁的生长周期,每个周期可以扩大上万倍的试管苗,如果外界条件允许,比如建有保温大棚等,每个季节都可以移栽试管苗,再不受季节的影响,随时都有白术苗出售,这为育种和生产过程中保存和利用优质中间体材料提供了科学的依据,克服了种子繁殖后代性状严重分离的现象,也缩短了白术品种选育年限。
生长素IBA、NAA共同促进白术试管苗根的生长,大约转接4 d后生根,根系生长发达旺盛,大约21 d便可以移栽,不受季节的影响,而原来单独利用NAA生长素促进白术根的生长,受到植株季节的影响,春季生长快速,但是夏、秋、冬三个季节生长却很缓慢,甚至停止生长。这个突破点,为白术药材品质的筛选奠定了一定的基础。

