葡萄种质资源抗霜霉病鉴定研究
李东奎,许一博,王跃进
(西北农林科技大学园艺学院/旱区作物逆境生物学国家重点实验室/农业农村部西北地区园艺作物生物与种质创制重点实验室,陕西杨凌 712100)
葡萄是一种广泛栽培的果树,在世界和我国园艺作物中都有很高的经济价值[1-2]。据世界粮农组织(FAO)数据显示,2019年全球葡萄栽培面积达到692.6万 hm2,总产量达到7713.9万 t。其中,我国葡萄面积74.6万 hm2,居世界第二位;葡萄产量达1437.2万 t,居世界第一位。葡萄生产中的主栽品种以欧洲葡萄为主,品质好,风味佳,用途广泛,但易感霜霉菌、白粉菌等真菌病害[3]。病害发生时,以化学方法喷药为主,这不仅增加生产成本、造成环境污染,还会导致杀菌剂残留,降低葡萄品质,造成巨大的经济损失[4]。从长远看,进行抗性育种是解决欧洲葡萄品种抗病性差的有效途径。葡萄抗病育种的前提是拥有抗病的种质资源,中国作为葡萄属植物的重要起源中心之一,拥有丰富的野生葡萄种质资源,对霜霉病表现出极好的抗性[2]。因此,对包括中国野生葡萄在内的种质资源进行抗霜霉病的田间自然鉴定,筛选抗病种质资源,对于抗霜霉病育种具有重要的科学意义。
霜霉病是葡萄最具破坏性的真菌病害之一,是由一种来自北美野生葡萄上的霜霉菌(Plasmopara viticola)引起[5],后来通过砧木、接穗等途径在欧洲各主产区传播爆发,对欧洲葡萄与葡萄酒产业造成巨大的损失[4]。我国由于早期缺乏相应的检验检疫措施导致霜霉病进入并大规模发病。葡萄霜霉菌主要侵染叶片,在环境条件适宜时,病菌在一个生长季内连续繁殖多代,导致病情呈暴发式发展,使树体光合性能降低,光合产物合成受阻,从而影响葡萄产量和果实品质[6-7]。
在田间自然条件下,根据发病率调查葡萄种质资源发病情况。按照感病指数统计,将葡萄种质与株系的抗病性分成5级[8]。对中国野生葡萄10个种29个株系以及17个欧洲品种、9个欧美杂种进行霜霉病抗病性鉴定,筛选抗霜霉病的种质资源。同时,采用苯胺蓝染色法,结合荧光显微镜技术对霜霉菌在抗病株系和感病品种中的侵染过程进行观察,并利用实时荧光定量PCR检测技术对葡萄霜霉菌抗病相关基因的表达进行分析,进一步证实葡萄种质资源的抗病表现,以期为葡萄抗霜霉病育种提供依据。
1 材料与方法
1.1 试验材料
2019—2020年在霜霉病流行后期的9月进行调查。田间自然抗病鉴定材料为中国野生葡萄10个种29个株系以及17个欧洲品种、9个美洲品种共计55份。田间试验于西北农林科技大学葡萄种质资源圃进行,室内分析研究在国家旱区作物逆境生物学实验室与农业部西北地区园艺作物生物与种质创制重点实验室进行。
1.2 葡萄霜霉病田间抗病性鉴定
按照叶片感病面积占整个叶片面积的百分比,将葡萄抗霜霉病分为0~7共8个级别进行调查统计,然后用加权的方法统计出植株发病的感病指数[18]。计算公式如下:
感病指数=Σ(病极值×该级发病叶数)/(调查总叶数×最高病极值)×100%
根据感病的严重程度把材料分成5级[8]。具体是:0为免疫或未发病;0.1~5.0为高抗;5.1~25.0为抗病;25.1~50.0为感病;50.1~100为高感。
1.3 葡萄叶片苯胺蓝染色过程
苯胺蓝染色液制备方法参考李卓[9]方法。取0.05 g苯胺蓝溶于100 mL磷酸二氢钾(0.067 Mol)中制备0.05%苯胺蓝染色液。将霜霉菌孢子囊悬浮液(2 ×104cfu/mL)均匀喷洒在葡萄叶背并套袋。分别于接种后0、12、36、60、84 h取样浸泡于0.05%苯胺蓝染色液中过夜。将叶背面朝上放在载玻片上,用蓝紫光观察菌丝生长情况。
1.4 荧光定量PCR分析抗病基因的表达
实时荧光定量PCR的引物设计参照Cheng等[10-11]列于(表1),对‘丹凤-2’‘塘尾’‘白玉霓’‘黑比诺’人工接种霜霉菌处理,于接种后0、12、24、48、72、96 h分别采样提取RNA。提取方法参照Hipure Plant RNA Mini Kit试剂盒(Magen R4151-02)的说明书。反转录合成cDNA的方法参照SumOnetube RT Mixture Ⅲ(gDNA removal)试剂盒(夏末科技 SUM7806)的说明书。稀释后的cDNA作为qRT-PCR的模板。以葡萄Actin为内参基因。实验方法参考Shi[12]进行3 次生物学重复,每处理 3次技术重复。

表1 实时荧光定量引物Table 1 Real time-PCR reaction primers
1.5 数据统计与分析
用Excel软件对大田统计数据进行整理分析,用Origin 8.0绘制实时荧光定量PCR数据分析图。基因相对表达量的显著性分析通过SPSS 25.0单因素方差分析的LSD法分析比较检验(P<0.01)差异结果。
2 结果与分析
2.1 葡萄霜霉病田间自然抗病性鉴定
2.1.1 中国野生葡萄霜霉病田间自然抗病性鉴定
利用田间自然抗病鉴定的方法对中国野生葡萄10个种29个株系进行抗霜霉病鉴定(表2)。其中,中国野生种华东葡萄商南-1、湖南-1、商南-2,毛葡萄南郑-1,复叶葡萄眉县-6、白水-40、渭南-3,瘿薁葡萄安林-2、安林-3对霜霉病有较高的抗性;复叶葡萄留坝-11、留坝-9为易感霜霉病株系。
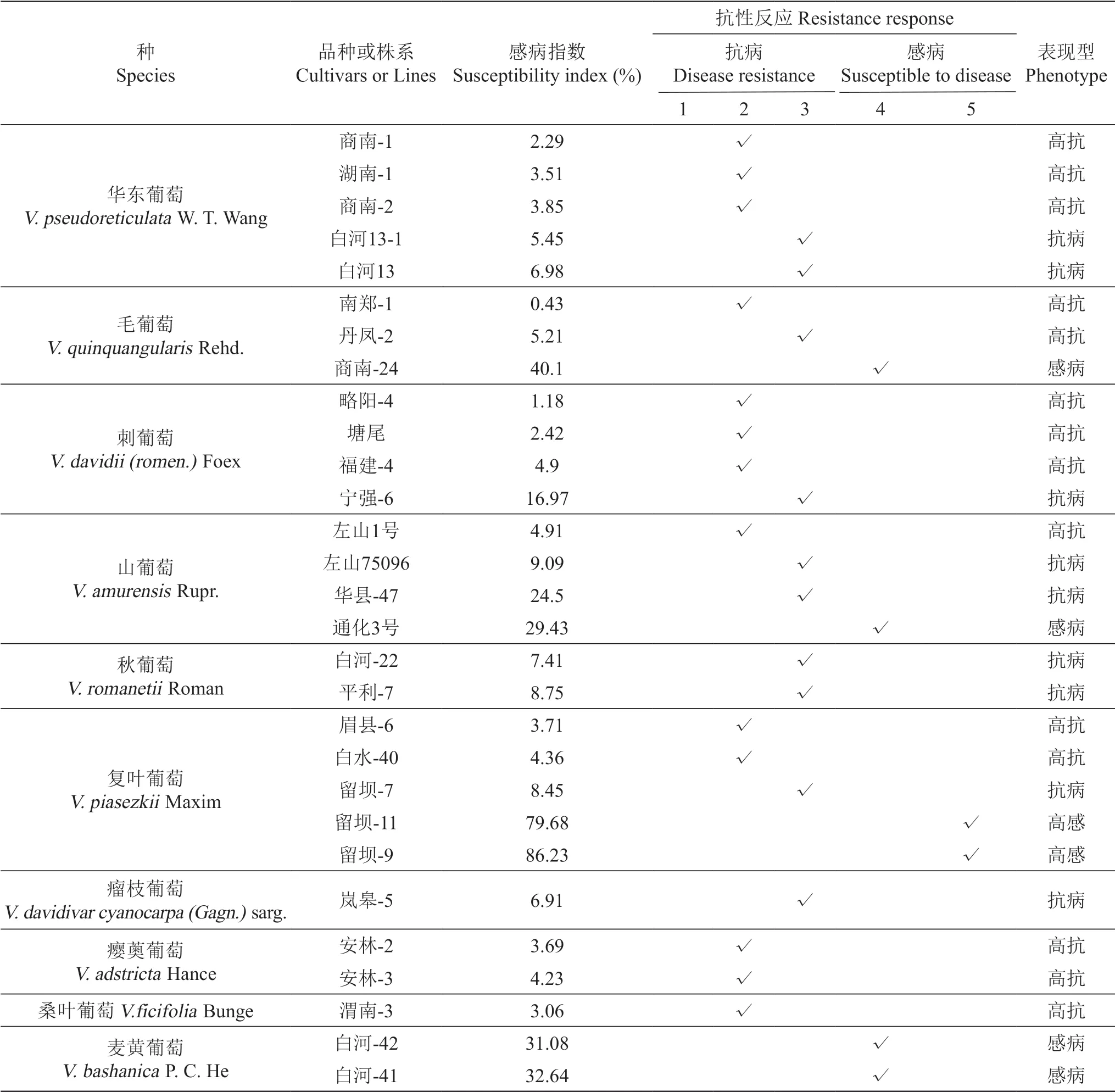
表2 田间自然条件下中国野生葡萄对霜霉病的抗性鉴定Table 2 Identification of Chinese wild Vitis resistance to downy mildew under natural conditions in the field
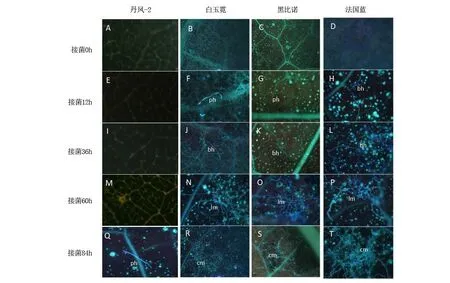
图1 人工接种霜霉菌侵染过程菌丝生长观察Figure 1 Observation of the infection process of Plasmopara viticola inoculated hypha
2.1.2 欧洲种与欧美杂种葡萄霜霉病田间抗病性鉴定
利用田间自然抗病鉴定方法对17个欧洲种、9个欧美杂种进行抗霜霉病鉴定。其中欧美杂种‘瑞比尔’‘SO4’‘高妻’对霜霉病有较高的抗性;欧洲品种‘白诗南’‘法国蓝’‘黑玫瑰’易感霜霉病(表3)。
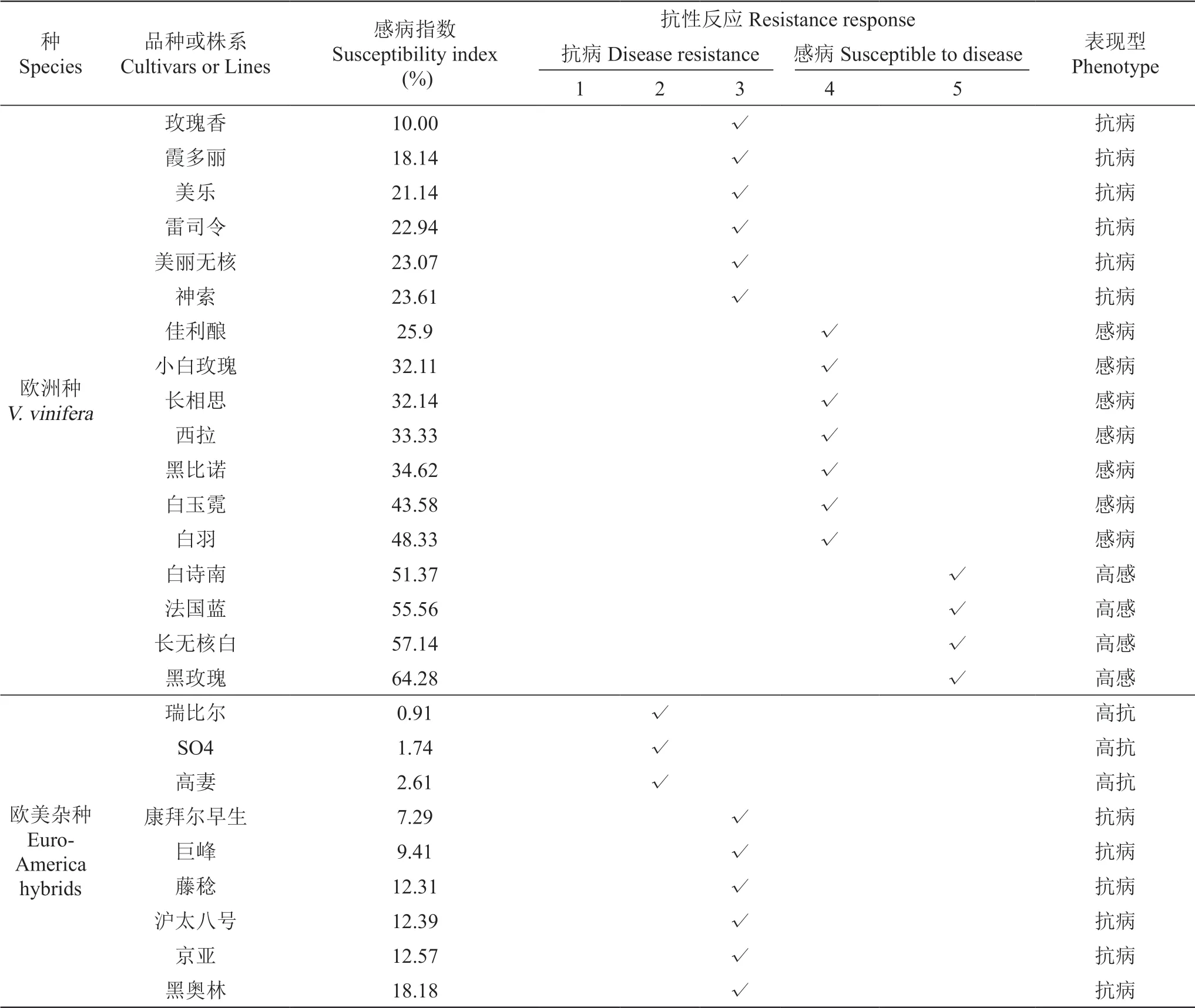
表3 田间自然条件欧洲葡萄与欧美杂种葡萄对霜霉病的抗性鉴定Table 3 Identification of resistance European varieties and Euro-America hybrids to downy mildew under natural conditions in the field
2.2 田间人工接种霜霉菌的侵染菌丝观察
利用人工接种的方法对抗病株系丹凤-2,感病品种‘白玉霓’‘黑比诺’‘法国蓝’进行人工接种霜霉菌处理,观察侵染过程。发现丹凤-2接种霜霉菌84 h后可观察到初生菌丝;‘白玉霓’接种12 h后有初生菌丝,36 h后有分支的长菌丝,84 h后出现聚集成团的长菌丝;‘黑比诺’接种12 h后可观察到长菌丝,36 h后可观察到有分支的长菌丝,60 h后出现聚集成团的长菌丝,84 h后出现坏死;‘法国蓝’接种12 h后可观察到长菌丝, 36 h后可观察到有分支的长菌丝,84 h后出现聚集成团的长菌丝。霜霉菌侵入‘白玉霓’‘黑比诺’‘法国蓝’后,菌丝的生长和发育明显快于丹凤-2。
2.3 部分种质抗病相关基因表达水平
通过病原菌侵染观察,对不同种质的入侵能力不同,这可能与组织结构有关,也可能与抗病基因表达后促进抵抗病原菌入侵的物质累积有关。对两个中国野生葡萄抗病株系丹凤-2、塘尾和两个易感品种‘黑比诺’‘白玉霓’接种霜霉菌后进行qRT-PCR分析,通过检测抗病相关基因的表达结果显示,抗病基因在抗病品种和易感品种中的表达有显著差异,中国野生葡萄抗病株系丹凤-2的叶片接种霜霉菌12 h后苯丙氨酸解氨酶基因PAL表达量显著提高,芪合酶基因STS接种霜霉菌96 h后表达量显著高于易感品种‘黑比诺’‘白玉霓’;中国野生葡萄抗病株系丹凤-2、塘尾的叶片接种霜霉菌后病程相关基因非表达子NPR1基因均出现表达量递减的情况;中国野生葡萄抗病株系丹凤-2、塘尾和两个易病品种‘黑比诺’‘白玉霓’的叶片在人工接种霜霉菌后,类甜蛋白基因TLP均出现表达量递增的趋势。
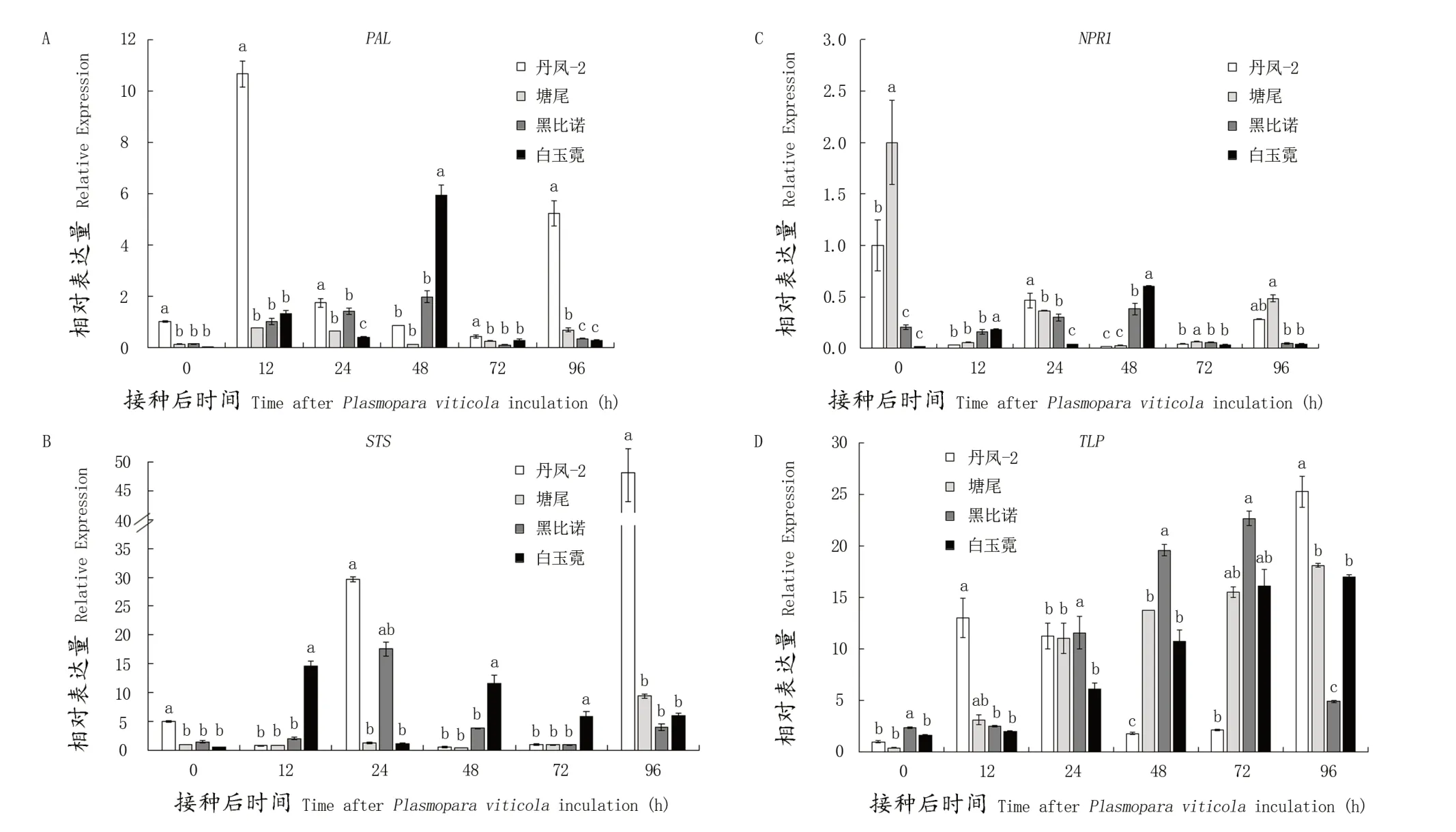
图2 不同葡萄接种霜霉菌处理后抗病相关基因差异表达Figure 2 Expression of disease resistance-related genes after Plasmopara viticola inoculation in different grapevinesA:苯丙氨酸解氨酶基因PAL基因相对表达量;B:芪合酶基因STS相对表达量;C:病程相关基因非表达子NPR1相对表达量;D:类甜蛋白基因TLP相对表达量。显示为平均值±SD(n=3);a代表极显著(P<0.01)A:The relative expression of PAL gene; B: The relative expression of STS gene; C: The relative expression of NPR1; D:The relative expression of TLP. The data were showed as mean value±SD (n=3).a highly significant (P<0.01), respectively
3 讨论与结论
中国蕴藏着丰富的野生葡萄种质资源[13],鉴定这些资源的抗病性是抗病育种的前提。贺普超等提出中国野生葡萄抗霜霉病的鉴定方法并对中国野生葡萄21个种67个株系和部分欧洲品种进行抗病性鉴定认为,华东葡萄、燕山葡萄、瘤枝葡萄、复叶葡萄、秋葡萄对抗霜霉病具有良好的抗性[14]。本次田间自然抗病性鉴定也发现,中国野生葡萄华东葡萄商南-1、湖南-1、商南-2,复叶葡萄眉县-6、白水-40,秋葡萄白河-22、平利-7等株系对霜霉病都有较高的抗性。Blaich利用人工接种方法对45个欧洲种、32个美洲种及26个欧美杂交子代进行接种霜霉菌处理,发现接种后欧洲种最容易表现症状,其次为欧美杂交子代,最不容易出现症状的为美洲种[15]。Bower以欧洲种为试材,利用田间自然抗病性鉴定法对29个欧洲种进行鉴定后认为,不同品种对霜霉病的抗性也不同[16]。Burruano利用人工接种霜霉菌的方法对不同葡萄品种接种后发现,霜霉菌在不同品种中的生长速度不同,其中霜霉菌在欧洲品种中生长最快[17]。本试验田间自然抗病性鉴定也发现,中国野生种、欧美杂交子代对霜霉病的抗性普遍高于欧洲品种。利用苯胺蓝染色的方法发现霜霉菌侵入感病的欧洲品种‘白玉霓’‘黑比诺’‘法国蓝’后,其菌丝的生长和发育明显快于侵入中国野生葡萄抗病株系丹凤-2;Trouvelot以18个欧洲种、11个美洲种为试材,人工接种霜霉菌的侵染过程发现,在接种霜霉菌5 d后,18个欧洲种中有17个出现坏死性病斑,而11个美洲种均没有出现坏死性病斑[18],这与本试验结果类似。万怡震等[19]对中国野生葡萄17个种的67个株系在自然条件下进行抗病性鉴定,发现多个株系对霜霉病抗性鉴定结果与本鉴定结果存在一定的差异,这可能与年份、树龄及病原菌积累有关,这为进一步的研究提供了方向。Javier以21个美洲品种和60个欧洲品种为试材,利用离体接种鉴定的方法进行霜霉病抗性评价后认为,欧洲种对霜霉病的抗性普遍低于美洲种[20]。Toffolatti以美洲种、欧洲种以及欧美杂种为试材,人工接种霜霉菌后从组织结构抗性和生理生化抗性进行分析后认为,美洲葡萄对霜霉菌较高的抗性与叶片结构和抗病基因的表达有关[21]。
组织结构是植物抵抗真菌病害的重要器官[22]。在棉花、蚕豆、枣树[23-25]等植物中都发现物理防御机制是植物抵御真菌侵染的重要方式。早期Marois以‘无核白’为试材利用氯仿溶剂除去葡萄表皮蜡质层后发现,‘无核白’对灰霉病的抗性显著降低[26];Selim以‘无核白’和‘雷司令’为试材利用实时荧光定量PCR技术分析后认为,葡萄叶片下表皮中的壳聚糖合成基因是响应霜霉菌侵染的重要基因[27]。Lemaître-Guillier通过葡萄蛋白质组学分析认为,角质层是葡萄抵御霜霉菌侵染的重要屏障[28]。有学者采用转录和代谢组学分析认为,葡萄上表皮中的壳聚糖是抵御葡萄灰霉菌的重要物质[29-30];韩蕊通过对不同抗性葡萄叶片与黑痘菌互作的超微结构观察认为,葡萄对黑痘病的抗性与上表皮厚度有关[31]。林玲认为,毛葡萄叶背绒毛为阻碍霜霉菌的侵染发挥了重要作用[32]。本次通过对人工接菌后的中国野生毛葡萄抗病株系丹凤-2,感病品种‘白玉霓’‘黑比诺’‘法国蓝’侵染过程的观察,认为丹凤-2叶背绒毛是其抵抗霜霉菌侵染的屏障。
葡萄生理生化指标抗性是其抵御真菌侵染的重要途径。苯丙氨酸解氨酶基因PAL表达量和活性的提高能促进木质素及酚类等次生物质的合成,是植物抵抗真菌病害的关键基因[33]。本次实时荧光定量分析发现,中国野生葡萄抗病株系丹凤-2在接种霜霉菌12 h后苯丙氨酸解氨酶基因PAL表达量显著高于易感品种‘黑比诺’与‘白玉霓’;Vannozzi通过基因组学分析认为,芪类物质是葡萄抵御霜霉菌侵染的重要植保素之一[34],Gamm以多个酿酒葡萄为试材,利用实时荧光定量分析技术发现多个抗病品种中的芪合酶基因STS在人工接种霜霉菌后会最先响应霜霉菌的诱导[35],本次实时荧光定量分析发现,丹凤-2接种霜霉菌后芪合酶基因STS表达量显著高于易感品种‘黑比诺’与‘白玉霓’;TLP家族是病程相关蛋白家族之一,在植物中具有广谱的抗真菌活性。通过抑制真菌酶活性,使真菌细胞膜透化,从而起到抵抗真菌侵染的作用[33]。Kortekamp分析多个抗病品种和易感品种中的PR蛋白编码基因和苯丙类代谢相关基因的表达发现,抗病基因在抗病品种和易感品种中的表达有显著差异,其中类甜蛋白基因TLP在抗病品种和易感品种中均有显著表达[36]。本试验RT-PCR分析发现,类甜蛋白基因TLP在抗病株系丹凤-2接种霜霉菌后12 h表达量显著提高;赵惠以3个抗病株系和3个感病株系为试材,利用实时荧光定量分析技术认为,TLP、NPR1在6个不同株系中响应霜霉菌侵染迅速,可能是葡萄调控霜霉病抗性的关键基因[11],这与本次实时荧光定量分析结果不同,其原因可能与试材有关。
综上,中国野生葡萄、欧洲葡萄、欧美杂种葡萄对霜霉病表现出抗病性差异,其中中国野生葡萄商南-1、湖南-1、商南-2、南郑-1、白水-40、渭南-3、安林-2、安林-3以及美洲品种‘瑞比尔’‘高妻’与砧木材料‘SO4’对霜霉病有较高的抗性,具有强的抗霜霉菌入侵以及抗病相关基因的上调表达能力。因此,中国野生葡萄抗霜霉病株系商南-1、湖南-1、商南-2、南郑-1、白水-40、渭南-3、安林-2与安林-3是今后抗病育种可以利用的亲本材料与抗病种质。

