自身免疫性胰腺炎19例临床特征分析并文献回顾
王苗苗,王亚丹,李 莉,吴 静,魏 南,王沧海,郭春梅,宿 慧,刘 红
王苗苗,王亚丹,李莉,魏南,王沧海,郭春梅,宿慧,刘红,首都医科大学附属北京世纪坛医院消化内科 北京市 100038
吴静,首都医科大学附属北京友谊医院消化内科 北京市 100050
0 引言
自身免疫性胰腺炎(autoimmune pancreatitis,AIP)是由免疫介导的,以影像学胰腺肿大、组织学淋巴浆细胞浸润伴席纹状纤维化为特征性表现的疾病,分为两型,亚洲患者多为1型AIP,其作为第一个发现、也是最常见的IgG4相关性疾病(IgG4-related disease,IgG4-RD),以梗阻性黄疸、胰腺肿大、胰管不规则狭窄、淋巴浆细胞浸润并纤维化、伴或不伴胰腺外器官受累为特征,对激素治疗敏感的一种特殊类型的慢性胰腺炎.胰腺外组织器官受累常见于胆管、淋巴结、涎腺、甲状腺等.有时仅表现为单一器官的受累,有时可同时或先后出现两个或多个器官的受累表现.本文分析首都医科大学附属北京世纪坛医院收治的AIP病人资料并总结诊治经验,以期进一步提高对AIP的诊治水平.
1 材料和方法
1.1 材料
1.1.1 研究对象:2011-01/2020-05在首都医科大学附属北京世纪坛医院就诊的19例AIP患者的临床资料,对其进行回顾性分析.对于因AIP反复发作在我院多次住院治疗的患者,本研究仅纳入首次就诊资料进行分析.所有AIP患者均符合2010年国际胰腺学会发布的国际诊断标准(international consensus diagnostic criteria,ICDC)[1],并按照ICDC标准进行分型诊断,19例均为1型AIP患者.
1.1.2 诊断标准:2010年国际胰腺学会发布ICDC标准,从6个方面进行描述,分别是:胰腺实质影像学(parenchymal imaging,P)、胰管影像学(ductal imaging,D)、血清学(serology,S)、胰外器官受累(other organ involvement,OOI)、组织学(histology of the pancreas,H)以及对激素治疗的反应(response to steroid,R).ICDC标准将AIP分为两型:1型AIP为淋巴浆细胞硬化性胰腺炎(lymphoplasmacytic sclerosing pancreatitis,LPSP),2型AIP为特发性导管中心性胰腺炎(idiopathic duct-centric chronic pancreatitis,IDCP).
1.2 方法收集了2011-01/2020-05期间在首都医科大学附属北京世纪坛医院确诊为AIP的患者,共19例,对其进行回顾性分析.
统计学处理应用Excel 2016整理临床资料,并建立数据库,应用SPSS 24.0统计软件包进行统计学分析.
2 结果
2.1 一般情况 共纳入符合条件的19例AIP患者,均符合1型AIP诊断.患者中男女比例为16:3,平均年龄为(71.0±10.7)岁,其中17例AIP患者年龄均在60岁以上.
2.2 临床特点 (1)临床表现:11/19 (57.89%)例以梗阻性黄疸起病,其余常见症状依次为:体重下降、纳差乏力、腹胀、血糖控制欠佳等,其中6例以新诊断糖尿病为首发表现、6例以血糖控制欠佳就诊于内分泌科.1例以多关节肿痛就诊于风湿免疫科(表1);(2)合并症:15/19例患者合并硬化性胆管炎,9/19例伴全身多处淋巴结肿大(累及部位:腮腺、颌下腺、颈部、纵膈、肝门、腹膜后、直肠周围);2/19例合并胃底静脉曲张;2/19例类风湿关节炎;1/19例合并自身免疫性甲状腺炎(表1).

表1 自身免疫性胰腺炎患者临床特点
2.3 血清学的变化 (1)共17例检测了血清IgG4,其中16例IgG4升高,平均水平为7.80±11.57g/L (3.03-46.3g/L);15/19例球蛋白升高;7/19例IgG升高;9/19例CRP、ESR升高;GGT、ALT、AST、ALP、胆红素系列、淀粉酶升高常见,可伴有ANA、RF阳性(表2);(2)CA199:11/19例(57.89%)患者CA199升高,平均值为708.43 U/mL (59.69-4906.06 U/mL).激素治疗后CA199均降至正常范围内(<37 U/mL).患者治疗后CAl99下降明显,有统计学意义(P<0.05)(表3).
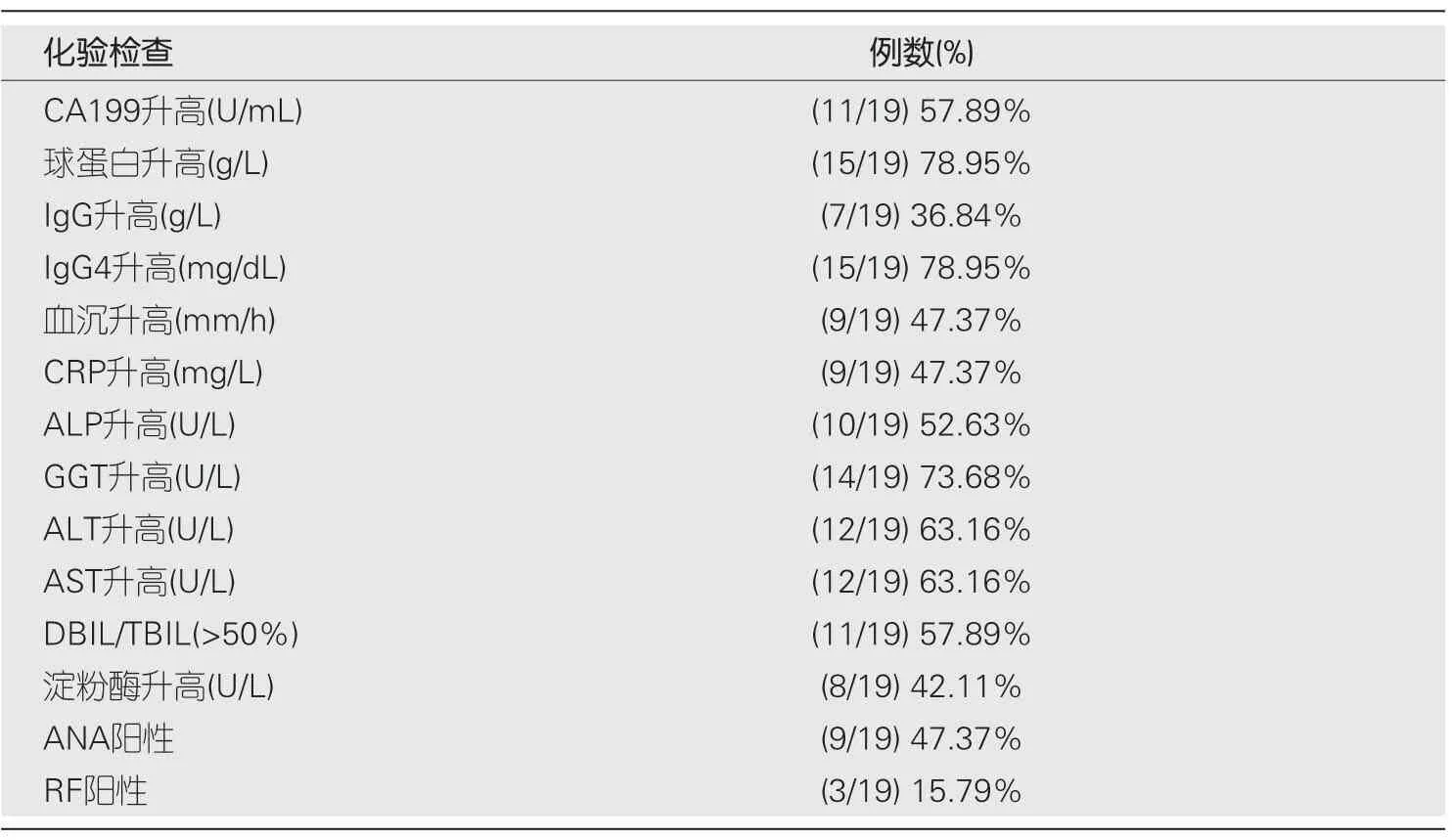
表2 自身免疫性胰腺炎患者血清学指标分析

表3 CAl99治疗前后的变化(P=0.03)
2.4 影像学特点 (1)腹部超声表现:9例行腹部超声,6例提示胰腺弥漫性或局灶性肿大,伴有回声减低;2例提示胰管扩张;5例提示胆管扩张;(2)CT/MRI:18例有完善的CT/MRI资料,其中胰腺的典型表现包括胰腺弥漫肿大8例(42.11%)(图1),胰腺局部肿大4例(21.05%),胰腺体积缩小1例(5.26%),胰管扩张3例(15.79%),胰腺周围包鞘影1例(5.26%).其他表现包括胆总管狭窄伴肝内外胆管不同程度扩张12例(63.15%);(3)EUS:7例行EUS检查,5例(71.43%)表现为胰腺弥漫性回声减低,呈网格样改变,周围可见低/无回声带,其中1例伴有胆总管管壁增厚,1例显示胰尾部胰管扩张,1例未见异常;(4)PET/CT:3例行PET/CT检查.其中1例提示胰腺高代谢肿块,倾向炎症.2例代谢未见异常.

图1 腹部超声表现.A:为治疗前腹部CT可见一线弥漫性肿胀;B:为同一患者治疗后复查CT提示胰腺大小恢复正常;C:为同一患者治疗前电子超声内镜影像,可见胰腺弥漫性肿胀,周围可见包膜;D:为同一患者病病理图片,IgG4染色呈阳性.
2.5 病理学表现 共4/19例有病理学证据.3例为内镜下十二指肠乳头活检组织病理,提示淋巴细胞及浆细胞浸润,IgG4(+)浆细胞>40个/HPF,1例为胰十二指肠切除术后病理,胰腺符合淋巴浆细胞硬化性胰腺炎,IgG4(+)浆细胞>50个/HPF,胆总管内见大量淋巴细胞、浆细胞浸润并纤维组织增生,血管壁可见淋巴细胞浸润,符合硬化性胆管炎.
2.6 治疗 16/19 (84.21%)例患者接受糖皮质激素治疗,其中6例联合免疫抑制剂治疗(包括雷公藤、环磷酰胺),3例联合熊去氧胆酸;2例仅表现血糖控制不佳未经激素治疗;1例误诊为胰腺癌行外科手术(胰十二指肠切除术).
2.7 预后 14/16例经糖皮质激素治疗后临床症状及影像学表现明显改善,CA199均降至正常范围内(<37 U/mL),1/16例复发,加用免疫抑制剂后好转,1/16例不明原因死亡.2例未经激素治疗患者,随访至目前病情无明显变化.1例行外科手术治疗患者因消化道出血死亡.
3 讨论
AIP是由免疫介导的,以影像学胰腺肿大、组织学淋巴浆细胞浸润伴席纹状纤维化为特征性表现的疾病[2],分为两型,1型AIP以IgG4水平升高及病理学IgG4(+)细胞浸润为特点称LPSP,2型则缺乏IgG4(+)细胞浸润,特征是胰管和腺泡上皮内中性粒细胞浸润导致管腔破坏和闭塞,称IDCP.本研究中病例均符合1型AIP诊断标准,故本文就1型AIP讨论.1型AIP可伴有其他组织器官受累,例如胆管、腹膜后、淋巴结、涎腺、甲状腺、肺、肾脏等,统称IgG4-RD,治疗以糖皮质激素及免疫抑制剂为主.AIP在日本报道的总患病率大约在0.46‱,男女比例为3.2:1,平均年龄为(66.3±11.5)岁[3],1型AIP多见于亚洲人群,2型AIP则以美洲及欧洲人群多见,亚洲人群罕见.我国的流行病学资料尚不完善,本研究中AIP患者以老年男性为主的情况与日本报道相符,且均为1型AIP,也与亚洲多为1型AIP相符,但男女病例与报道的差异考虑为纳入样本量较少所致.
AIP的发病机制为多因素参与,目前尚不完全清楚.遗传学及自身免疫机制被认为起主导作用,感染、过敏等因素参与其中.研究发现单倍体基因HLA DRBl*0405-DQBl*04 01[4]、多倍体基因CTLA4+6230和单倍体基因-318C/+49A/CT60G[5]等可能在AIP的发病过程中发挥作用,具体机制尚需进一步阐明.免疫机制包括细胞免疫和体液免疫两方面.细胞免疫中Th1细胞、Th2细胞和Tregs细胞的作用至关重要,其分泌的细胞因子如IL-2、IL-4、IL-5、IL-10等可介导细胞毒性作用,增加嗜酸性粒细胞并提高血清IgE水平,其中IL-10被认为是促进IgG4产生的关键细胞因子[6,7].病理中浆细胞及IgG、IgG4的大量沉积,以及IgG4和C3组成的免疫复合物沉积[8],均说明体液免疫在发病机制中可能发挥作用,目前发现Bregs细胞及补体、球蛋白、细胞因子等参与疾病过程.由于IgG4不能交联抗原形成免疫复合物,从而诱导自身抗体的产生,如乳铁蛋白抗体、抗胰蛋白酶原自身抗体以及抗碳酸酐酶抗体,起到破坏组织的作用.
AIP患者的临床表现多无特异性,起病隐匿,常见症状包括梗阻性黄疸、体重下降、乏力、腹痛、新发糖尿病及血糖控制不佳等,常见体征主要有皮肤巩膜的黄染,浅表淋巴结肿大、上腹部轻压痛等.首诊科室以消化内科为主,其次为内分泌科及排普外科.据报道1型AIP的最常见临床临床表现即为无痛性黄疸,其出现与胆管受累导致的胆总管狭窄相关[9],该症状易被疑诊为壶腹周围肿瘤.
实验室检查及治疗后指标的随访对1型AIP的诊断具有临床意义.本研究中84.21%患者血清IgG4水平显著升高,且均大于2倍正常上限,可作为1型AIP的诊断依据之一,但并非特异性指标,其在胰腺癌中也可出现表达升高,但一般处于低水平升高,通常不超过2倍正常上限[10].本研究中57.89%的患者伴有CA199升高,该标志物常用于胰腺癌的筛查,但不具有特异性,研究表明CA199的升高也可见于胆道良性梗阻[11],故CA199升高用于鉴别肿瘤和AIP并不合理,本研究认为CA199经治疗后如降至正常,则更支持AIP的诊断,但也需要综合其他临床资料.
AIP的典型影像学表现为胰腺呈“腊肠样”弥漫性肿大,边缘锯齿状结构消失,胰周可见薄膜状低密度影,称“胶囊征”.腹部超声可作为初筛检查,但由于肠气影响对胰腺的观察欠佳,故诊断价值较小,AIP的典型超声表现为胰腺局部或弥漫性肿大,且病变部位呈低回声.腹部CT/MRI对AIP的诊断价值较大,以胰腺实质局灶性或弥漫性肿大,边缘锯齿状结构消失,典型者呈“腊肠样”改变,胰周可见薄膜样结构,同时可显示其他脏器受累的情况,例如胆管壁增厚,胆管狭窄且多为远端胆总管狭窄,呈“鼠尾征”,以及腹膜后淋巴结肿大等[12].EUS对AIP具较大诊断价值,但属有创性操作,故应用具有局限性,AIP典型的EUS征象为胰腺局限或弥漫性肿大,伴回声减低,其内可见网格样高回声,胰腺周边呈低回声改变,如能行EUS-FNA,取得病理诊断依据则更具价值,但值得一提的是EUS-FNA也有误诊可能,还需结合患者病情动态观察.
根据ICDC标准,1型AIP的诊断需综合6个方面,分别是胰腺实质影像学、胰管影像学、血清学、胰外器官受累、组织学以及对糖皮质激素治疗的反应.1型AIP与胰腺癌的鉴别在临床中最为棘手,获得组织病理诊断较为困难时需综合其他临床特征,甚至通过随访进行鉴别.糖皮质激素诊断性治疗的适应症为:(1)1型AIP患者;(2)组织穿刺活检结果及肿瘤标志物均为阴性;(3)排除胰腺癌;(4)具有以上2项或2项以上AIP其他证据;糖皮质激素诊断性治疗时间不得长于2 wk.但即使对糖皮质激素治疗有反应也不能完全排除胰腺癌诊断,部分胰腺癌患者经糖皮质激素治疗后临床表现及影像学表现也可改善,故还需临床中密切随访.如应用糖皮质激素2 wk无明显改善,需考虑手术探查获得病理证据,以避免误诊[13].
1型AIP的规范治疗是糖皮质激素治疗[14].治疗的适应症是临床表现为梗阻性黄疸、腹痛以及胰腺外受累的患者.治疗过程可划分为诱导缓解、逐渐减量、维持治疗以及停药四个时期.推荐的起始剂量为口服泼尼松龙0.6 mg/(kg·d),持续2-4 wk诱导缓解.在临床症状、实验室检查,以及影像学改善的前提下,每1-2 wk减量5 mg,并在之后的2-3 mo内逐渐减量至维持剂量(2.5-5 mg/d).激素的维持治疗在预防AIP复发是非常有用的,推荐维持的最小剂量为5 mg/d,本研究中1例复发患者为激素维持治疗期间复发.故维持治疗的剂量以及停药的时间需个体化进行.若出现激素依赖和激素治疗无效、复发以及合并其他自身免疫病等情况,可考虑加用免疫抑制剂,如6-巯基嘌呤、硫唑嘌呤、霉酚酸酯等.合并硬化性胆管炎者或可加用熊去氧胆酸治疗.
对1型AIP的患者需长期随访,包括临床症状、影像学变化,以及应用糖皮质激素及免疫抑制剂的不良反应,血清学水平变化不能用于评价疗效.1型AIP的复发率较高,约为初次治疗患者的20%-50%,复发后建议原初始剂量或高于原初始剂量的糖皮质激素进行治疗,可联用或换用免疫抑制剂及生物制剂[15].有少数1型AIP进展或合并胰腺癌的病例报道,需在随访中警惕疾病变化.
4 结论
本研究的目的旨在总结1型AIP的疾病特点,增强临床医师诊治能力.1型AIP在临床上属罕见病,且临床表现、血清学指标等均不具有特异性,因而诊断较为困难,需结合影像学、糖皮质激素诊断性治疗及随访情况等反复验证,从而达到明确诊断,避免误诊和不必要手术的目的.
文章亮点
实验背景
1型自身免疫性胰腺炎(autoimmune pancreatitis,AIP)属罕见病,其临床表现、血清学指标等均不具有特异性,因而诊断较为困难.总结该病的临床特点及预后情况对今后的诊治起到指导作用.
实验动机
旨在总结AIP的临床特征,提高临床医师对该病的认识.
实验目标
总结AIP的临床特征.
实验方法
回顾性分析2011-01/2020-05在首都医科大学附属北京世纪坛医院就诊的19例AIP患者的临床资料.
实验结果
AIP的诊断需结合影像学、糖皮质激素诊断性治疗及随访情况等反复验证,从而达到明确诊断.
实验结论
AIP的诊断仍较困难,需反复验证,以明确诊断,从而避免误诊和不必要手术.
展望前景
结合患者临床特征、影像学、糖皮质激素诊断性治疗等可避免AIP的误诊和不必要的手术,临床尚期待更具敏感性及特异性的诊断方法.

