腹腔镜辅助胃癌根治术对患者免疫指标及微转移的影响
戴东华,沈美华
江苏省南通市海门区人民医院急诊外科,江苏南通 226100
胃癌患病率占恶性肿瘤的第二位,占消化系统疾病的第一位,早期彻底切除原发病灶、清除淋巴结是提高患者生存质量的重要途径[1-2]。常规开腹胃癌根治术是治疗胃癌的常用技术,具有切除范围准确、操作便捷、疗效可靠等优点[3-4]。但手术切口大,对组织造成的创伤较大,术中出血量多,并会增加术后并发症发生风险,影响患者术后早期康复。腹腔镜手术创伤程度相对较小、术后疼痛轻微,能弥补开腹手术的不足,逐渐被应用于胃癌治疗[5-6]。微转移是非血液系统恶性肿瘤进展中播散在血液系统、淋巴系统和骨髓等各器官组织中的微小隐匿癌灶,其存在是腹膜种植转移形成的先决体条件,与胃癌术后复发密切相关[7-8]。该研究选择2015年2月—2020年12月就诊于该院的104例胃癌患者为研究对象,分析腹腔镜辅助胃癌根治术治疗胃癌患者效果。现报道如下。
1 资料与方法
1.1 一般资料
该研究经医学伦理委员会审核批准。选择就诊于该院的104例胃癌患者为研究对象,按随机数表法分为腹腔镜组(52例)和常规组(52例)。腹腔镜组:女20例,男32例;年龄41~79岁,平均年龄(57.65±2.14)岁;组织学类型:鳞癌30例,腺癌22例;TNM分期:ⅠB期2例,Ⅱ期10例,ⅢA期18例,ⅢB期22例。对照组:女18例,男34例;年龄40~77岁,平均年龄(57.24±2.10)岁;组织学类型:鳞癌33例,腺癌19例;TNM分期:ⅠB期3例,Ⅱ期8例,ⅢA期16例,ⅢB期25例。两组性别、年龄、组织学类型相比,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
(1)纳入标准:①年龄18~80岁;②患者心肺功能良好;③临床资料完整者;④经CT等影像学检查确诊为胃癌;⑤首次接受胃癌根治术治疗且手术耐受性良好;⑥家属签署知情同意书;⑦TNM分期为ⅠB~ⅢB期。
(2)排除标准:①联合脏器切除术者;②既往接受过免疫或放化疗治疗者;③合并其他恶性肿瘤者;④存在腹腔镜手术禁忌证者,如凝血功能障碍、腹壁疝、门静脉高压症、横隔膜疝等;⑤既往有上腹部手术史者;⑥因穿孔、出血等行急诊手术者;⑦存在自身免疫性疾病者;⑧肝肾功能严重受损者。
1.3 方法
腹腔镜组行腹腔镜辅助下根治术治疗:气管插管全麻后取平卧位,双腿呈“大”字分开,持镜者位于患者双腿之间,术者位于患者左侧,助手位于右侧,术中可按需交换位置。脐下缘1~2 cm处刺入气腹针,创建气腹压,维持气腹压为12 mmHg左右,并置入腹腔,观察盆壁、肝脏、腹肠系膜等有无转移灶。于左侧腋前线肋缘下穿刺,置入12 mm套管针,将其作为主操作孔,在脐左侧5 cm偏上处穿刺,置入5 mm套管针,作为辅操作孔,分别于右锁骨中线平脐偏上处、右侧腋前线肋缘下2 cm处穿刺,置入5 mm套管针,作为观察孔。对横结肠系膜前叶、胰腺被膜、大网膜自横结肠中部右侧向脾曲游离,胃脾韧带充分显露后,离断胃短血管,同法处理胃左动静脉。彻底清扫第7、8、9组淋巴结,紧贴脾门用超声刀对贲门左侧组织清扫,随后清扫第2、10组淋巴结,紧贴肝脏下方,将小网膜清扫至贲门右侧组织,对第1组淋巴结清扫。切断前后食管被膜,食管裸化约6 cm。在上腹正中做一切口,长度为5~7 cm,保护切口。将胃拖出腹腔,用荷包钳在贲门上3 cm处切断食管,置入抵钉座,在预切平面将肿瘤切除,2经残胃前壁戳孔置入5 mm圆型吻合器,经胃后壁穿出,行食管-胃吻合,关闭切口。常规组在气管插管全麻下行开腹胃癌根治术治疗:取位同腹腔镜组,做一长约20 cm切口于腹部正中剑突处,逐层进腹,并置入切口保护圈,术野充分显露后,仔细观察肿瘤位置、大小等,将肿瘤病灶切除,对相关淋巴结清扫,清扫顺序同A组。食管-胃吻合,无出血点后放置引流管,关闭切口。
1.4 观察指标
①比较两组手术指标。如手术时间、切口长度、术中出血量、清扫淋巴结数、术后肠功能恢复时间、首次下床活动时间、住院时间等。②免疫指标。分别采集两组患者术前、术后5 d时5 mL空腹肘静脉血,置于4℃离心机内离心操作5 min,转速为1 500 r/min,离心半径为13.5 cm,获取上清液。使用流式细胞仪测定CD4+、CD8+,并计算CD4+/CD8+比值。③微转移指标。气腹建立后收集腹腔冲洗液,即避开病灶,将37℃的250 mL 0.9%氯化钠注射液注入腹腔,浸泡3 min后抽取100 mL腹腔冲洗液,关腹前用上述方式收集腹腔冲洗液,离心取上清液,测定多巴胺脱羧酶(DDC)、癌胚抗原(CEA),用双抗体夹心ELISA法测定。④对比两组术后并发症(吻合口漏、吻合口出血、粘连性肠梗阻、切口感染等)发生情况。
1.5 统计方法
采用SPSS 21.0统计学软件进行数据分析,计量资料以(±s)表示,组间差异比较采用t检验;计数资料以[n(%)]表示,组间差异比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术指标比较
腹腔镜组切口长度短于常规组,术中出血量少于常规组,手术时间长于常规组,术后肠功能恢复时间、住院时间和首次下床活动时间较常规组短,差异有统计学意义(P<0.05),两组清扫淋巴结数比较,差异无统计学意义(P>0.05)。见表1。
表1 两组患者手术指标比较(±s)Table 1 Comparison of surgical indicators between the two groups(±s)
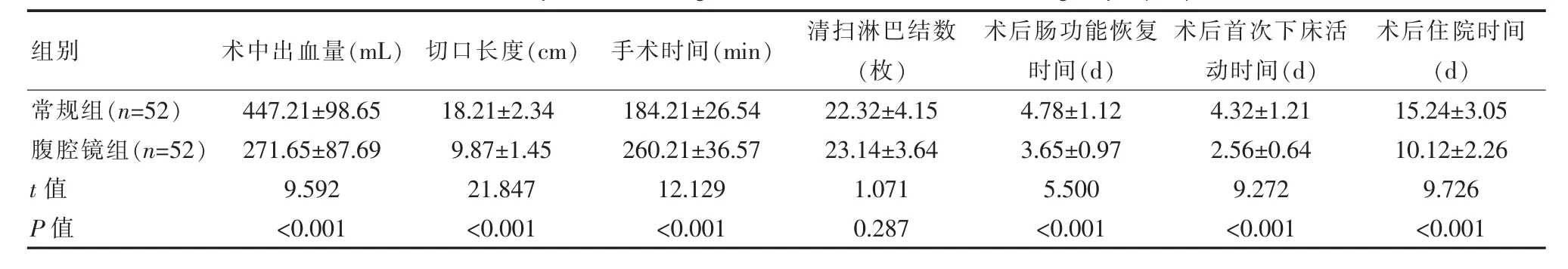
表1 两组患者手术指标比较(±s)Table 1 Comparison of surgical indicators between the two groups(±s)
组别术中出血量(mL)切口长度(cm)手术时间(min)清扫淋巴结数(枚)术后肠功能恢复时间(d)术后首次下床活动时间(d)术后住院时间(d)常规组(n=52)腹腔镜组(n=52)t值P值447.21±98.65 271.65±87.69 9.592<0.001 18.21±2.34 9.87±1.45 21.847<0.001 184.21±26.54 260.21±36.57 12.129<0.001 22.32±4.15 23.14±3.64 1.071 0.287 4.78±1.12 3.65±0.97 5.500<0.001 4.32±1.21 2.56±0.64 9.272<0.001 15.24±3.05 10.12±2.26 9.726<0.001
2.2 两组患者免疫指标比较
两组术前免疫指标比较,差异无统计学意义(P>0.05),腹腔镜组术后CD4+/CD8+、CD4+较常规组高,CD8+较常规组低,差异有统计学意义(P<0.05)。见表2。
表2 两组患者免疫指标比较(±s)Table 2 Comparison of immune indicators between the two groups(±s)
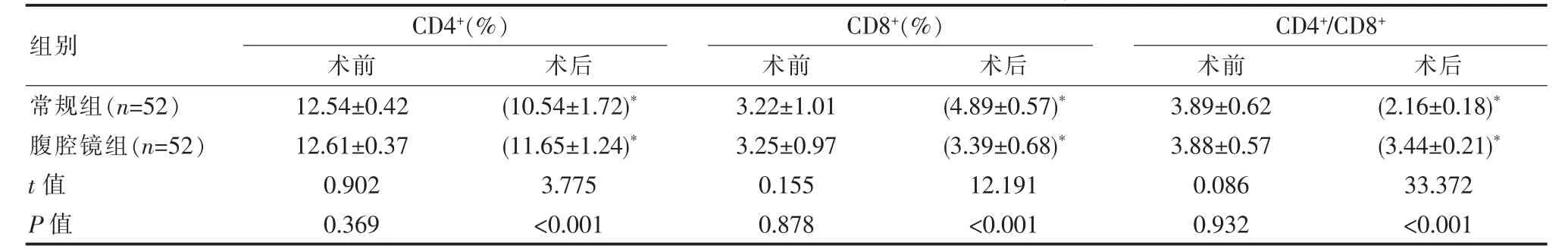
表2 两组患者免疫指标比较(±s)Table 2 Comparison of immune indicators between the two groups(±s)
注:与同组治疗前相比,*P<0.05
组别CD4+(%)术前 术后CD8+(%)术前 术后CD4+/CD8+术前 术后常规组(n=52)腹腔镜组(n=52)t值P值12.54±0.42 12.61±0.37 0.902 0.369(10.54±1.72)*(11.65±1.24)*3.775<0.001 3.22±1.01 3.25±0.97 0.155 0.878(4.89±0.57)*(3.39±0.68)*12.191<0.001 3.89±0.62 3.88±0.57 0.086 0.932(2.16±0.18)*(3.44±0.21)*33.372<0.001
2.3 两组患者微转移指标比较
两组术前微转移指标比较,差异无统计学意义(P>0.05),术后,腹腔镜组CEA、DDC水平较常规组低,差异有统计学意义(P<0.05)。见表3。
表3 两组患者微转移指标比较[(±s),ng/mL]Table 3 Comparison of micrometastasis indicators between the two groups[(±s),ng/mL]
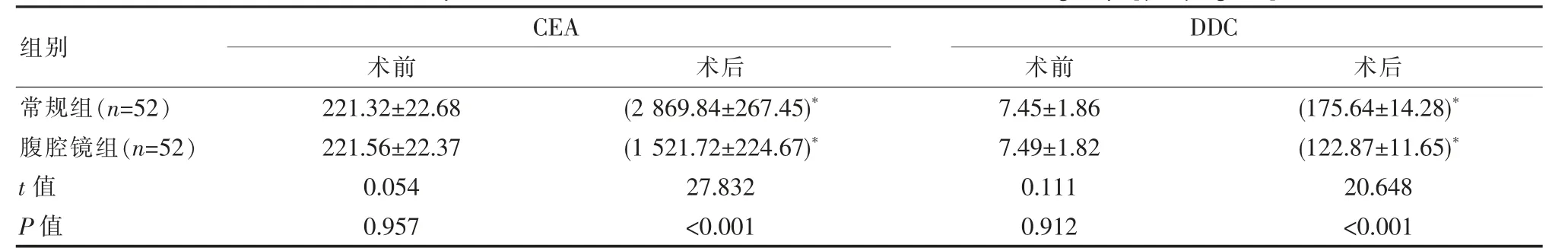
表3 两组患者微转移指标比较[(±s),ng/mL]Table 3 Comparison of micrometastasis indicators between the two groups[(±s),ng/mL]
注:与同组治疗前相比,*P<0.05
组别CEA术前 术后DDC术前 术后常规组(n=52)腹腔镜组(n=52)t值P值221.32±22.68 221.56±22.37 0.054 0.957(2 869.84±267.45)*(1 521.72±224.67)*27.832<0.001 7.45±1.86 7.49±1.82 0.111 0.912(175.64±14.28)*(122.87±11.65)*20.648<0.001
2.4 两组患者并发症比较
腹腔镜组并发症较常规组低,差异有统计学意义(P<0.05)。见表4。
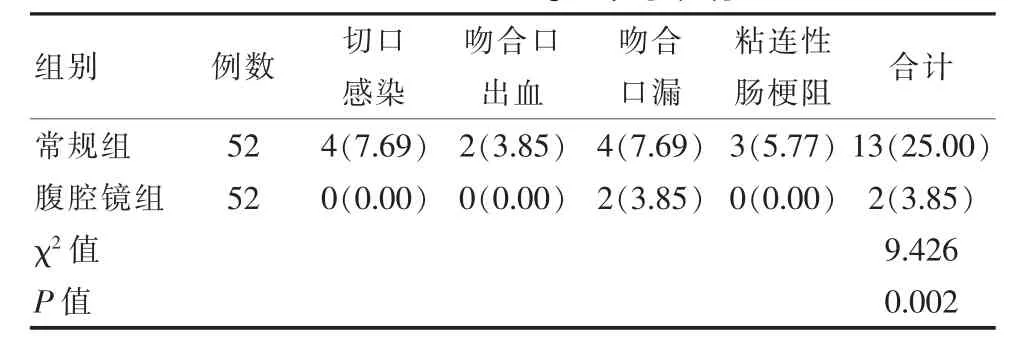
表4 两组患者并发症发生情况比较[n(%)]Table 4 Comparison of the occurrence of complications between the two groups[n(%)]
3 讨论
胃癌多发于中老年男性,其发病与吸烟、遗传、幽门螺旋杆菌感染、饮酒、等因素密切相关,多发于中老年男性,可诱发腹痛、黑便、食欲减退等不良症状,病情严重时可造成患者死亡[9-11]。开腹胃癌根治术能直接观察胃组织病变与病灶大小情况,可在直视下切除病灶、清扫淋巴结,是治疗胃癌的常用术式[12-13]。但该手术对机体造成的损伤较大,存在失血量多、术后疼痛重、并发症多等不足,延长患者术后恢复进程,影响手术治疗效果[14]。随着腹腔镜手术技巧的提高,其探索和应用范围不断扩大,在胃癌患者中也取得了满意效果。
该研究中,腹腔镜组手术时间为(260.21±36.57)min,长于常规组,提示腹腔镜手术用时较长。因胃部血管结构复杂、消化道重建困难、淋巴结清扫区域广等因素影响,腹腔镜手术操作难度相对较大,手术时间相对长于开腹手术[15-16]。该研究中,两组清扫淋巴结数相当,腹腔镜组切口长度为(9.87±1.45)cm、术中出血量为(271.65±87.69)mL,低于常规组,术后肠功能恢复时间为(3.65±0.97)d、住院时间为(10.12±2.26)d、首次下床活动时间为(2.56±0.64)d,短于常规组;腹腔镜组术后CD4+/CD8+、CD4+高于常规组,并发症发生率、CD8+低于常规组(P<0.05),提示腹腔镜手术可减小手术创伤,对免疫功能影响小,减少并发症发生,术后恢复快。腹腔镜具有视觉放大效应,为术者提供清晰的视野,便于辨认解剖结构,更加精细的实施血管离断、淋巴结清扫等操作,并能及时止血,可减少不必要的副损伤、出血,促进术后胃肠功能早期恢复,减少术后并发症,利于患者术后早期康复[17-19]。
胃癌术后转移涉及肿瘤细胞迁移、新生血管形成、肿瘤细胞的黏附改变、细胞外基质降解增加、细胞增殖改变等多方面[20]。胃癌患者术后多存在淋巴结微转移,腹腔内残存的微小病灶或游离的癌细胞可种植于腹膜上,可加速癌细胞扩散,使患者病情迅速恶化,是导致患者术后复发和腹膜种植的主要因素,影响预后[21-22]。CEA是检测游离癌细胞和胃癌复发的重要标志物,其水平高低可反映胃癌微转移情况。DDC与血管生成和细胞增殖、凋亡关系密切,预测胃癌腹膜转移具有较高的敏感性和特异性。王晓明等[23]分别对胃癌患者行腹腔镜辅助胃癌根治术(观察组)和常规开腹胃癌根治术(对照组)治疗,结果显示,两组手术结束时腹腔冲洗液中DDC、CEA均低高于手术开始 时,且 观 察 组DDC为 (115.2±42.1)ng/L、CEA为(1 418.9±572.2)ng/L,低于对照组,提示腹腔镜辅助胃癌根治术能够降低术后微转移风险。该研究中,腹腔镜组术后DDC为(122.87±11.65)ng/mL、CEA为(1 521.72±224.67)ng/mL,低于常规组,与上述研究结果相似。这可能与腹腔镜手术可依靠气腹获取视野,且无需长期牵拉肿瘤组织以暴露术野,切除肿瘤前对肿瘤几乎“零挤压”,对肿瘤组织的刺激相对较小,同时术中使用超声刀、电凝钩等凝血设备,可更好的凝结血管和淋巴管的断端,尽可能减少肿瘤细胞从血管或淋巴管脱落有关。
综上所述,腹腔镜手术治疗胃癌具有创伤小、并发症少、免疫功能影响小、恢复快、术后微转移发生风险小等优点且治疗效果与开腹手术相当,具有推广价值。

