进展期胃癌新辅助治疗病理完全缓解的研究进展
吴留成 陈建思 覃宇周 黄名威 金钦文
胃癌是严重威胁我国居民健康的恶性肿瘤,发病率和死亡率分别位居我国恶性肿瘤第2位和第3位[1]。因早期症状不明显,大多数胃癌患者在诊断时往往已经进入进展期。目前胃癌的治疗虽然主要依赖于手术,但是单纯手术难以达到根治目的,因此以手术治疗为主,包括化疗、放疗、靶向治疗和免疫治疗的多学科综合治疗模式成为标准治疗方案。其中,作为综合治疗组成部分的新辅助治疗,已被中国临床肿瘤学会(CSCO)、美国国立综合癌症网络(NCCN)以及欧洲肿瘤内科学会(ESMO)胃癌诊疗指南推荐作为局部晚期胃癌综合治疗的重要一环。新辅助治疗不仅有助于了解肿瘤对放化疗等治疗的敏感程度,为进一步治疗提供依据;还能使肿瘤缩小,降低分期,给更多患者提供手术治疗机会,同时也有利于防止耐药细胞株形成,减少术后复发和转移。有研究报道新辅助治疗可使大约50%的肿瘤发生不同程度的消退,少部分患者在新辅助治疗后甚至可达到病理完全缓解(pathologic complete response,pCR),从而获得较好的预后[2⁃3]。随着新辅助治疗方案不断优化,可以预期,胃癌新辅助治疗后的pCR率将进一步提高,而如何合理诊治pCR患者,成为亟待解决的一个问题。本文基于目前的临床数据对进展期胃癌新辅助治疗后获pCR的定义及其预后,以及后续的治疗等进行综述,以期为该类患者的临床诊疗提供建议。
1 进展期胃癌新辅助治疗pCR的现状
1.1 pCR的定义及判断标准
pCR主要取决于根治术之后的病理结果,是指在接受新辅助治疗后的胃癌根治术切除标本中,在原发肿瘤区域广泛取材,且镜下未见肿瘤细胞残留。pCR的病理学特征比较明确,即在显微镜下表现为肿瘤细胞毒坏死并被炎性肉芽组织或纤维组织取代或大面积无细胞黏液湖。但是对于pCR的判断标准,目前国内外报道并不一致,其中有部分研究认为病灶中残留的非浸润型肿瘤组织不影响其判断为pCR,部分研究认为原发灶完全缓解即可判断为 pCR[3⁃6],也有研究认为原发灶和转移淋巴结均完全缓解才能判断为pCR[7⁃8]。值得注意的是,选取的 pCR判断标准不同,其对预后的指导意义也不同,甚至影响评估患者的远期疗效,例如当pCR定义为原发灶完全缓解时,此时的淋巴结状态是影响生存的重要因素[9]。一项有关乳腺癌新辅助化疗后pCR的研究发现,病灶中残留的非浸润型肿瘤组织(ypTis)与不良预后密切相关[10],但是该结论在胃癌新辅助治疗后是否同样适用有待进一步证实。由此也可以看出,统一新辅助治疗后的pCR标准具有重要意义。
1.2 不同新辅助治疗模式下的pCR率
既往有关进展期胃癌新辅助治疗的研究显示,不同人群、不同治疗模式、不同治疗方案的pCR率(3%~29%)并不相同[11⁃12]。例如,NeoFLOT研究中进展期胃癌应用新辅助化疗方案FLOT(氟尿嘧啶+亚叶酸钙+奥沙利铂+多西他赛)的pCR率为20%[13],AIO研究采用DCX方案(多西紫杉醇+顺铂+卡培他滨)进行新辅助化疗的pCR率为13.7%[14],FLOT4⁃AIO研究中FLOT4与ECF/ECX方案(表柔比星+顺铂+氟尿嘧啶/卡培他滨)的pCR分别为16%和6%[15],上述研究中的pCR率与小样本非随机研究报道的pCR率基本一致[16],本中心在临床上使用SOX方案(奥沙利铂+替吉奥)进行胃癌新辅助化疗时也获得12.3%的pCR率。由此可见,进展期胃癌应用以紫杉醇类为基础,联合铂类、氟尿嘧啶类的三药联合方案进行新辅助化疗时可以获得较高的pCR率。也有研究在新辅助化疗的基础上加入放疗,以更好地控制局部病灶,增加局部治疗强度,提高进展期胃癌的pCR率。如德国的POET研究在术前PLF方案(顺铂+5-氟尿嘧啶/醛氢叶酸)化疗基础上给予同步放疗,使pCR率从1.9%提高到 14.3%[17]。MD Anderson的单中心Ⅱ期研究RTOG 9904显示,术前PF方案(顺铂+氟尿嘧啶)联合放疗的pCR率可达26%[18]。正在进行的TOPGEAR研究在MAGIC研究的ECF方案基础上加术前新辅助放疗,但是有关pCR率的研究结果尚未公布,结果值得期待。
联合靶向和化疗药物的新辅助治疗方案也被用于进展期胃癌的治疗,德国的HER⁃FLOT研究选取HER2阳性的cT2⁃4和/或N+,M0期进展期胃食管结合部癌,给予曲妥珠单抗联合FLOT新辅助方案化疗4周期,该方案的pCR率达21.4%[19]。但是,NEOHX的Ⅱ期研究中曲妥珠单抗联合XELOX的新辅助治疗方案,在可切除胃癌或胃食管结合部癌中的pCR率仅为9.6%[20]。以上研究提示,曲妥珠单抗能否提高胃癌新辅助化疗的pCR率仍需大型Ⅲ期研究证实。此外,免疫检查点抑制剂如PD⁃1/PD⁃L1在胃癌治疗中也取得了进展,在晚期胃癌三线治疗的地位得以认可,在二线的治疗模式正在探索中[21]。虽然目前仍缺乏免疫检查点抑制剂联合化疗在进展期胃癌新辅助治疗中的研究结果,但是其可能获得的pCR率同样值得期待。
由此可见,对于进展期胃癌,不同新辅助治疗模式可以获得不同的pCR率,其中铂类、氟尿嘧啶类联合紫杉醇类较不联合紫杉醇类更容易获得pCR,放疗的联合应用可以进一步提高pCR率。但值得注意的是,pCR率不能成为选择新辅助治疗方案的唯一依据,应综合考虑肿瘤部位、患者自身情况等,比如目前在临床实践中,胃食管结合部癌由于位置固定,容易勾画靶区,因此更多接受了新辅助放化疗方案。
2 进展期胃癌新辅助治疗后获pCR患者的预后
2.1 pCR患者的复发转移模式
经新辅助治疗能够获得pCR的进展期胃癌一般属于对治疗敏感的患者,理论上远期生存往往较好,不少研究[18,21⁃22]也证实该类人群的预后较好。但是,获pCR并不等同于治愈,在进展期胃癌中,不少研究已报道在新辅助治疗后获pCR患者的复发和转移问题不容忽视。在CHO等[23]报道的一项系统综述中,22例进展期胃癌新辅助治疗后获pCR的患者5年死亡率和复发率分别为15%和25%,复发病例中33%(1/3)为肝转移、33%(1/3)为脑转移。FIELDS 等[24]研究也发现获pCR患者5年复发率为27%,复发病例中36%(5/14)为脑转移。彭良群等[8]随访21例pCR患者时发现,5例复发病例中肝转移占40%(2/5)、脑转移占20%(1/5)。STARK等[5]在报道的10例ypT0N+患者中,5年复发率达到80%(8/10),复发病例中肝转移占37.5%(3/8)、脑转移占25%(2/8)。结合上述研究发现,新辅助治疗后获pCR的患者依然会发生复发转移,其中以肝、脑远处转移为主,但是少有腹腔种植转移,可能原因是血脑屏障阻止化疗药物进入脑组织,从而致使该部位易发生转移。同时提示pCR患者随访时应重点关注肝、脑转移的症状体征及相关检查,非pCR患者则更可能在腹腔等各部位发生复发转移。
关于影响pCR患者预后因素的研究,目前仅有彭良群等[8]报道年龄≤50岁及术后并发症是影响胃癌新辅助治疗后pCR患者预后的独立因素,可能机制一方面是由于青年人群的胃癌生物学行为恶性度较高以及术后并发症的炎性反应容易导致对肿瘤细胞免疫力下降;另一方面是辅助化疗的依从性。但是目前有关pCR患者是否需要进一步接受辅助化疗的研究较少,其中WANG等[25]根据是否行辅助化疗将39例pCR患者分成两组(辅助化疗组20例,无辅助化疗组19例),结果发现是否行辅助化疗并不是影响患者生存的因素,这一研究结果也提示pCR患者可能无需接受辅助化疗,但是该研究病例数偏少,仍需基于人群的大样本研究进一步证实。在临床实践中,经新辅助化疗后获pCR患者的辅助化疗依从性普遍较差,这可能也是目前缺少pCR人群辅助化疗能否获益有关证据的原因。
总体来说,pCR患者的预后情况较好,但是影响其预后的因素尚不明确。此外,部分pCR患者仍会出现复发转移,特别是肝、脑转移,因此如何将此类“未治愈”人群从pCR患者中甄别出来值得进一步研究,而对胃癌分子生物学及转移机制的深入理解和液体活检技术的发展可能是未来的突破口。
2.2 不同新辅助治疗模式pCR患者的预后
在进展期胃癌患者的新辅助治疗模式中,新辅助化疗和新辅助放化疗是最常用的模式,虽然经新辅助治疗获得pCR的进展期胃癌一般远期生存较好,但是不同新辅助治疗方案获pCR的人群预后差异较大。目前大多数研究(表 1)[2,6⁃7,16⁃17,23⁃27]显示新辅助化疗获pCR患者的预后(5年总生存率约为90%)均显著优于新辅助放化疗患者(5年总生存率约为60%)。TRUMBULL等[26]通过回顾性分析美国国家癌症数据库2004—2013年的胃癌患者数据,纳入413例新辅助治疗(新辅助化疗84例,新辅助放化疗329例)获pCR患者,发现新辅助化疗患者的5年总生存率显著优于新辅助放化疗(94.0vs60.0%,P<0.01)。IKOMA等[22]也报道新辅助治疗获pCR患者的5年总生存率仅为60%,其中78%的患者接受的是新辅助放化疗。同样,KALTENMEIER等[27]研究也显示新辅助治疗获pCR患者的5年总生存率仅为58.0%,其中新辅助放化疗比例为75.6%。此外,相比于以上新辅助放化疗方案,在使用新辅助化疗方案的研究中获pCR的患者显示了更好的预后,如CHO等[23]通过问卷调查共纳入22例新辅助化疗获pCR的胃癌患者,发现其3年、5年无复发生存率和总生存率分别高达91.0%和96.0%,5年无复发生存率和总生存率分别为75.0%和85.0%。一项单中心研究纳入21例新辅助化疗获pCR患者,其3年无复发生存率和总生存率也分别达到90.2%和90.5%[8]。当然,也有部分研究报道,新辅助放化疗组与新辅助化疗组pCR患者的预后差异并不明显[7]。而不同新辅助治疗方案获pCR人群的预后差异,考虑其可能机制主要包括以下几方面:⑴胃癌复发大多以远处转移为主,尤其是腹膜种植,而作为全身治疗的新辅助化疗的优势正是尽早清除微小转移灶,减少远处转移而改善预后[28]。⑵新辅助放化疗获pCR的部分原因是放疗的局部作用,而非全部来自化疗效果,因此新辅助放化疗的病理缓解情况无法同步反映全身肿瘤对治疗的反应。⑶放疗对靶区的毒副作用可能增加手难度及术后并发症[29]。⑷仅通过新辅助化疗即可获pCR的患者,一般对化疗比较敏感且具有较好的生物学行为,尤其是相对于通过新辅助放化疗获pCR患者而言[30]。由此可见,两种新辅助治疗模式下获pCR患者的不同预后具备一定的理论基础,未来可以考虑通过扩大样本量或者系统综述进一步加以证实。
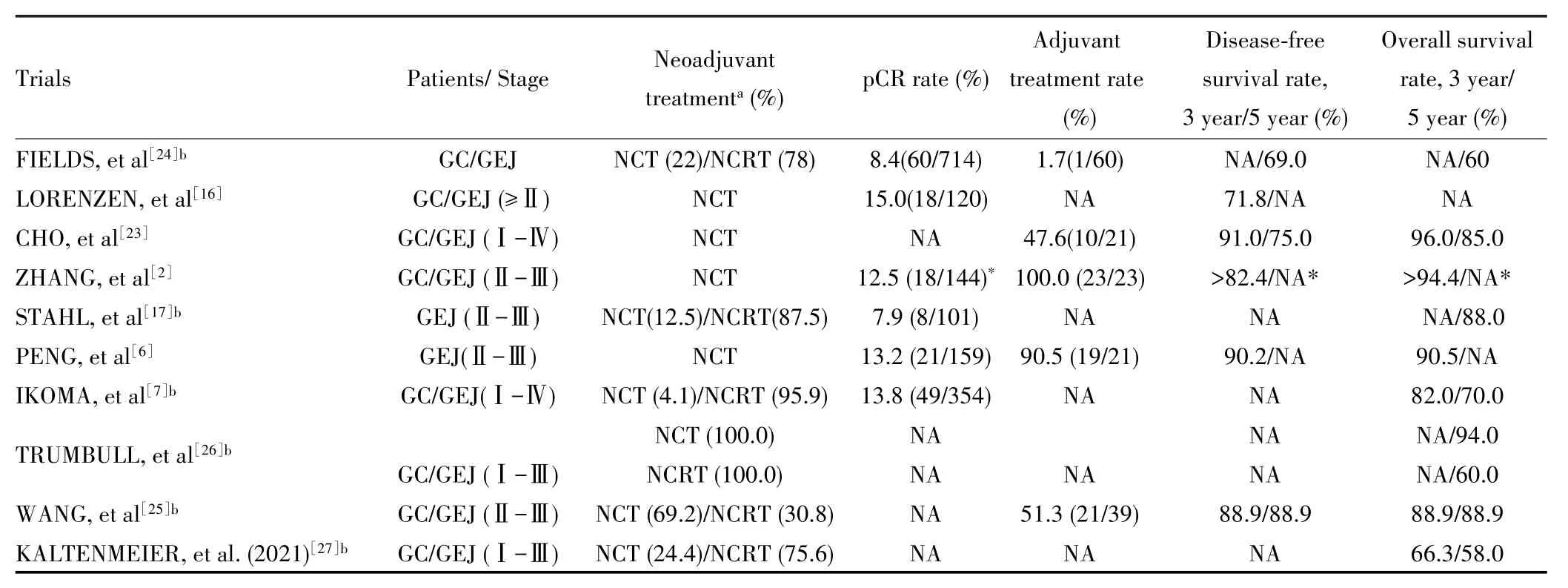
1 不同研究中进展期胃癌新辅助治疗后获pCR患者的生存情况Tab.1 Survival of pCR patients with advanced gastric cancer after neoadjuvant therapy in different studies
2.3 区别对待不同新辅助治疗方案获pCR患者
pCR在胃癌的新辅助治疗评价中具有良好的预后提示意义,因此pCR可以作为胃癌新辅助治疗Ⅱ期临床研究的终点指标之一,而pCR作为预测新辅助治疗效果的终点指标也可以加快新疗法的测试。但是,pCR能否替代无进展生存期和总生存期成为胃癌新辅助治疗Ⅲ期临床研究的终点指标仍颇具争议[31]。部分研究显示pCR是胃癌患者无进展生存期和总生存期的独立预后因子[18,25],在这些研究中大部分患者接受了新辅助化疗。但是也有研究报道pCR率的增加未能转化为生存获益,但是值得注意的是该研究中患者接受的是新辅助放化疗[15]。正如前所述,新辅助化疗及新辅助放化疗获pCR人群的预后并不同,因此这两种方案所获的pCR对预后的指导意义也可能存在差异,这是因为pCR只是肿瘤病灶对治疗的反应,但是有效的治疗也并不一定总能使肿瘤病灶获pCR,而且对于进展期患者,微转移灶对治疗的反应可能对生存影响更大。结合以上研究,认为pCR对胃癌新辅助治疗后的预后指导意义差异可能主要是不同的治疗方式所导致,这就提示在临床中应该区别对待不同新辅助治疗模式下后获pCR的患者,例如pCR可以在Ⅲ期胃癌新辅助化疗研究中替代无进展生存期和总生存期,而其在新辅助放化疗研究中能否替代则需进一步研究。同时为了能够加以区分,建议在涉及胃癌新辅助治疗后pCR时,应该同时说明新辅助治疗方式,或者在pCR/ypTNM分期增加前缀用于区分不同的新辅助治疗后的TNM分期,使临床医师更加准确评估疾病情况[26]。
3 pCR患者术后辅助化疗应用的思考
总体而言,一般获pCR的患者术后辅助化疗的依从性较差,这也反映出医患双方均不同程度认可“pCR=治愈”,而这也导致部分患者放弃了辅助化疗[29]。MOKDAD 等[32]应用倾向评分匹配法评估胃食管结合部癌新辅助放化疗后的辅助化疗对预后的影响,最后术后辅助化疗组732例与术后观察组3 660例匹配成功,结果显示辅助化疗可以显著改善预后(HR=0.79,95%CI:0.72~0.88),该研究在亚组分析时还发现pCR患者可能从术后辅助化疗中获益最大(HR=0.57,95%CI:0.28~1.13)。然而,WANG等[25]回顾性分析单中心病例,纳入39例经新辅助化疗后获得pCR的胃癌患者,其中20例(51.3%)术后接受了辅助化疗,19例(48.7%)未接受辅助化疗,结果发现两组的无病生存期和总生存期差异无统计学意义(均P>0.05),提示胃癌新辅助治疗后pCR患者可能不需要接受辅助化疗。但是该研究纳入病例较少,这对结论的可靠性有一定影响。虽然上述结论均有待大样本研究进一步证实,但是不能忽视的是两项研究结果具有冲突,可能解释为两项研究的新辅助治疗方式的区别,因此笔者推测新辅助化疗后pCR患者可能无法从辅助化疗中获益,而辅助化疗则可能使新辅助放化疗后pCR患者生存获益,上述推测需要针对性的研究予以证实。
4 小结与展望
局部进展期胃癌经新辅助治疗尤其是新辅助放化后,部分患者可获得pCR,临床预后较好。鉴于直肠癌新辅助治疗后“等待观察”策略和全程新辅助治疗策略的实施应用,及更加有效的新辅助治疗方案的应用,局部进展期胃癌特别是胃食管结合部癌能否也考虑放弃根治性手术而采用密切随访观察的策略或全程新辅助治疗策略是值得探索的方向。然而,目前关于进展期胃癌的pCR研究也仍存在以下问题:⑴不同研究的pCR定义不一致,亟需统一定义以避免混淆;⑵影响pCR率的确切因素尚未知晓,如何进一步提高pCR率而使更多患者获益有待进一步探索;⑶目前仍缺乏有效准确的方法筛查可能获得pCR的患者,如何在现有影像学的基础上,通过分子生物学等手段筛选出这部分人群是值得探索的问题;⑷新辅助放化疗较单纯新辅助化疗的价值需要进一步明确。但相信随着研究不断深入,胃癌新辅助治疗后获pCR患者的处理策略将会更加成熟与明确,从而为患者带来更大的生存获益。

