基于生物学行为的晚期胆管癌靶向免疫治疗进展
王云超 杨旭 杨晓波 赵海涛
胆管细胞癌(cholangiocarcinoma,CCA,简称胆管癌)是一种起源于胆管上皮细胞且具有高度异质性的胆道恶性肿瘤,可发生于胆道树的任何位置,根据解剖位置可分为肝内胆管细胞癌(intrahepatic cholan⁃giocarcinoma,iCCA)、肝门部胆管细胞癌(perihilar cholangiocarcinoma,pCCA或Klatskin瘤)以及远端胆管细胞癌(distal cholangiocarcinoma,dCCA),发生率分别为10%~20%、50%~60%和20%~30%[1⁃3]。其中pCCA和dCCA统称为肝外胆管细胞癌(extrahepatic cholan⁃giocarcinoma,eCCA)。CCA是仅次于肝细胞癌的第二种最常见的原发性肝脏恶性肿瘤,其发病率约占所有原发性肝脏肿瘤的15%[4⁃5]。CCA的发病年龄为70岁左右,男女均可发病,但以男性为主[4]。在全球范围内,CCA的发病率和死亡率显示出显著的地域差异,其中与西方国家相比,亚洲地区的CCA发病率较高,且同一国家不同地区之间也存在显著差异[4,6]。CCA发病率的差异也反映了不同危险因素对CCA发病的影响,侧面反映了CCA不同的生物学行为。
目前手术治疗仍是早期CCA的首选治疗方式,但是CCA早期症状隐匿,50%~60%的患者发现时已为晚期,因此失去了手术治疗机会。而晚期CCA患者的中位生存时间仅为3.9个月[4]。晚期CCA的标准一线治疗方案是吉西他滨联合顺铂(GC),但中位生存时间也仅有11.7个月[7]。而且一线化疗失败后,绝大多数二线及之后的治疗方案效果有限。近年来,随着测序技术的普及,靶向治疗和免疫治疗成为CCA治疗研究的热点,本文将结合CCA的分子生物学特点,对靶向和免疫治疗在CCA中的应用进展进行综述。
1 胆管癌的生物学特征
胆道系统起源于不同的胚胎细胞,加上诱发因素不同,CCA不同亚型间存在高度瘤内和瘤间异质性,这也预示着CCA具有不同的生物学特性[8⁃10]。iCCA表现为3种生长模式:肿块型、导管周围浸润型和导管内型[11]。pCCA和dCCA则主要表现为扁平或边界不清的结节性硬化性肿瘤,表现为导管内乳头状肿瘤的较少见[12]。iCCA又可以分为小胆管型和大胆管型[13],小胆管iCCA伴有异柠檬酸脱氢酶2(isocitrate dehydrogenase 2,IDH2)表征突变或成纤维细胞生长因子受体2(fibroblast growth factor receptor 2,FGFR2)融合,而大胆管iCCA以及pCCA、dCCA常伴有高频KRAS和/或TP53基因突变[12,14⁃16]。
随着大规模基因组分析的出现,学者们对CCA在基因组、表观遗传和分子水平上的理解也逐渐提高。目前测序研究发现了基因组不稳定性,如TP53、BRCA1和BRAC2等突变;表观遗传调控的改变,如IDH1和IDH2、BAP1、组蛋白去甲基化/甲基化的改变,激酶信号(KRAS、ERBB1~3、BRAF、PTEN和FGFR1~3等)的改变等,都参与了CCA的发生过程[14,17⁃19]。其中,KRAS突变几乎存在于所有CCA亚型中;TP53、IDH1/2、ARID1A突变,FGFR2融合尤其是BICC1重排,EPHA2和BAP1突变常发生在iCCA中;而人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)扩增,PRKACA和PRKACB融合,ELF3以及ARID1B突变常发生在pCCA和dCCA中[20⁃24]。但是,这种基因组谱的改变与病因也有很强的相关性,例如肝吸虫引起的CCA中TP53、SMAD4、MLL3和GNAS突变率较高,而非肝吸虫相关CCA患者中IDH1/2和BAP1突变率更高。乙肝相关的iCCA患者中TP53突变率较高,而乙肝阴性患者中KRAS突变率较高[18,25⁃26]。这些不同解剖部位的独特遗传特征、组织学特征也为个性化治疗提供了新方向。
2 胆管癌的靶向治疗
近年来随着测序技术的发展和成熟,CCA潜在的分子病理也逐步被揭示,潜在的可靶向的基因突变逐渐被发现,靶向不同靶点的药物,例如靶向IDH突变、成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)、表皮生长因子受体(epithelial growth factor receptor,EGFR)、丝裂原活化蛋白激酶(mitogen⁃activated protein kinase,MAPK)通路、PI3K/AKT/mTOR通路以及乳腺癌易感基因(breast cancer susceptibility gene,BRCA)和DNA损伤修复(DNA damage repair,DDR)相关蛋白等抑制剂被开发,逐渐应用到临床实践中,并表现出一定疗效。不同靶向药物的作用靶点见图1。
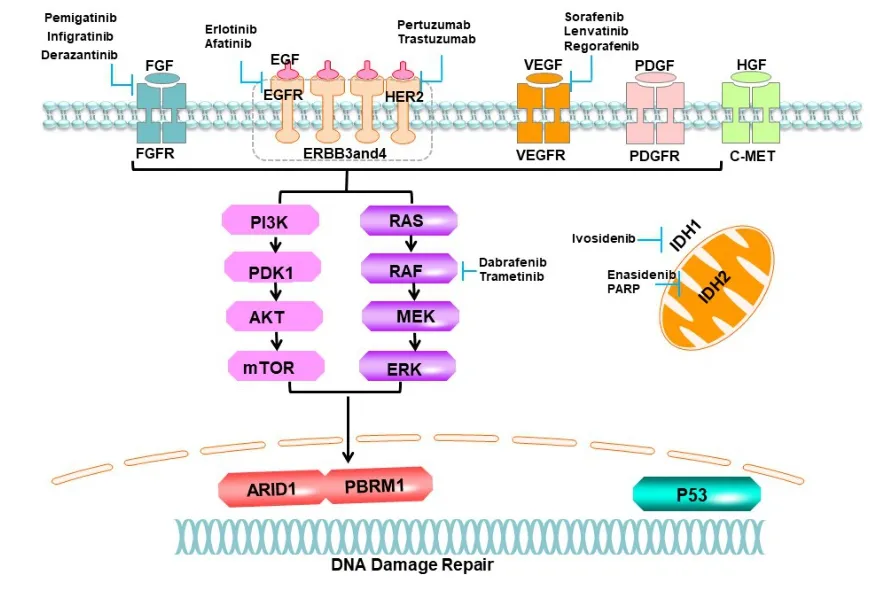
图1 不同靶向药物的作用靶点Fig.1 Targets of different targeted drugs
2.1 针对IDH突变抑制剂
IDH是三羧酸循环中的一种酶,能催化异柠檬酸氧化脱羧生成酮戊二酸。IDH的3种亚型中,目前认为IDH1/2突变会破坏异柠檬酸脱氢酶的正常催化活性,导致产生新的代谢物2⁃羟基戊二酸(2⁃HG),从而诱导细胞发生癌变[27]。IDH1突变较IDH2突变更常见,其中 10%~20%的 iCCA 存在 IDH1突变[28⁃29]。目前针对IDH突变的抑制剂也已经逐渐被开发,例如IDH1抑制剂AG⁃120、IDH2抑制剂AG⁃221和泛IDH1/2抑制剂AG⁃881正逐步走向临床[30⁃34]。在ClarIDHy研究中,185例既往曾接受治疗的伴IDH1突变的CCA患者按2∶1随机分配并分别接受了AG⁃120(Ivosidenib)和安慰剂治疗,结果发现,与安慰剂治疗相比,Ivosidenib治疗显著改善了无进展生存期(progression⁃free survival,PFS),Ivosidenib治疗的中位总生存时间(median overall survival,mOS)为 10.8个月,安慰剂为9.7个月,因此57%使用安慰剂治疗的患者改用Ivosidenib治疗[34]。2020版NCCN指南也指出IDH1突变患者二线治疗可以选择Ivosidenib。AG⁃221(Enasidenib)是突变IDH2的选择性抑制剂,已经在急性髓系白血病的临床前模型中显示出活性,目前正在对晚期实体肿瘤患者进行Ⅰ/Ⅱ期临床试验,其中包括IDH2突变的iCCA(NCT02273739)[35]。聚ADP核糖聚合酶(PARP)抑制剂在IDH1/2突变的iCAA中的效果(NCT03212274、NCT03878095)也在探索中。
2.2 靶向FGFR抑制剂
FGFR是由胞外配体结构域和胞内酪氨酸激酶域构成的受体酪氨酸激酶,包括FGFR1~4 4种亚型,通过与其配体FGF结合而调节细胞增殖、迁移、分化和血管生成[36]。在CCA中,FGFR基因可发生融合、突变和扩增等变化,且这些改变多位于FGFR2的基因编码区,少数位于FGFR1,并与胆管癌的发生和发展密切相关[37⁃38]。其中,13%~20% 的 iCCA 患者存在FGFR基因融合,而FGFR2⁃BICC1融合又是最常见的融合方式之一,因此靶向FGFR信号通路为胆管癌治疗提供了一种新的治疗策略[39]。
最初靶向FGFR突变的药物以非选择性酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)为目标,如仑伐替尼、培唑帕尼和瑞戈非尼等,除了靶向FGFR外,还能抑制其他酪氨酸激酶,包括血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)、血小板衍生生长因子受体(platelet⁃derived growth factor receptor,PDGFR)、FLT3和RET等,而这些药物在含有FGFR2融合的iCCA 中具有一定疗效[40⁃41]。近年来,一些选择性FGFR⁃TKI抑制剂也逐渐被开发,如Pemigatinib(INCB054828)[42]、Infigratinib(BGJ398)[43]和 Futibatinib(TAS⁃120)[44],这些药物在Ⅰ/Ⅱ期临床研究中显示出了可观的疗效,且不良反应可控。其中,Pemigatinib(INCB054828)是一种选择性作用于FGFR1/2/3的抑制剂,已被批准用于治疗曾接受过治疗、存在FGFR2融合或重排、不能手术切除的局部晚期或转移性胆管癌患者,也是首个被批准用于治疗晚期胆管癌的靶向药物。在2021年美国临床肿瘤学会(ASCO)上,FIGHT⁃202研究显示,Pemigatinib在FGFR2基因融合或重排突变的胆管癌患者中客观缓解率(objective response rate,ORR)为 37%,疾病控制率(disease control rate,DCR)为 82.4%,mOS为 17.5个月,mPFS为7个月,药物不良反应在可控范围内[42]。这一研究结果意味着FGFR2基因融合突变的胆管癌患者应用Pemigatinib能明显获益。
一项单臂、Ⅱ期、关于泛FGFR抑制剂Infigratinib(BGJ398)在胆管癌患者中的研究(NCT02150967)显示,Infigratinib具有显著的抗肿瘤活性,ORR和DCR分别为23.1%和84.3%,mPFS为7.3个月,mOS为12.2个月。2021年5月28日,美国FDA加速批准Infigratinib,主要用于FGFR2融合或其他重排,并且既往曾治疗、不可切除的局部晚期或转移性CCA成年患者[43]。此外,Derazantinib(ARQ 087),一种ATP竞争性小分子激酶抑制剂,在FGFR1/2/3突变细胞系中也显示出抗增殖活性。在一项Derazantinib用于治疗伴FGFR2基因融合的不可切除CCA患者的多中心、Ⅱ期临床试验中,总体反应率为21.4%,DCR为74.8%,且安全性可控[45]。目前Derazantinib还有3项临床研究正在开展中。其他FGFR选择性抑制剂,如Debio1347(NCT01948297)、Futibatinib(TAS ⁃120)(NCT04601857)、Erdafitinib(JNJ⁃42756493)(NCT04083976)等也在进行Ⅰ/Ⅱ期临床试验。此外,值得一提的是,以上靶向抑制FGFR信号通路的药物,大多数会引起高磷血症、指甲变化、头发变化(脱发)、黏膜炎、味觉障碍、干眼症、结膜炎、肌肉疼痛和骨关节疼痛等不良反应[46]。
2.3 靶向EGFR抑制剂
EGFR家族由4种受体酪氨酸激酶蛋白组成,分别为ErbB⁃1(EGFR或 HER1)、ErbB⁃2(HER2)、ErbB⁃3(HER3)、ErbB⁃4(HER4),均属于Ⅰ型酪氨酸激酶受体家族,负责细胞内外信号传导,并激活细胞内的下游信号通路[47]。在CCA中EGFR和ERBB2(HER2)表现为过表达,通过激活丝裂原活化蛋白激酶(mito⁃gen⁃activated protein kinase,MAPK)⁃ERK 或 PI3k⁃mTOR通路参与肿瘤发生、侵袭、转移。研究显示,5%~15%的CCA患者会出现HER2改变,且eCCA的HER2改变较iCCA更常见(20%vs1%~2%)。其中,HER2在eCCA中主要以突变和扩增为主,而在iCCA中主要以扩增为主[48]。目前针对HER2改变的靶向药物探索已取得一定成果。如MyPathway研究作为一项多队列篮子试验,主要评估了HER2抑制剂(帕妥珠单抗和曲妥珠单抗)、BRAF抑制剂(维莫非尼)、Hedgehog通路抑制剂(维莫德吉)以及EGFR抑制剂(厄洛替尼)在不同癌种中的作用,其中帕妥珠单抗联合曲妥珠单抗在39例HER2扩增、HER2过表达或转移性胆管癌患者中ORR为23%,中位随访时间为8.1个月[49]。SUMMIT研究评估了奈拉替尼在HER2阳性CCA患者中的疗效,25例患者的ORR为16%,DCR为28%,mPFS为2.8个月,mOS为5.4个月,最常见的治疗相关不良反应为腹泻和呕吐(NCT01953926)。
针对EGFR改变的抑制剂,如厄洛替尼、西妥昔单抗、帕尼单抗等,虽然在前期临床试验中取得一定成果,但单一或与其他抗癌药物联合使用时疗效有限[50⁃51]。目前我国已上市的EGFR抑制剂有三代,第一代EGFR⁃TKI抑制剂代表药物为吉非替尼、厄洛替尼、埃克替尼;第二代有阿法替尼、达可替尼;第三代有奥希替尼、阿美替尼。
2.4 靶向MAPK通路抑制剂
MAPK信号通路是信号从细胞表面传导到细胞核内部的重要通路,典型的MAPK通路激活是由生长因子及细胞表面受体主要是酪氨酸激酶受体(EGF⁃EGFR)结合触发的。MAPK通路主要由上游RAS蛋白(包括NRAS、HRAS、KRAS4A和KRAS4B),RAF(包括ARAF、BRAF和CRAF三种亚型)以及核心成分MEK组成[52]。MAPK信号通路是突变频率最高的一条通路,因此靶向MAPK信号通路已成为肿瘤治疗的热点方向之一。KRAS突变率在eCCA中达8.3%~47.0%,在 iCCA 中 为 8.6%~24.2%[53]。 目 前 针 对KRAS突变的靶向药物效果并不理想,可能会影响正常的MAPK信号传导,相反,抑制其下游信号分子如MEK、BRAF也成为当前的治疗策略[54]。
BRAF突变多发生在iCCA中,突变率为1%~3%,而 BRAF最常见的突变是 BRAF⁃V600E[55]。对于BRAF⁃V600E突变的患者,ROAR篮子试验[56]评估了BRAF抑制剂达拉非尼(D)联合MEK抑制剂曲美替尼(T)对BRAF⁃V600E突变胆管癌患者的治疗有效性和安全性。该研究纳入43例BRAF⁃V600E突变胆管癌患者,ORR达51%,6个月、12个月和24个月的PFS分别为63%、30%、8%,mPFS为9个月;6个月、12个月和24个月的OS分别为84%、56%、36%,mOS为14个月;安全性方面,最常见为发热。2021版NCCN指南推荐BRAF⁃V600E突变的经治晚期胆道肿瘤患者可接受达拉非尼和曲美替尼治疗。
2.5 靶向PI3K/AKT/mTOR通路抑制剂
PI3K/AKT/mTOR通路与MAPK⁃ERK通路一样,主要参与调节细胞增殖和血管生成。有研究报道,PIK3CA中的突变可导致PI3K/AKT/mTOR通路活化,从而促进胆管癌增殖和侵袭[57]。依维莫司是一种mTOR抑制剂,一项针对晚期胆管癌的临床试验显示依维莫司治疗的DCR为44.7%,ORR为5.1%,mPFS为3.2个月,可见单药应用依维莫司在CCA中效果并不理想[58]。
2.6 靶向BRCA和DDR相关蛋白抑制剂
BRCA包括BRCA1和BRCA2,这2个基因负责编码合成一种肿瘤抑制蛋白,参与DNA同源损伤修复并防止细胞过度增殖。近期研究发现,BRCA1/2胚系突变会增加CCA发生风险,大约3.5%的CCA患者中可检测到体系或胚系BRCA突变,同时CCA的发生常伴有DNA修复基因改变。因此,携带这些类型突变的患者对DNA损伤治疗和PARP抑制剂有一定效果。近期,本团队发表的研究成果也证明了这一结论,即有BRCA1/2家系特点的胚系截短突变患者使用奥拉帕利治疗的有效率较高,在研究中有3例患者使用奥拉帕利治疗后达到PR[59]。关于BRCA及DNA损伤修复相关蛋白突变的抑制剂研究(NCT04042831,NCT03207347)正在进行中。
2.7 其他靶向药物
基于嗜神经酪氨酸激酶受体(NTRK)编码的原肌球蛋白受体激酶(tropomyosin⁃receptor kinase,TRK)是一种参与MAPK途径的膜结合受体。NTRK融合可导致TRK改变,促进细胞分化、增殖和存活。3.5%的iCCA患者伴有NTRK融合,目前第一代TRK抑制剂Larotrectinib和Entrectinib已经FDA批准,其在伴有NTRK融合的晚期实体瘤中ORR高达57%~75%[60]。2021版NCCN指南也指出,伴NTRK融合的CCA患者一线可以考虑应用靶向药物(Entrectinib和Larotrectinib)治疗。细胞间质上皮转换因子(cellular⁃mesenchymal epithelial transition factor,c⁃MET)作为肝细胞生长因子(hepatocyte growth factor,HGF)的酪氨酸激酶受体,参与上皮⁃间质转化。其中在12%~58%的iCCA和16%的eCCA中发现c⁃MET过表达[61]。目前,关于MET抑制剂的临床试验发现,无论单药还是联合化疗,其有效率很有限,并未明显改善ORR、PFS或OS[62⁃63]。在CCA中,VEGF过表达是一种不良预后因素。但是在CCA临床试验中测试的几种抗血管生成剂,如索拉非尼、仑伐替尼、瑞戈非尼等,其靶向VEGF并未取得满意的效果[64]。
3 胆管癌的免疫治疗
免疫治疗已成为肿瘤领域的研究热点之一,突变负荷越高越能从免疫治疗中受益。目前研究发现相当一部分CCAs显示出较高的突变负荷,提示免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)治疗可能在CCA患者中有效[65]。ICIs在CCA中也进行了许多尝试,但单药的治疗效果依然有限[66⁃70](表1)。纳武利尤单抗在晚期CCA患者中ORR为22%,DCR为59%,mPFS为3.68个月,mOS为14.24个月,而在整个研究中获益的人群还是以伴错配修复缺陷(deficiency mismatch repair,dMMR)以及PD⁃1/PD⁃L1阳性的患者为主[71]。KEYNOTE⁃158以及KEYNOTE⁃028研究评估了帕博利珠单抗在CCA患者中的作用,效果还是有限。KEYNOTE⁃028研究纳入24例CCA患者,ORR为13%,mOS和mPFS分别为6.2个月和1.8个月[72]。在KEYNOTE⁃158研究中,纳入104例CCA患者,ORR为5.8%,mPFS为2个月,mOS为7.4个月[72]。2021版NCCN指南指出伴有MSI⁃H/dMMR以及肿瘤突变负荷高表达的肿瘤患者可以选择帕博利珠单抗。为了提高免疫抑制剂在CCA中的疗效,不同免疫抑制剂之间的联合方案也在不断尝试。例如,纳武利尤单抗(PD⁃1)联合伊匹木单抗(CTLA⁃4)在晚期无微卫星不稳定灶的CCA患者中的研究发现,两者联合的ORR为23%,DCR为44%,mPFS、mOS分别为2.9个月和5.7个月[73]。

表1 ICIs单药治疗CCA患者的部分临床研究结果Tab.1 Partial clinical research results of ICIs monotherapy in patients with CCA
目前尽管有大量临床试验试图观察ICIs对CCA的疗效,但现有的临床数据仍主要局限于小型单臂研究和篮子试验的亚组分析,并不能得出关于双免疫检查抑制点联合方案的潜在附加价值。为了进一步探讨免疫抑制剂的潜在价值,免疫抑制剂联合靶向药物、联合化疗、联合局部治疗的研究也在进行中。如LEAP⁃005Ⅱ期研究显示,仑伐替尼联合帕博利珠单抗在晚期胆道肿瘤患者中ORR为10%,DCR为68%,中位缓解持续时间为5.3个月[74]。笔者团队前期一项关于仑伐替尼联合帕博利珠单抗治疗晚期CCA的研究中,ORR为25%,DCR为78.1%,临床受益率为40.5%,mPFS为4.9个月,mOS为 11.0个月[75]。也有研究对帕博利珠单抗联合Ramucirumab(VEGFR2抑制剂)以及阿替利珠单抗(PD⁃L1抗体)联合Cobimetinib(MEK抑制剂)在既往曾接受治疗的晚期CCA患者中进行探索[76]。还有研究报道,阿替利珠单抗联合Cobimetinib较单独使用阿替利珠单抗显著延长了中位无进展生存期(111 dvs57 d)[77⁃78]。帕博利珠单抗(NCT02703714)、纳武利尤单抗(NCT03639935)、度伐利尤单抗(NCT03875235)也在积极探寻联合吉西他滨/顺铂(GC)方案作为一线治疗的有效性。PD⁃1/PD⁃L1联合放疗、射频治疗、TACE的临床研究(NCT03937830)也在进行中。
4 小结与展望
综上所述,目前晚期CCA仍以姑息性化疗为主,但治疗效果有限。CCA存在高度异质性,这为分子靶向治疗提供了基础。目前的一系列临床试验表明,分子靶向治疗在CCA中显示出良好的疗效,其中Pemigatinib已被FDA批准用于治疗FGFR基因突变的CCA。同时,靶向联合免疫治疗及化疗的综合治疗方案也显示出良好的应用前景。未来随着高通量测序技术以及免疫治疗的发展,晚期CCA患者的治疗模式也会发生变化,针对突变基因的个体化精准治疗将成为新的方向。积极探寻遗传突变,选择合适的治疗靶点,以及探索与其他抗肿瘤方案联用,是改进晚期CCA治疗效果,延长患者寿命值得注意的突破点。

