miR⁃429靶向调控SIAH1基因对结直肠癌细胞LOVO增殖的影响
李姗姗 裴阳 张威 孙立影 姜淼 尚国印 牛思佳 马志斌
结直肠癌是常见的消化系统恶性肿瘤,在全球癌症发病率及死亡率中均高居第三位[1⁃2]。在我国,结直肠癌在近年来也成为发病率增长最快的恶性肿瘤之一,死亡率亦逐年递增[3]。早期预测和发现对改善结直肠癌患者预后至关重要,因此学者们不断试图从结直肠癌的发病机制中寻找靶点,以在始动环节中断其发生。miRNA属于单链式的非编码RNA,长度为18~25个核苷酸,其在肿瘤发生发展和分子靶向治疗中的研究备受关注[4⁃5]。在结直肠癌中,目前也已经发现了几十种异常表达的相关miRNA,miRNA可以作用于细胞成瘤性,从而促进或抑制癌细胞转移和增殖[6⁃7]。本研究在前期的甲基化芯片检测中发现miR⁃429在甲基化前后数值差异显著,提示miR⁃429可能是一种抑癌基因[8]。本研究进一步通过Targetscan软件筛选出miR⁃429与细胞增殖密切相关的靶向基因SIAH1,构建含SIAH1基因3′⁃UTR重组双荧光素酶报告质粒,探讨miR⁃429是否通过靶向调控SIAH1表达而影响结直肠癌细胞LOVO增殖。
1 材料与方法
1.1 主要材料与试剂
人正常结肠黏膜上皮细胞NCM460和结直肠癌细胞系SW480、LOVO、HT⁃29购自ATCC细胞库;miR⁃429 mimic及阴性对照(NC)由上海吉玛制药技术有限公司合成;LipofectamineTM2000试剂盒、TRIzol试剂盒、逆转录试剂盒以及qRT⁃PCR试剂盒、BCA试剂盒、紫外分光光度计均购自美国Thermo Fisher公司;双荧光素酶检测试剂盒购自Promega公司;双荧光素酶报告基因实验转染质粒购自南京博恩生物技术有限公司;倒置显微镜购自麦克奥迪实业集团有限公司;F12K培养基、胰酶、EDTA购自美国Sigma公司;一抗SIAH1抗体、二抗山羊抗体IgG购自英国Abcam公司;荧光定量PCR仪购自韩国Bioneer公司。
1.2 细胞分组和转染
将人正常结肠黏膜上皮细胞NCM460和结直肠癌细胞系SW480、LOVO、HT⁃29培养于RPMI⁃1640培养基中。qRT⁃PCR检测miR⁃429表达量并选取miR⁃429表达最低的细胞系纳入后续实验。取对数生长期细胞,以4×105/mL浓度接种于6孔板中。实验分组:转染过表达质粒miR⁃429 mimic(miR⁃429 mimic组)和转染miR⁃429阴性对照序列(NC组),以不做任何处理的细胞作为空白对照组(Control组)。转染步骤依据Li⁃pofectamineTM2000试剂盒说明书进行。
1.3 靶向关系预测和双荧光素酶报告基因实验
采用Targetscan软件在线分析预测miR⁃429特异性靶向基因。将miR⁃429作为检索词输入Targetscan(www.targetscan.org)在线分析软件中预测与miR⁃429存在特异性结合位点的靶基因,然后通过双荧光素酶报告基因实验验证miR⁃429和SIAH1的靶向关系。首先将含有miR⁃429结合位点的SIAH1序列进行扩增并克隆至pmirGLO双荧光素酶报告载体,该序列命名为SIAH1⁃3′UTR⁃WT,同时构建突变型对照(SIAH1⁃3′UTR⁃MUT)。将上述2种序列分别与NC和miR⁃429 mimic共转染至HEK⁃293T细胞,转染过程按照LipofectamineTM2000试剂盒说明书进行。48 h后,使用双荧光素酶报告基因检测试剂盒测定各组细胞的荧光素酶活性,荧光素酶活性以萤火虫荧光素酶和海肾荧光素酶活性的比值进行计算。
1.4 qRT⁃PCR检测 miR⁃429 mRNA的表达
采用TRIzol试剂盒提取LOVO细胞中总RNA,依据逆转录试剂盒说明书合成cDNA,然后按照qRT⁃PCR试剂盒说明进行反应。PCR反应条件:95℃变性10 min,60℃退火30 s、72℃延伸40 min,共40个循环。引物序列如下:miR⁃429 上游为 5′⁃ACTGCTC⁃GATGCTCGATCGTAGCA⁃3′,下游为5′⁃CTAGCTAGT⁃GCTCGATAACGTCCA⁃3′;U6上游为5′⁃GCTCGAAC⁃GTAGCAGCGATGCAGT⁃3′,下游为 5′⁃GTGCAACGC⁃GAGGCCTGGTGCAAC⁃3′。使用2-△△Ct法计算miR⁃429的相对表达量。
1.5 Western blot检测SIAH1蛋白表达
收集各组细胞,加入RIPA裂解液裂解细胞,提取总蛋白,用BCA试剂盒测定蛋白浓度。取30 μg蛋白上样,之后行SDS⁃PAGE凝胶电泳,转膜,5%脱脂奶粉封闭,然后加入以1∶2 000稀释的SIAH1抗体作为一抗,4℃条件下孵育过夜;次日加入1∶2 500稀释的山羊抗兔IgG作为二抗,室温条件下孵育1 h;然后用ECL显影液显影,拍照。以GAPDH为内参,采用Image J软件测定蛋白灰度值。
1.6 流式细胞仪检测细胞周期
收集各组细胞,用胰酶消化后以1%胎牛血清洗涤,0.5%乙醇固定30 min。然后用PBS冲洗,RNase水浴细胞30 min后,加入50 μL浓度为10 μg/mL的PI染液,室温下染色30 min。上流式细胞仪检测细胞周期的情况并分析。
1.7 MTT法检测细胞增殖
各组细胞转染36 h后,用胰蛋白酶消化,然后收集各组细胞并接种于96孔板,每孔接种5×103个细胞。分别在转染第1天、2天、3天、4天、5天、6天时向各孔中加入20 μL的MTT溶液,4 h后上酶标仪检测490 nm处各组细胞的吸光度(OD)值,并绘制细胞生长曲线。
1.8 统计学方法
采用SPSS 17.0统计软件对数据进行分析。符合正态分布的计量资料以均数±标准差(x±s)表示,两组均数比较采用独立样本t检验,多组均数比较采用单因素方差分析,若组间差异有统计学意义,采用Bonferroni检验进行多重比较。本研究以双侧P<0.05为差异有统计学意义。
2 结果
2.1 miR⁃429在结直肠癌细胞系中的表达
qRT⁃PCR检测结果显示,与NCM460细胞相比,结直肠癌细胞系 SW480、LOVO、HT⁃29中 miR⁃429的表达均降低(均P<0.001),其中LOVO细胞系中miR⁃429的表达最低,因此选择LOVO细胞进行后续实验。见图1。
2.2 miR⁃429和SIAH1的靶向关系验证
Targetscan靶向关系预测网站分析显示,miR⁃429和SIAH1存在特异性结合位点,见图2A。双荧光素酶报告基因实验验证二者之间的靶向关系,结果显示,在LOVO细胞中,相对于NC组,SIAH1⁃3′UTR⁃WT与miR⁃429 mimic共转染组的荧光素酶活性显著降低(t=7.861,P=0.001),见图2B。
2.3 成功构建过表达miR⁃429的结直肠癌细胞LOVO
qRT⁃PCR检测结果显示,LOVO细胞转染24 h后,miR⁃429 mimic组中miR⁃429的表达显著高于NC组(3.948±0.382vs0.913±0.075,t=13.501,P<0.001),见图3。说明转染成功。

图3 miR⁃429转染效率验证Fig.3 Verification of miR⁃429 transfection efficiency
2.4 过表达miR⁃429对结直肠癌细胞LOVO中SIAH1蛋白表达的影响
Western blot检测结果显示,转染72 h后,miR⁃429 mimic组细胞中SIAH1蛋白表达水平较NC组显著降低(0.415±0.046vs1.012±0.093,t=9.966,P<0.001),见图4。说明过表达miR⁃429能抑制SIAH1蛋白的表达。

图4 过表达miR⁃429对LOVO细胞中SIAH1蛋白表达的影响Fig.4 Effect of miR⁃429 overexpression on the expression of SIAH1 protein in LOVO cells
2.5 过表达miR⁃429对结直肠癌细胞LOVO周期的影响
流式细胞仪检测细胞周期结果显示,相对于NC组和Control组,miR⁃429 mimic组细胞LOVO在G0G1期、S期、G2M期细胞所占百分比减少(均P<0.05),见图5。说明过表达miR⁃429能使细胞阻滞在G0G1期。

图5 过表达miR⁃429对LOVO细胞周期的影响Fig.5 Effect of miR⁃429 overexpression on cell cycle of LOVO cells
2.6 过表达miR⁃429对结直肠癌细胞LOVO增殖的影响
MTT法检测结果显示,从4~6 d开始,miR⁃429 mimic组中细胞增殖能力较Control组和NC组显著降低(均P<0.001),见图6。说明过表达miR⁃429能抑制LOVO细胞增殖。
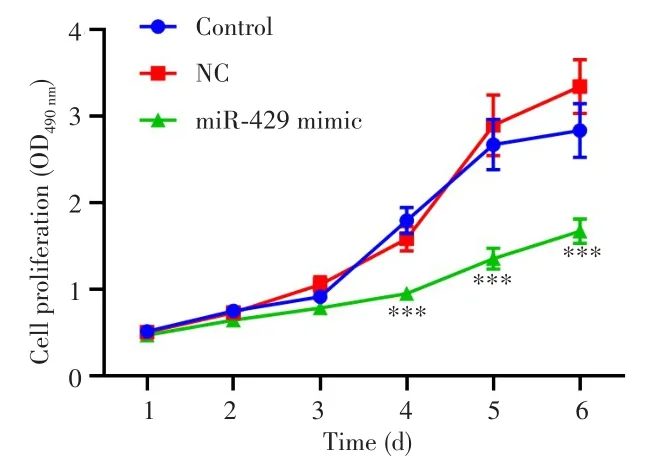
图6 过表达miR⁃429对LOVO细胞增殖的影响Fig.6 Effect of miR⁃429 overexpression on the proliferation of LOVO cells
3 讨论
miRNAs是一种较小的内源性非编码RNA分子,普遍存在于单核原始生物及复杂的真核生物中,并在进化过程中表现保守,因此得以保证其功能的特殊性[9]。研究发现miRNA在肿瘤发生、发展中发挥着重要作用,对癌性基因有一定促进功能,甚至可以直接促进癌细胞分化、转移、增殖,最终形成恶性肿瘤[10]。但是miRNA发挥抑癌或者促癌作用都直接受细胞表达方式和细胞恶性转化的影响[11]。
miR⁃429属于miR⁃200家族,具有高度保守、基因簇集现象、时序性和组织特异性等生物学特性[12]。该家族在部分肿瘤(肝癌、肾细胞癌)中呈低表达,而在一些肿瘤(膀胱癌、宫颈癌)中呈高表达[13]。关于miR⁃429,常靓等[14]在胃癌组织中发现miR⁃429表达显著低于癌旁正常组织,提示其在胃癌中可能起抑癌基因作用。吕桂帅等[15]报道miR⁃429可以调节肝细胞癌的炎性微环境、分化及增殖。LI等[16]在过表达miR⁃429的子宫内膜癌细胞中观察到了细胞增殖抑制和凋亡增加,而在乳腺癌中miR⁃429则促进细胞增殖和转移[17]。但是目前miR⁃429在结直肠癌中的作用鲜有研究。
SIAH家族蛋白与果蝇属SINA蛋白属于同系物,其中SINA属于人体中的高度保守蛋白,与SIAH1和SIAH2同源。SIAH1在人体16q12号染色体中表达水平比较高,其编码长度可达282个氨基酸,与果蝇属SINA的序列机构有76%的相似度,与SIAH1有77%的同一性[18]。然而SIAH1和SIAH2蛋白在N端有显著差别。SIAH1蛋白具有E3泛素连接酶的活性,作为泛素连接酶之一,能够在细胞正常发展及人类疾病过程中发挥调节蛋白稳定、复杂蛋白的组装的功能[19]。这些蛋白包括β⁃catenin、c⁃myb、APC和SIAH1本身。目前认为SIAH1属于抑制肿瘤发生的重要蛋白,在肝癌患者细胞系中发现SIAH1表达存在高活跃性,其水平越高,肝癌细胞凋亡数目越多,从而发挥抑癌作用[20]。同时,也有研究发现,乳腺癌患者中SIAH1表达可作用于有丝分裂细胞,从而抑制细胞增殖和生长,逐渐促进癌细胞走向凋亡[21]。另有研究表明,SIAH1依附或独立存在于p53细胞中,可促进细胞凋亡,产生抑制恶性肿瘤进展的作用[22]。可见,SIAH1在肿瘤发生、进展、凋亡中敏感性较高,在多种恶性肿瘤中表达异常。但是,关于SIAH1在结直肠癌中的表达研究有限。
miRNA主要通过与靶基因3′⁃UTR区的互补序列完全或不完全结合,导致靶基因的降解而发挥负性调控作用[23]。本研究利用双荧光素酶报告基因实验证实SIAH1基因的3′⁃UTR区有miR⁃429的结合位点,提供了miR⁃429靶向调控SIAH1基因的结构学证据。然后进一步将SIAH1 3′⁃UTR区序列经PCR扩增后连接入双荧光素酶报告载体,并将突变的SIAH1的3′⁃UTR区(mutUTR)设置为对照,用 miR⁃429 mimic与上述重组质粒共转染LOVO细胞,结果证实了miR⁃429通过与SIAH1基因3′⁃UTRs区的结合位点相结合来发挥负性调控作用。而既往研究显示miRNA调控基因表达的主要方式是通过一种未知方式诱发蛋白质翻译抑制从而抑制蛋白质合成[24⁃25]。因此,本研究再利用免疫印迹方法对各处理组的SIAH1基因蛋白质水平进行检测,结果发现过表达miR⁃429的LOVO细胞中SIAH1蛋白表达水平明显降低,说明miR⁃429可能通过负向调控SIAH1基因的降解发挥作用,为miR⁃429调控SIAH1提供了功能学证据。本研究的MTT实验和流式细胞仪检测还发现过表达miR⁃429后,LOVO细胞的增殖速度明显减慢,对细胞的S~G2M期阻滞也证明了能抑制细胞增殖,说明miR⁃429负向调控SIAH1基因后抑制了结直肠癌细胞增殖。
综上所述,本研究初步证实了miR⁃429可以靶向调控SIAH1基因的表达而抑制结直肠癌细胞的过度生长、增殖。由此推测,当正常的结直肠癌细胞由于甲基化等原因使miR⁃429表达沉默,导致其抑癌功能丧失,从而可能促进结直肠癌的形成。但是miR⁃429的确切作用机制以及同细胞调控网络的相互作用等仍有待进一步研究。本研究结果对进一步揭示miRNA功能,以及结直肠癌发生的分子生物学机制研究及早期肿瘤诊断和治疗提供了新的方向。

