鸡蛋壳膜多肽酶解工艺及抗氧化活性研究
张伟云,张凤清
(长春工业大学化学与生命科学学院,吉林长春130012)
鸡蛋壳膜,俗称“凤凰衣”[1],含有90%以上的蛋白质,且氨基酸组成合理,是一种优质蛋白[2]。其中,壳膜中的蛋白质主要有角蛋白(keratin)、胶原蛋白(collagen)、卵清蛋白(ovalbumin)、溶菌酶(lysozyme)、骨桥蛋白(osteopontin)等成分[3]。目前,在医药领域具有加速上皮形成[4-5]、消炎[6]及促进肌肤生长等功效,同时对临床中褥疮、皮肤烫伤[7]及外伤性鼓膜穿孔[8]等也有良好的治疗效果。但大部分壳膜蛋白中存在大量的二硫键,使得壳膜蛋白性质相当稳定,不溶于酸、碱等[9]。壳膜蛋白的难溶性,不易被人体吸收,限制了其加工和应用。因此,建立一种温和、可行且安全的方法用于鸡蛋壳膜中蛋白质的水解,增加其资源利用率显得尤为重要。
蛋白酶酶解法,主要通过酶促反应将蛋白质中的二硫键打开,以获得可溶性多肽[10]。研究发现,利用蛋白酶酶解法生产抗氧化性酶解液可以得到大量的具有免疫活性[11]、抗高血压、抑制肿瘤、抗氧化[12]、抗高血脂等功能的生物活性肽[13]。
本研究采用酶解法,将鸡蛋壳膜酶解成小分子肽,并对其酶解工艺进行优化。通过测定鸡蛋壳膜多肽不同抗氧化体系的清除效果,研究其体外抗氧化活性,旨在为鸡蛋壳膜综合利用提供科学依据,同时使鸡蛋壳膜变废为宝,可以改善环境,提高产品经济附加值。
1 材料与方法
1.1 材料与仪器
鸡蛋壳膜:市售;碱性蛋白酶(AP-200a)(20万 U/g):安琪酵母股份有限公司;胃蛋白酶(3万U/g)、木瓜蛋白酶(10万 U/g)、复合蛋白酶(50万 U/g)(均为食品级):河南万邦实业有限公司;2,2-联苯基-1-苦基肼基(DPPH)、2,2'-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS):上海麦克林生化科技有限公司;抗坏血酸(VC):国药集团化学试剂有限公司;邻苯三酚:北京化工厂;pH精密试纸:上海三爱思试剂有限公司;海洋鱼低聚肽校正曲线标准品:上海曦玉分析仪器科技有限公司;其它试剂均为分析纯。
UV-5500紫外可见分光光度计:上海元析仪器有限公司;HH-4数显恒温水浴锅:金坛市江南仪器厂;TG16G型高速离心机:湖南凯达科学仪器有限公司;DYF-200C万能粉碎机:上海皓庄仪器有限公司;FD-1A-50型冷冻干燥机:上海五久自动化设备有限公司;安捷伦1260型四元梯度液相色谱仪:美国安捷伦科技有限公司;TSKgel G2000 SWXL型凝胶柱:上海曦玉分析仪器科技有限公司;JA2003B型千分之一电子天平:上海越平科学仪器有限公司。
1.2 试验方法
1.2.1 鸡蛋壳膜多肽制备的工艺流程
鸡蛋壳膜→预处理(粉碎)→加水溶解→用1.0mol/L的NaOH溶液或HCl调节pH值→调节水浴温度→加一定量蛋白酶恒温酶解→高温灭活→离心(4000r/min,15 min)→取上清液→冷冻干燥→鸡蛋壳膜多肽
1.2.2 酶解试验
1.2.2.1 蛋白酶种类的确定
取鸡蛋壳膜,粉碎至粉末,均分成4等份,加适量水搅匀,选用食品级胃蛋白酶、碱性蛋白酶(AP-200a)、木瓜蛋白酶和复合蛋白酶,在各自最适条件下酶解5 h,酶解后高温灭活10 min,以4 000 r/min离心15 min,取上清液,冷冻干燥得鸡蛋壳膜冻干粉。以水解度为指标,筛选最适蛋白酶。
1.2.2.2 鸡蛋壳膜酶解工艺优化
单因素试验:分别研究酶解时间、料液比、酶添加量3个因素对水解度的影响。酶解时间取 3、4、5、6、7h;料液比取 1∶7、1∶8、1∶9、1∶10、1∶11(g/mL);酶添加量取0.5%、1.0%、2.0%、3.0%、4.0%,依次将上述3个因素中的任意2个因素确定为定值,变化另外1个因素,考察其变化范围对鸡蛋壳膜酶解效果的影响。
响应面试验:在上述单因素试验的基础上,以鸡蛋壳膜多肽的水解度为响应值,考察酶解时间(A)、料液比(B)、酶添加量(C)3个因素对响应值的交互影响,根据Box-Behnken design(BBD)设计三因素三水平的响应面试验。各因素水平如表1所示。

表1 响应面试验因素水平Table 1 Factors and levels of response surface experiments
1.2.3 水解度的测定
总氮含量测定:采用GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》中的凯氏定氮法;氨基酸态氮含量测定:采用GB 5009.235—2016《食品安全国家标准食品中氨基酸态氮的测定》中的甲醛值法;水解度(DH)计算公式见公式1。

1.3 多肽分子量及分布范围测定
为了探究本法得到的鸡蛋壳膜肽粉中肽的分子量及其分布范围,本法依据GB/T 22729—2008《海洋鱼低聚肽粉》中的方法进行测定,通过高效凝胶过滤色谱对肽粉中肽的分子量分布情况进行检测,以海洋鱼低聚肽为校正曲线标准品。
1.4 鸡蛋壳膜多肽的体外抗氧化活性测定
1.4.1 DPPH·清除率测定
参考王敏等[14]的方法,并作适当修改。分别取2.0 mL不同质量浓度(0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mg/mL)的样品溶液与系列同等质量浓度的VC溶液,再分别加入等量的2.0mL DPPH溶液(0.1mmol/L,溶于无水乙醇)置于具塞试管中,摇匀反应30 min,在517 nm下测定吸光度为A(空白为等量的无水乙醇)。2.0mL乙醇溶液加入2.0mL样品溶液,摇匀反应30 min后,在517 nm处测定吸光度值Aj。2.0 mL DPPH溶液加入2.0 mL蒸馏水在517 nm处测定其吸光度值A0。鸡蛋壳膜多肽对DPPH·的清除能力以清除率R1表示。DPPH·清除率的计算公式见公式2。

1.4.2 ABTS+·清除率测定
参考姬晨曦等[15]的方法,并作适当修改。取适量体积7.4 mmol/L的ABTS溶液和等体积2.6 mmol/L的过硫酸钾溶液,混合均匀后室温(25℃)避光放置12 h~16 h,形成ABTS+储备液备用。将ABTS+储备液用无水乙醇稀释至吸光度为0.70±0.002,即ABTS+工作液备用。分别取 600 μL 不同质量浓度(0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mg/mL) 的样品溶液与系列同等质量浓度的VC溶液,再分别加入5.0 mL ABTS+工作液置于具塞试管中,摇匀反应15 min,在734 nm下测定吸光度为A(空白为等量的无水乙醇)。5.0 mL乙醇溶液加入600 μL样品溶液,摇匀反应15 min后,在734 nm处测定吸光度值Aj。5.0 mL ABTS+工作液溶液加入600 μL蒸馏水在734 nm处测定其吸光度值A0。鸡蛋壳膜多肽对ABTS+·的清除能力以清除率R2表示。ABTS+·清除率的计算公式见公式3。

1.4.3 ·OH清除率测定
参考綦蕾等[16]的方法,并作适当修改。分别取2.0mL不同质量浓度(0.5、1.0、1.5、2.0、2.5、3.0 mg/mL)的样品溶液与同等质量浓度的VC溶液,再依次加入1 mL 9 mmol/L FeSO4、1 mL 9 mmol/L水杨酸乙醇溶液,混匀后加入1 mL 9 mmol/L H2O2于具塞试管中,在37℃下水浴30 min后,在波长510 nm处测定吸光度值A(空白为等量的蒸馏水),用蒸馏水代替FeSO4、水杨酸乙醇溶液、H2O2,在37℃下水浴30 min后,在波长510 nm处测定吸光度值Aj。用蒸馏水代替样品溶液,在37℃下水浴30 min后,在波长510 nm处测定吸光度值A0。鸡蛋壳膜多肽对·OH的清除能力以清除率R3表示。·OH清除率的计算公式见公式4。

参考胡小军等[17]的方法,并作适当修改。分别取50 mmol/L、pH8.2的Tris-HCl缓冲液4.5 mL于试管中,在25℃水浴中放置20 min后,再分别加入1.0 mL不同质量浓度(0.5、1.0、1.5、2.0、2.5、3.0 mg/mL)的样品溶液与系列同等质量浓度的VC溶液,然后加入0.4 mL 25.0 mmol/L的邻苯三酚溶液、1.0 mL 8.0 mol/L的HCl溶液混匀后,在25℃水浴中放置5 min,在波长为325 nm处测定吸光度A(空白为等量的蒸馏水)。用蒸馏水代替Tris-HCl缓冲液、邻苯三酚溶液、HCl溶液,在25℃水浴中放置5 min,在波长为325 nm处测定吸光度值Aj。用蒸馏水代替样品溶液,在25℃水浴中放置5 min,在波长为325 nm处测定吸光度值A0。鸡蛋壳膜多肽对的清除能力以清除率R4表示。清除率的计算公式见公式5。
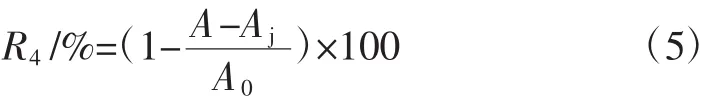
1.4.5 酶的体外抗氧化验证
根据1.4.2试验方法,用确定的碱性蛋白酶(AP-200a)作为样品,对ABTS+·的清除能力进行测定。
1.5 数据处理
采用Excel进行数据分析,试验结果表示为平均值±标准差。采用Origin9.0软件绘制图表,通过Design-Expert.V 8.0.6.1软件获得响应面数据。
2 结果与分析
2.1 蛋白酶种类的确定
酶是具有生物活性的蛋白质,它具有高效性和专一性,酶种类是酶解过程中最重要的影响因素之一[18]。为了方便比较,在各个蛋白酶最适温度和最适pH值下对鸡蛋壳膜进行酶解,不同蛋白酶对水解度的影响如图1所示。

图1 酶种类对酶解效果的影响Fig.1 Effect of enzyme types on enzymatic hydrolysis
由图1可知,碱性蛋白酶(AP-200a)对鸡蛋壳膜的酶解效果最好,水解度达到(27.52±1.21)%,而另外3种蛋白酶相对较低。所以选择碱性蛋白酶(AP-200a)作为最优酶,进行后续酶解工艺的优化。
2.2 鸡蛋壳膜酶解单因素试验
酶解时间、料液比、酶添加量对酶解效果的影响见图2。

图2 酶解时间、料液比、酶添加量分别对酶解效果的影响Fig.2 Effect of enzymatic hydrolysis time,material-liquid ratio,amount of enzyme on enzymatic hydrolysis effect
由图2(A)可知,当酶解时间3 h~5 h时,水解度呈逐渐上升的趋势。酶解时间5h时,水解度最大。随着酶解时间的延长,水解度变化不大,故设定5 h为较优的酶解时间。由图 2(B)可知,当料液比1∶7(g/mL)~1∶9(g/mL)时,水解度呈逐渐上升趋势,超过1∶9(g/mL)时,水解度趋于平稳,故选 1∶9(g/mL)为较优的料液比。由图 2(C)可知,随着酶添加量增加,水解度逐渐增大,当酶添加量超过2.0%时,水解度变化不大并趋于平稳。因此,最佳的酶添加量为2.0%。
2.3 响应面设计结果
2.3.1 BBD模型建立
在最佳酶解条件下,按照表1设计进行试验,以壳膜多肽水解度为响应值,共17组试验,其中5组中心点,每组重复3次。对得到的数据进行拟合,得到的二次回归方程为Y=27.21+1.38A+0.82B+0.81C+0.02AB+0.025AC-0.023BC-1.78C2-0.95B2-1.06C2。响应面分析结果见表2,响应面二次模型的ANOVA分析见表3。

表2 响应面分析结果Table 2 Analysis result for response surface
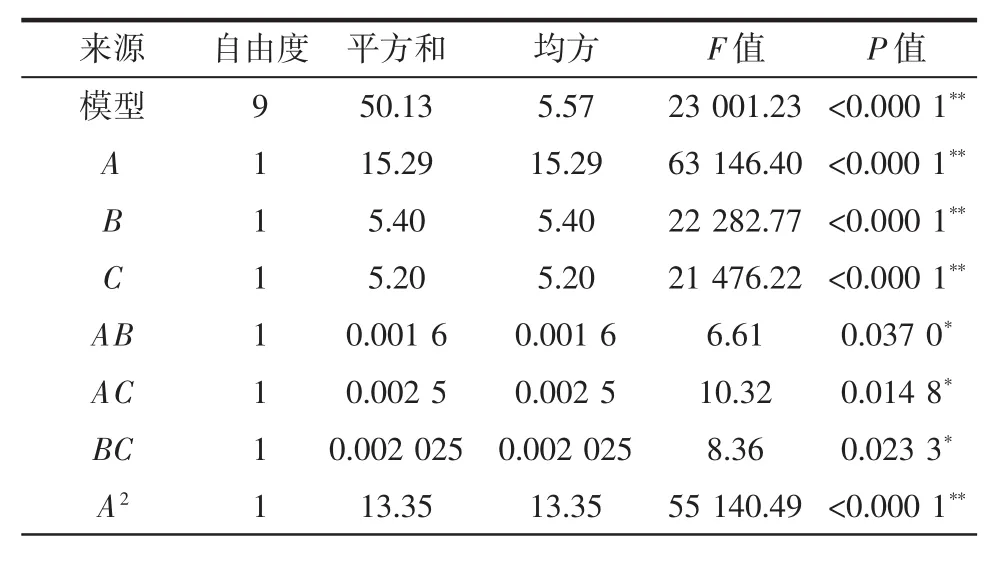
表3 响应面二次模型的ANOVA分析Table 3 ANOVA for response surface quadratic model
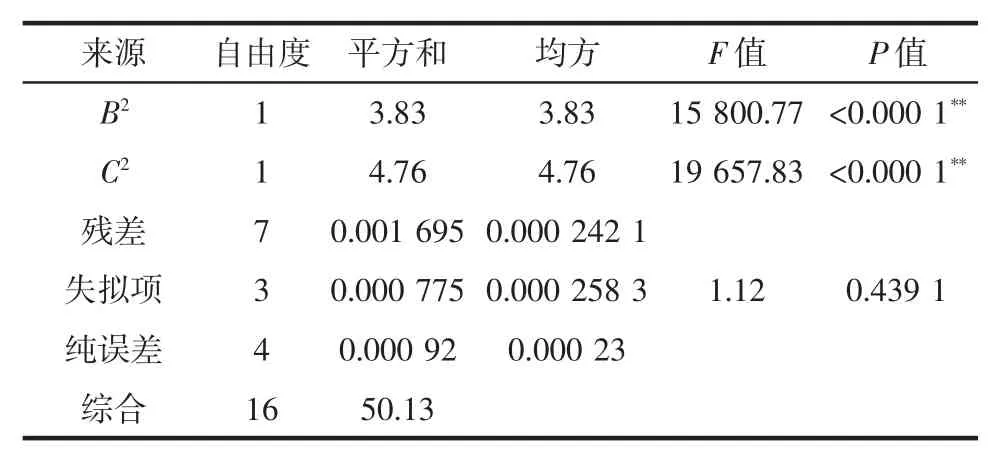
续表3 响应面二次模型的ANOVA分析Continue table 3 ANOVA for response surface quadratic model
由表3中ANOVA分析结果可知,该法所建模型极显著(P模型<0.000 1),且失拟项表现为不显著(P失拟项=0.439 1),具有极好的相关矫正系数(R2adj=0.999 9),表明该模型建立成功,对现实试验效果具有良好的预判效果,能很好地模拟现实试验规律。
2.3.2 BBD分析
通过对BBD模型拟合结果进行分析,可以更好地判断各个因素间的交互影响以及影响规律。各因素交互作用对水解度的影响见图3。
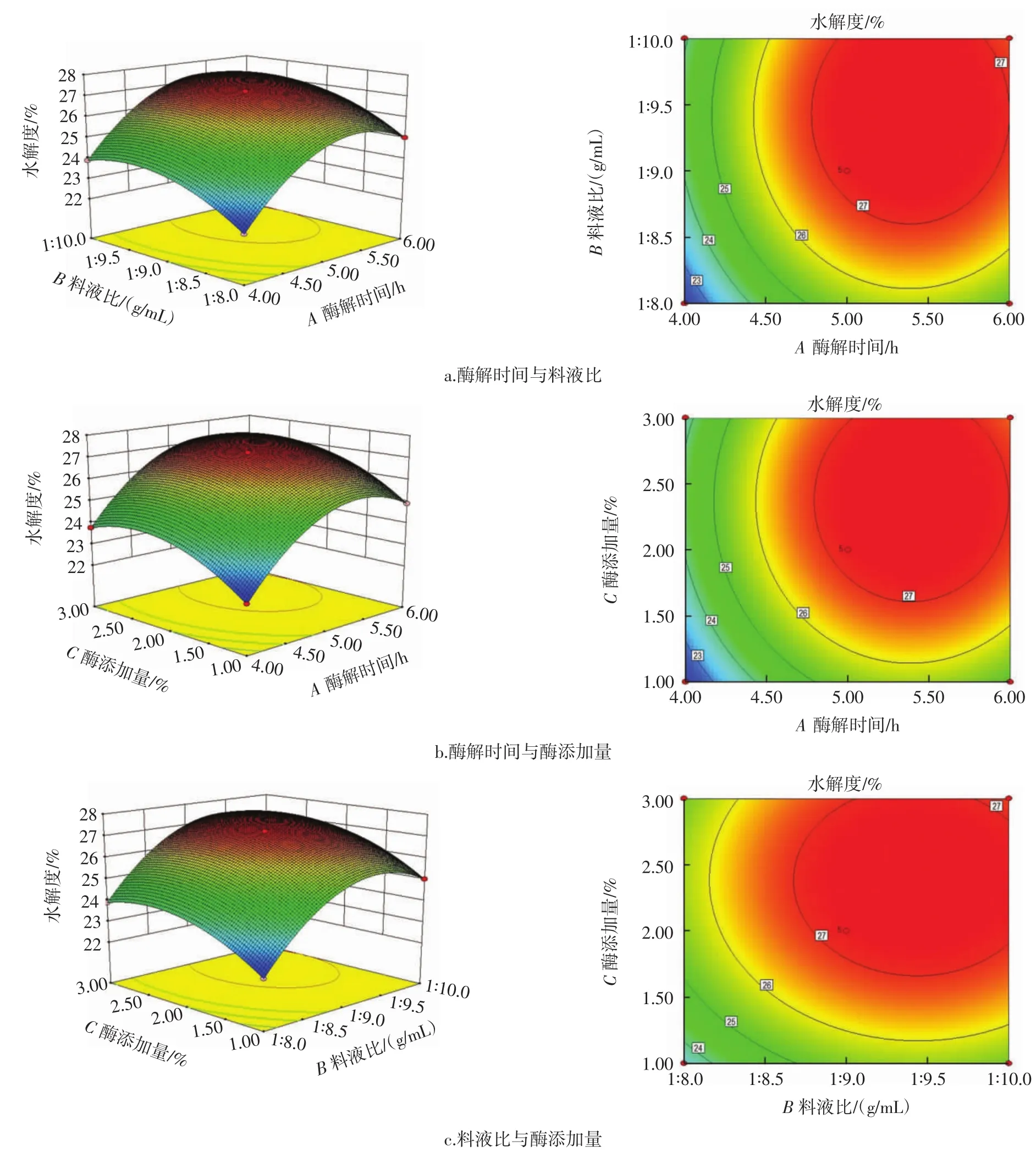
图3 各因素交互作用对水解度的影响Fig.3 Effect of interaction of various factors on hydrolysis degree
如图3所示,三维图中坡度的陡峭程度代表因素在交互影响中的显著性,因素的三维图越陡峭,显著性越大;而二维等高线图则是三维图的投影,通过其疏密程度可判断因素的显著性,在变化区间内,因素的等高线越密集,显著性越大,对响应值的影响也越大。由图3a和图3b可以看出,当固定料液比(B)和酶添加量(C),变化酶解时间(A)时,酶解时间对应响应值等高线的密度明显高于料液比和酶添加量的等高线密度,表明酶解时间在取值范围内变化时对响应值影响的显著性要高于料液比和酶添加量,表3中A、B和C的F值分别为63 146.40、22 282.77和21 476.22,这与上述试验规律相一致。造成这种现象的原因可能是由于酶解时间不足,蛋白酶与底物接触不充分,导致酶促反应不充足,酶解过程不完全,所得多肽含量较低;当酶解时间过长时则会导致部分多肽进一步水解成氨基酸,使水解度稍微下降。此现象与图3中二维等高线图规律相符,当酶解时间、料液比和酶添加量处于低值时,壳膜蛋白水解度均低于20%,而当酶解时间、料液比和酶添加量高于 5 h、1∶9(g/mL)和 2%时,壳膜蛋白的水解度普遍高于27%。图3c中可以看出,料液比与酶添加量的二维等高线变化趋势相类似,但二维图中等高线呈椭圆形,表明料液比对响应值影响的显著性略高于酶添加量。引起这种结果的原因是当料液比过低时,鸡蛋壳膜不易分散,易形成聚集体,壳膜与蛋白酶接触面积降低,酶解效率下降,水解度降低;而料液比过高时,对蛋白酶和壳膜起到稀释作用,使得两者接触几率下降,水解度稍微下降。因此,BBD试验结果表明,因素变化对响应值影响的显著性规律为酶解时间(A)>料液比(B)>酶添加量(C),这与表3中的试验数据相符。
2.3.3 最优条件确定及回归模型验证
在设定的取值范围内,以最大水解度为指标,对试验预期结果进行最优化拟合,选择各个因素的最佳取值为酶解时间 5.39 h,料液比 1∶9.43(g/mL),酶添加量2.38%,此时壳膜蛋白水解度为27.81%。依据现实试验可行性,将酶解条件调整为酶解时间5 h,料液比1∶9.5(g/mL),酶添加量 2.4%,在此条件下,重复进行6次验证试验,得到的平均水解度为27.15%。试验结果表明,通过BBD设计结果建立的二次多元回归模型可以很好的拟合现实试验结果,对试验结果具有较好的预测性。
2.4 鸡蛋壳膜多肽的分子量分布
在BBD优化后的最佳工艺条件下,通过高效凝胶色谱法对酶解后壳膜多肽中肽的相对分子质量大小及分布情况进行检测。肽分子量分布饼状图见图4。
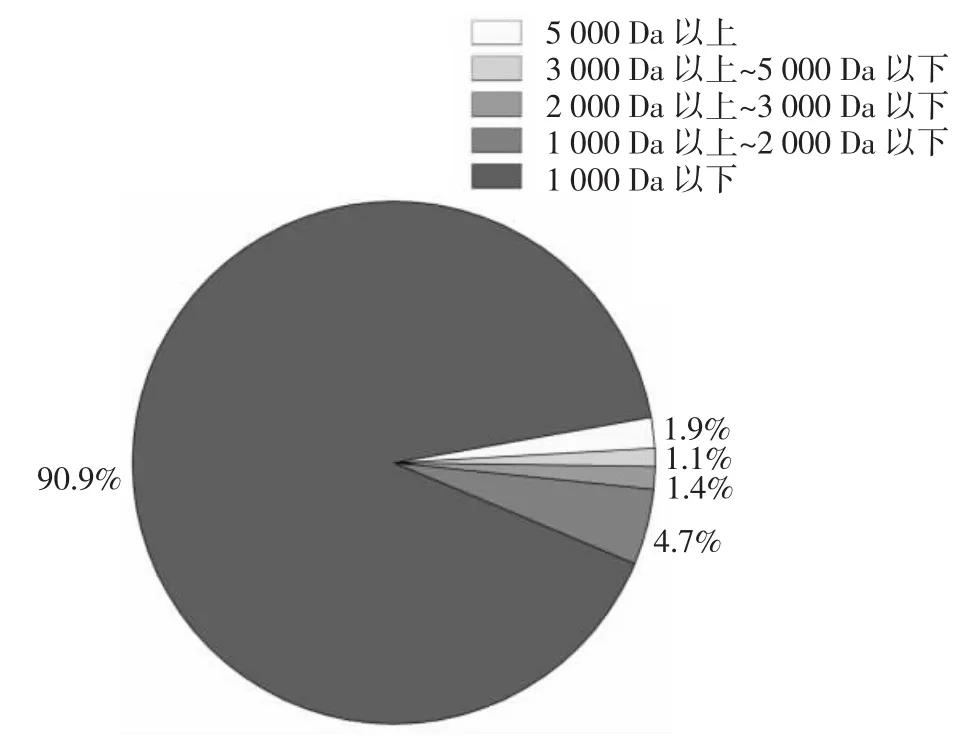
图4 肽分子量分布饼状图Fig.4 Molecular mass distribution of polypeptides in a pie chart
如图4所示,酶解后的鸡蛋壳膜多肽中分子量在5 000 Da以下的肽段占98.1%,其中小于1 000 Da的小分子肽占90.9%。该法得到的1 000 Da以下的分子肽所占比例较高,此类小分子肽更易被人体消化吸收,且具有大分子蛋白质所没有的一些物理化学特性,尤其是分子量较小的肽段,具有一定的抗氧化性[19-20],试验预期效果良好,可用于鸡蛋壳中壳膜蛋白的酶解。
2.5 鸡蛋壳膜多肽体外抗氧化结果
2.5.1 鸡蛋壳膜多肽对DPPH·清除能力
按照1.4.1试验方法进行试验,以鸡蛋壳膜多肽质量浓度为横坐标,以DPPH·清除率为纵坐标,鸡蛋壳膜多肽的DPPH·清除能力见图5。
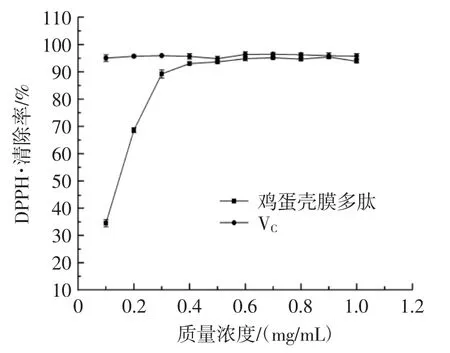
图5 鸡蛋壳膜多肽清除DPPH·的效果Fig.5 Effect of eggshell membrane in removing DPPH·
DPPH·是一种稳定的有机氮自由基,在乙醇溶液中显深紫色,能吸收抗氧化物的电子而引起样品颜色的改变,其褪色程度与接受电子数成正比[21]。VC是较好的抗氧化剂,将鸡蛋壳膜多肽的抗氧化能力与VC的抗氧化能力进行比较。由图5可知,鸡蛋壳膜多肽对DPPH·清除率弱于VC,但是随着质量浓度的增加,鸡蛋壳膜多肽对DPPH·清除率逐渐增大。当鸡蛋壳膜多肽质量浓度为0.4 mg/mL时,对DPPH·清除率为(93.03±0.51)%,同种质量浓度下VC的清除率为(95.63±0.97)%,与VC的效果相当。
2.5.2 鸡蛋壳膜多肽对ABTS+·清除能力
按照1.4.2试验方法进行试验,以鸡蛋壳膜多肽质量浓度为横坐标,以ABTS+·清除率为纵坐标,鸡蛋壳膜多肽的ABTS+·清除能力见图6。

图6 鸡蛋壳膜多肽清除ABTS+·的效果Fig.6 Effect of eggshell membrane in removing ABTS+·
ABTS经氧化后会生成蓝绿色ABTS+·,鸡蛋壳膜多肽可清除ABTS+·,从而使ABTS+·母液在一定程度褪色。由图6可看出,鸡蛋壳膜多肽和VC都有清除ABTS+·的能力,鸡蛋壳膜多肽对ABTS+·清除率弱于VC,但是随着质量浓度的增加,鸡蛋壳膜多肽对ABTS+·清除率逐渐增大。当鸡蛋壳膜多肽质量浓度为0.9 mg/mL 时,对 ABTS+·清除率为(94.53±0.92)%,同种质量浓度下VC的清除率为(98.50±0.70)%,与VC的效果相当。说明鸡蛋壳膜多肽也具有较好的清除ABTS+·的能力。
2.5.3 鸡蛋壳膜多肽对·OH清除能力
按照1.4.3试验方法进行试验,以鸡蛋壳膜多肽质量浓度为横坐标,以·OH清除率为纵坐标,鸡蛋壳膜多肽的·OH清除能力见图7。
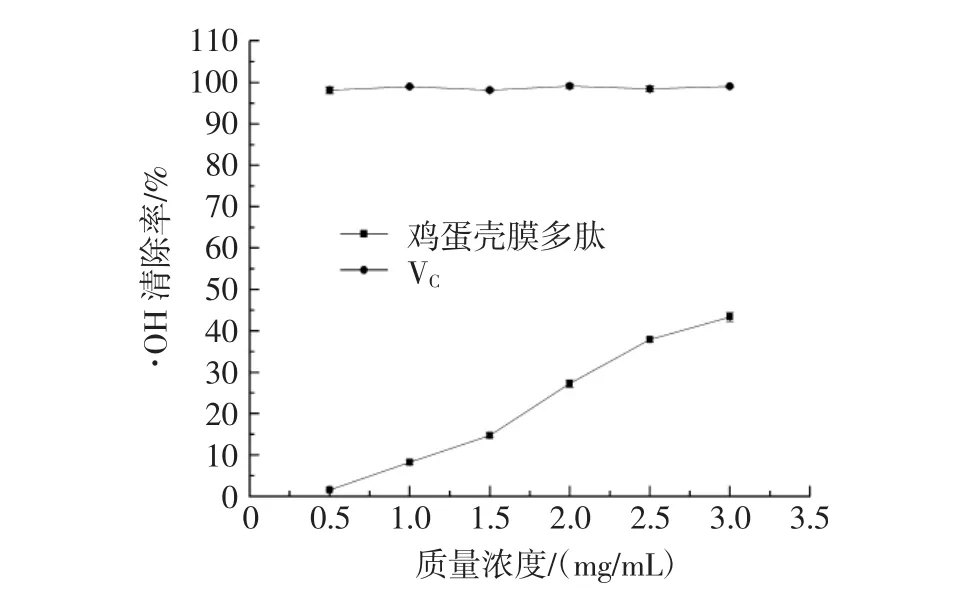
图7 鸡蛋壳膜多肽清除·OH的效果Fig.7 Effect of eggshell membrane in removing·OH
由图7可知,鸡蛋壳膜多肽和VC都有清除·OH的能力,鸡蛋壳膜多肽对·OH清除率较弱于VC,但是随着质量浓度的增加,鸡蛋壳膜多肽对·OH清除率逐渐增大。当鸡蛋壳膜多肽质量浓度为3.0 mg/mL时,对·OH清除率为(43.33±1.10)%,同种质量浓度下VC的清除率为(99.07±0.25)%,在相同质量浓度下,·OH清除率为VC的43.74%,较VC有一定差距。
按照1.4.4试验方法进行试验,以鸡蛋壳膜多肽质量浓度为横坐标,以清除率为纵坐标,鸡蛋壳膜多肽的清除能力见图8。
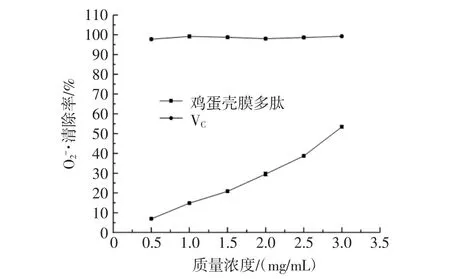
图8 鸡蛋壳膜多肽对清除能力Fig.8 Effect of eggshell membrane in removing
由图8可知,鸡蛋壳膜多肽和VC都有清除的能力,鸡蛋壳膜多肽对清除率较弱于VC,但是随着质量浓度的增加,鸡蛋壳膜多肽对清除率逐渐增大。当鸡蛋壳膜多肽质量浓度为3.0 mg/mL时,对清除率为(53.40±0.70)%,同种质量浓度下 VC的清除率为(99.20±0.44)%,在相同质量浓度下,清除率为VC的53.83%,较VC有一定差距。
2.5.5 碱性蛋白酶对ABTS+·清除能力
按照1.4.2试验方法进行试验,以碱性蛋白酶(AP-200a)质量浓度为横坐标,以ABTS+·清除率为纵坐标,碱性蛋白酶(AP-200a)对ABTS+·清除能力见图9。
由图 9可知,碱性蛋白酶(AP-200a)对 ABTS+·清除能力很弱,当浓度达到1.0 mg/mL时,对ABTS+·的清除率为(7.11±0.54)%,而鸡蛋壳膜多肽和VC的清除能力都接近100%。结果表明,鸡蛋壳膜冻干粉中虽然含有的少量酶,但是碱性蛋白酶(AP-200a)本身无明显抗氧化活性。因此,说明鸡蛋壳膜多肽具有很好的抗氧化活性。
3 结果与讨论
目前,对各种肽的研究越来越多,活性肽抗氧化活性的研究已取得一定成果,大豆低聚肽已被列为新资源产品。还有小麦肽、玉米肽等,也被大家所关注。而对蛋壳膜类研究较少,鸡蛋壳膜具有致密的纤维结构特点,不易被分解。本试验以水解度为指标,筛选出碱性蛋白酶(AP-200a)酶解效果最佳,通过单因素考察和响应面分析优化了鸡蛋壳膜的酶解工艺,确定采用酶添加量 2.4%,料液比 1∶9.5(g/mL),酶解时间 5 h,在此条件下,壳膜多肽水解度为27.15%,与预测值27.81%接近,表明该方法可行。水解后相对分子质量小于1 000 Da的小分子肽所占比例为90.9%;且壳膜多肽对DPPH·、ABTS+·的清除率分别为(93.03±0.51)%、(94.53±0.92)%,与 VC的效果相当;但对·OH 和 O2-的清除率分别为(43.33±1.10)%和(53.40±0.70)%。刘文颖等[22]测得大豆低聚肽的分子量小于1000Da的组分高达83.54%。有研究报道,分子量小的组分比分子量过大的组分抗氧化性更强[23]。杨珊珊等[24]发现,当浓度为4 mg/mL时,蛋清多肽对DPPH·清除率可达到65.7%。梁盈等[25]发现大米活性肽具有较好的抗氧化活性,对DPPH·和·OH的清除能力分别达46.70%、68.23%。还有研究发现,大豆低聚肽、小麦低聚肽、海洋生物小分子肽、洋葱多肽等都同样具有抗氧化效果[26-28]。但是大多研究中没有验证酶解液或是得到的肽粉中所含的蛋白酶是否具有抗氧化活性,本试验在做壳膜多肽对ABTS+·的清除能力的同时,验证了碱性蛋白酶(AP-200a)对ABTS+·的清除能力,结果表明,碱性蛋白酶(AP-200a)没有明显的抗氧化活性。因此,通过该方法酶解后的鸡蛋壳膜多肽具有一定抗氧化活性。
因此,试验以鸡蛋壳膜为原料,对其进行制备小分子肽的研究,得到了分子量组分较小的鸡蛋壳膜多肽,创新了鸡蛋壳膜酶解工艺的试验优化方法,并对其进行了一系列的体外抗氧化活性研究,研究结果表明鸡蛋壳膜多肽具有良好的抗氧化活性。同时,本研究为鸡蛋壳膜综合再利用、变废为宝提供了理论基础,既可以达到保护环境以及资源化利用的目的,也为今后的蛋类产品研究奠定了研究基础。

