清肠化湿方通过激活AhR/IL-22缓解小鼠溃疡性结肠炎的作用机制研究
屈芸,朱磊,王琼,王耀辉,胡静怡,连紫宇,吉跃进,周恩,沈洪
(南京中医药大学附属医院/江苏省中医院,江苏 南京 210029)
溃疡性结肠炎(Ulcerative colitis,UC)是一种慢性非特异性胃肠道炎性疾病,病程常超过6周,患者以腹泻、腹痛、黏液脓血便等为主[1]。近年来,其发病率逐年上升[2]。中医学无“溃疡性结肠炎”之说,参照其症状,将其归为古籍“久痢”“肠澼”“泄泻”之类[3]。治疗时,西医多用传统药物(5-氨基水杨酸类药物、糖皮质激素、免疫抑制剂)、生物制剂、营养支持治疗与外科手术治疗等[4],中医常用多种方式联合治疗,包括口服中药、灌肠、针灸等。UC病机总属本虚标实,沈洪教授认为UC活动期患者病机当属湿热之邪壅滞肠膜,损伤肠络,导致气血失调,其结合多年临证经验及现代研究,针对湿热病机,运用清肠化湿方治疗UC疗效可靠[5]。本方由白头翁、白芍、黄芩、地榆、白芷等药物组成,共奏清热除湿、凉血止痢之效。
芳香烃受体(Aryl hydrocarbon receptor,AhR)属于螺旋-环-螺旋超家族,多以未活化的方式广泛表达于多种细胞的胞浆中,一旦被特应性的配体激活,AhR便进入细胞核并与AhR核转位子结合形成二聚体,启动一系列下游目的基因的表达。AhR可以促进Th17细胞和3型先天淋巴细胞(ILC3)产生白介素(IL)-22,并对其有重要的调节作用[6]。此外,肠道微生物还可以通过影响AhR配体来调节IL-22的产生。IL-22可以由不同的细胞产生,比如活化的T细胞、NK细胞等,而在肠道中,ILC3是IL-22的主要来源[7]。ILC3主要通过分泌细胞因子调节炎症,其功能的维持与AhR的活性密切相关[8]。IL-10和IL-22有共同的β链IL-10Rβ,负责信号传递[9]。肠道微生物产生的部分代谢产物能够结合并激活AhR,被激活的AhR可诱导下游细胞因子IL-22的表达,从而调节肠道内环境的稳态。
前期研究表明清肠化湿方能够减轻UC小鼠炎症免疫反应,影响Th17分化,促进IL-10分泌,诱导肠干细胞再生[10]。但本方是否通过影响AhR及肠道黏膜屏障,进而影响IL-22分泌及黏蛋白(MUC-2)与紧密连接蛋白(Claudin4)的表达尚未明确,因此本研究旨在探讨本方的相关作用机制,并为未来的科学研究提供理论支撑。
1 材料与方法
1.1 动物
48只雄性SPF级6~8周龄C57BL/6小鼠,体质量20~22 g,购自浙江维通利华实验动物技术有限公司。动物许可证号:SCXK(浙)2019-0001。在南京中医药大学实验动物中心动物房饲养。小鼠适应环境1周(每日自由进食饮水),温度24~25 ℃,湿度50%~60%,每日12 h光照,12 h避光。
1.2 药物与试剂
清肠化湿方(白头翁15 g,白芍15 g,黄芩10 g,白芷10 g,地榆15 g,黄芪15 g)中药购自江苏省中医院药房。经南京市药品检验所质量检验,鉴定为合格中药饮片。称取清肠化湿方生药,用1 200 mL蒸馏水浸泡60 min,煎煮60 min,滤过收集煎煮液;剩余药渣用1 200 mL蒸馏水,二次煎煮60 min,滤过收集煎煮液。合并2次药液,4 ℃ 4 000×g离心10 min,取上清,浓缩成12 g·kg-1水煎剂。DSS(分子量:36 000~50 000 kDa,美国MP Biomedicals公司,货号:0216011050);美沙拉嗪肠溶片(佳木斯鹿灵制药有限公司,货号:190311),经研磨配成0.3 g·mL-1混悬液;AhR拮抗剂6,2',4'-Trimethoxyflavone(TMF,Sigma公司,货号:T4080),浓度配成5 mg·kg-1;抗体MUC-2(ab272692)、AhR(sc-133088)、细胞色素P450 1A1(CYP1A1)(sc-25304)、IL-22(ABP57408)、Claudin4(ab15104)、β-actin(sc-47778);TrizolTMReagent RNA提取剂(Ambion公司,货号:15596026);HiScriptⅡ QRT SuperMix for qPCR,ChamQ UNiversal SYBR qPCR Master Mix(Vazyme公司,货号:R223-01,Q711-02/03);PCR引物(Invitrogen公司,货号:HG1910090009);MDF-38超低温冰箱(日本三洋公司);7500 fast荧光定量PCR仪(美国ABI公司);PowerPac Basic电泳仪,Mini PROTEAN Tetra Cell电泳槽(美国Bio-Rad公司);Mini PROTEAN Tetra Cell转膜槽(美国Bio-Rad公司);CHEMIDOC XRS+凝胶成像仪(美国Bio-Rad公司);CKX41倒置相差显微镜(日本Olympus公司);5804R超速离心机(德国Eppendorf公司);ELX-800酶标仪(美国BioTek公司)。
1.3 分组及模型制备
48只小鼠随机分为正常组(Ctrl)、模型组(DSS)、美沙拉嗪组(5-ASA)、清肠化湿方组(QCHS),清肠化湿方+TMF组(QCHS+TMF)、TMF组(TMF)。每组8只。除正常组外,小鼠均饮用含2.5% DSS蒸馏水1周造成UC模型。美沙拉嗪组给予0.3 g·kg-1美沙拉嗪溶液灌胃,清肠化湿方组按照12 g·kg-1中药灌胃。清肠化湿方+TMF组按照12 g·kg-1中药灌胃+5 mg·kg-1TMF腹腔注射,TMF组按照5 mg·kg-1TMF腹腔注射,其余组给予0.9%生理盐水腹腔注射。灌胃及腹腔注射共10 d,于第11天处死小鼠。
1.4 取材
取材时,收集小鼠血清、结肠、结肠内容物。具体取材方法如下:用镊子摘取小鼠眼球,取血至离心机按照3 000 r·min-1离心10 min后,收集上层血清,保存于-80 ℃。采用颈椎脱臼法处死小鼠,75%乙醇浸润小鼠,沿腹中线剪开腹部皮肤、腹肌、腹膜,暴露腹腔。分离回肠、结肠,置于冰板上,去除结肠表面脂肪组织,测量长度并拍照,取回肠于1.5 mL EP管,-80 ℃保存;纵剖结肠,取出结肠内容物置于1.5 mL EP管中,-80 ℃保存。将纵剖后的结肠用预冷的PBS冲洗干净,在滤纸上吸干。取末端1 cm处的组织放入4%多聚甲醛中固定,剩余组织-80 ℃保存。
1.5 检测指标及方法
1.5.1 一般情况、疾病活动指数(Disease activity index,DAI)及结肠长度变化 每天观察小鼠毛色、尿液颜色、精神状态等一般情况,记录小鼠体质量、粪便质地及便血情况,对小鼠进行DAI评分[11],具体评分见表1。

表1 DAI评分标准
注:DAI=(体质量下降率评分+大便性状评分+便血情况评分)/3。正常大便:成形便;松散大便:糊状、半成形便,不黏附于肛门;稀便:稀水样便,可黏附于肛门。
1.5.2 结肠病理切片观察 将4%多聚甲醛中固定的组织进行常规石蜡包埋,切片厚度为4~5 μm,进行常规HE染色,在光镜下观察并拍照。
1.5.3 Western blot检测小鼠结肠组织MUC-2、AhR、CYP1A1、IL-22、Claudin4蛋白水平 取出-80 ℃保存的结肠组织100 mg,使用RIPA缓冲液与蛋白酶抑制剂混合,离心匀浆,用BCA蛋白检测试剂盒测定蛋白质浓度并计算出上样量。取蛋白样品在80 V,30 min,120 V,60 min条件下进行SDS-PAGE分析。转膜时,恒流300 mA,90 min。转膜后,用5%脱脂牛奶进行封闭60 min。洗膜后将膜与抗体放在4 ℃下过夜,次日用TBST 10 min洗膜3次,常温二抗孵育60 min,再用TBST 10 min洗膜3次。用增强化学发光(ECL)检测。用Image Lab软件分析化学发光信号。收集数据并从3个独立样本中分析。
1.5.4 qPCR检测结肠组织IL-1β、TNF-α、IL-6、AhR的mRNA水平 取小鼠结肠组织于1 mL Trizol中充分裂解后,进行氯仿萃取及异丙醇沉淀,75%乙醇洗涤,溶于20 μL DEPC水中。测量RNA浓度及纯度合格后,按照逆转录试剂盒说明书进行逆转录,得到cDNA,再以cDNA为模板进行扩增目的基因。反应体系为10 μL:SYBR qPCR Premix Ex Taq 5 μL,上下引物各0.2 μL,DEPC水3.6 μL,DNA 1 μL。设置反应条件:预变性(95 ℃,30 s)循环1次;扩增(95 ℃,10 s;60 ℃,30 s),循环40次;溶解曲线(95 ℃,15 s;60 ℃,60 s;95 ℃,10 s):循环1次。引物由Invitrogen公司合成,核苷酸序列见表2。采用2-△△Ct方法对qPCR结果进行数据分析。

表2 qPCR引物序列
1.6 统计学方法
2 结果
2.1 各组小鼠一般情况
正常组小鼠毛色正常,行动灵敏,饮食、粪便正常。模型组小鼠给2.5%DSS后出现进食量显著降低,明显肉眼血便,肛门口有血便附着,体质量下降;美沙拉嗪组、清肠化湿方组灌胃后,毛色、活动状态、血便呈好转状态。清肠化湿方+TMF组、TMF组小鼠毛发光泽下降,进食量降低,见到肉眼血便,体质量下降。各组小鼠体质量变化见图1,结肠形态见图2。

注:与Ctrl组相比,**P<0.01;与DSS组相比,##P<0.01;与QCHS组相比,图1 各组小鼠的体质量变化

图2 各组小鼠的结肠外观
2.2 各组小鼠结肠长度及DAI评分
与正常组比较,模型组小鼠结肠长度缩短(P<0.01),DAI评分升高(P<0.01)。与模型组比较,美沙拉嗪组、清肠化湿方组小鼠结肠长度增加(P<0.01),DAI评分降低(P<0.01)。与清肠化湿方组比较,清肠化湿方+TMF组小鼠结肠长度缩短(P<0.05),DAI评分升高(P<0.01)。见表3。
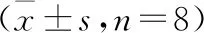
表3 各组小鼠DAI评分和结肠长度比较
注:与Ctrl组相比,**P<0.01;与DSS组相比,##P<0.01;与QCHS组相比,△△P<0.01。
2.3 各组小鼠结肠组织病理情况
正常组小鼠结肠组织结构完整清晰,杯状细胞及隐窝结构未有破坏;模型组可见溃疡形成,未见隐窝,黏膜糜烂。美沙拉嗪组及清肠化湿方组较模型组溃疡、黏膜损伤情况均明显减轻;清肠化湿方+TMF组及TMF组可见溃疡,腺体数量下降,大量炎细胞浸润。见图3。

图3 各组小鼠结肠组织病理状况(HE,×100)
2.4 各组小鼠结肠组织IL-1β、TNF-α、IL-6、AhR的mRNA水平
与正常组比较,模型组小鼠IL-1β、TNF-α、IL-6的mRNA表达上升(P<0.05,P<0.01),AhR的mRNA表达下降(P<0.05)。与模型组比较,美沙拉嗪组、清肠化湿方组IL-1β、TNF-α、IL-6的mRNA表达下降(P<0.05,P<0.01),清肠化湿方组AhR的mRNA表达上升(P<0.05)。与清肠化湿方组比较,清肠化湿方+TMF组小鼠IL-1β、TNF-α、IL-6的mRNA表达上升(P<0.01)。见图4。
注:与Ctrl组相比,*P<0.05,**P<0.01;与DSS组相比,#P<0.05,##P<0.01;与QCHS组相比,图4 各组小鼠IL-1β、TNF-α、IL-6、AhR的mRNA表达比较
2.5 各组小鼠结肠组织MUC-2、AhR、CYP1A1、IL-22、Claudin4蛋白表达
与正常组比较,模型组结肠组织中MUC-2、AhR、CYP1A1、IL-22、Claudin4蛋白表达下降(P<0.05,P<0.01);与模型组比较,美沙拉嗪组、清肠化湿方组MUC-2、CYP1A1、Claudin4蛋白表达升高(P<0.01);与模型组比较,清肠化湿方组AhR、IL-22蛋白表达升高(P<0.01)。与清肠化湿方组比较,清肠化湿方+TMF组小鼠MUC-2、AhR、CYP1A1、IL-22、Claudin4蛋白表达下降(P<0.01)。见图5。

注:与Ctrl组相比,*P<0.05,**P<0.01;与DSS组相比,##P<0.01;与QCHS组相比,图5 各组小鼠结肠组织中MUC-2、AhR、CYP1A1、IL-22、Claudin4蛋白水平
3 讨论
UC作为临床疑难病之一,发病率在我国迅速上升。从中医角度分析,其病机责之湿热二邪,湿热蕴结脉络,日久入于血分,以致肠道受损,传导失责,最终出现腹痛、腹泻、黏液血便等症状。本方中白头翁、黄芩可清肠化湿解毒,祛除湿热之邪,以除病因之本;白芍柔肝健脾,同调肝脾;地榆清热为主,亦可止血,以防出血之弊,白芷止痛为先,亦可燥湿;加以生黄芪扶正御邪、调节免疫,盖因黄芪尤擅补益脾肺之气,培补土气则气血生化有源,充盈肺气则固表御邪有力。
免疫因素是UC的关键发病机制之一[12]。AhR是一种转录因子[13],在免疫细胞中高度表达,可以介导一系列反应[14]。AhR可以促进Th17细胞和ILC3产生IL-22[15]。IL-22作为IL-10家族成员之一,在炎症性肠病(IBD)患者中,其分泌和功能调控可以推动细胞再生、防御、组织重构。IL-22的多种下游机制参与介导先天免疫、获得性免疫和组织稳态的调节。
CYP1A1是一种参与多种药物代谢的Ⅰ相酶,是AhR的下游靶基因[16]。它受经典的AhR信号通路控制[17]。激活的AhR通过维持肠道干细胞稳态和屏障完整性来调节肠道内环境平衡[18]。研究表明IBD患者的肠道组织中,AhR的表达受到明显抑制,UC模型小鼠在使用AhR激动剂后,其炎症得到显著缓解[19-20]。AhR在肠道中广泛表达,其激活与UC的转归有关[21]。UC患者体内AhR的表达下调。研究表明,在UC模型小鼠中,AhR的活化受到抑制,表达下降,说明AhR在肠道炎症中起到重要的作用[22]。活化的AhR可以促进IL-22的产生,并对其有重要的调节作用,从而抑制炎症[23]。
肠黏膜屏障由抗菌因子和黏液支撑,可以阻止微生物破坏免疫系统[24-25]。UC患者的上皮功能和黏膜屏障受到破坏[26],杯状细胞分泌的黏液组分减少,肠道渗透性增加,导致肠道微生物群的破坏[27]。黏蛋白是一种高度糖基化的O-糖蛋白,由分泌上皮细胞产生,在肠道内起到抵御病原体、有害物质的屏障作用。其中MUC-2是结肠中黏蛋白的主要成分,在UC患者中,MUC-2的分泌减少,因此恢复MUC-2水平可以改善UC[28]。有报道表明,UC会导致紧密连接蛋白水平显著下调,肠道对微生物配体和有害代谢物的通透性显著增加,从而导致全身炎症反应,因此恢复肠道屏障的完整性对UC患者极为重要[29]。
课题组前期研究结果显示清肠化湿方组小鼠的色氨酸代谢增加,色氨酸可以代谢产生内源性AhR配体,从而维持肠道内环境的稳定和正常的新陈代谢。肠道内的大肠杆菌、变形杆菌、芽孢杆菌等都能将色氨酸代谢成吲哚及吲哚酸衍生物,它们是AhR的微生物配体,具有抗炎活性,促进AhR活化及IL-22释放,从而维持肠道内环境的稳定。
目前IL-22已成为UC药物研发的关键靶点之一,本研究紧密结合疾病发病机制,围绕免疫与肠黏膜屏障进行研究。实验结果表明清肠化湿方可以改善UC模型小鼠的肠道损伤,促进UC的恢复。其机制可能通过激活AhR,上调CYP1A1蛋白,促进IL-22生成,抑制炎症水平,同时增加MUC-2及Claudin4的表达,修复肠黏膜屏障,从而缓解UC,并为临床实践提供实验依据。

