五味子鲜果采后“杀青”加工对其药材品质的影响
刘磊 马伟 吴修红 杨大宇 张晓燕 牛露露 张淑香

中圖分类号 R282.4 文献标志码 A 文章编号 1001-0408(2021)21-2599-06
DOI 10.6039/j.issn.1001-0408.2021.21.07
摘 要 目的:研究五味子鲜果采后“杀青”加工对其药材品质的影响,为中药材产地加工的科学化、合理化提供新思路。方法:以15份五味子鲜果为样品,每3份为一组,分别采用50 ℃烘干、晒干、微波“杀青”后50 ℃烘干、烫漂“杀青”后50 ℃烘干、蒸制“杀青”后50 ℃烘干等5种方法进行初加工。借助《中药色谱指纹图谱相似度评价系统》(2012版)建立15份五味子干燥品的高效液相色谱(HPLC)指纹图谱并进行相似度评价;通过聚类分析评价不同加工方法所得五味子干燥品的相似性。同时,采用HPLC法测定各干燥品中五味子醇甲、五味子醇乙、五味子酯甲、五味子酯乙、五味子甲素、五味子乙素和五味子丙素等7种木脂素类成分的含量变化。结果:15份五味子干燥品的指纹图谱中共得到7个共有峰,除晒干样品色谱图与对照指纹图谱的相似度相对较低外,其他加工方法所得干燥品的色谱图的相似度均大于0.900。聚类分析结果显示,五味子微波“杀青”后50 ℃烘干和烫漂“杀青”后50 ℃烘干的6份样品聚为第1类;蒸制“杀青”后50 ℃烘干的3份样品聚为第2类;50 ℃烘干和晒干的6份样品聚为第3类。含量测定结果显示,50 ℃烘干和晒干样品中7种木脂素成分的总含量差异无统计学意义(P>0.05);微波、烫漂和蒸制“杀青”后再50 ℃烘干的样品中7种木脂素成分的总含量均显著高于50 ℃烘干和晒干样品(P<0.01)。结论:先采用烫漂、微波等方法“杀青”后再干燥处理的五味子样品的品质要优于直接晒干和烘干的样品。
关键词 五味子;采后加工;杀青;高效液相色谱指纹图谱;木脂素类
ABSTRACT OBJECTIVE: To study the effects of “green removing” processing technology of fresh fruit of Schisandra chinensis after harvested on the quality of medicinal material, and to provide new ideas for the scientific and rational processing of Chinese medicinal material. METHODS: Fifteen fresh fruits of S. chinensis were used as samples, with 3 samples in each group. The sample were processed preliminarily by 5 methods, such as drying at 50 ℃, drying in the sun, drying at 50 ℃ after “green removing” processing with microwave, drying at 50 ℃ after “green removing” processing with blanching, drying at 50 ℃ after “green removing” processing with steaming. HPLC fingerprints of 15 batches of dried S. chinensis products were established and similarity evaluation was conducted according to Similarity Evaluation System of TCM Chromatographic Fingerprints (2012 edition). Cluster analysis was used to evaluate the similarity of dried S. chinensis products with different processing methods. At the same time, HPLC method was adopted to determine the content changes of seven lignans in dried products, such as schisandrol A, schisandrol B, schisantherin A, schisantherin B, schizandrin A, schisandrin B and schisandrin C. RESULTS: A total of 7 common peaks were obtained in the fingerprints of 15 batches of dried S. chinensis products. Except that the similarity between the chromatograms of dried samples in the sun and the control fingerprint was relatively low, the similarities of chromatograms of dried products by other processing methods were greater than 0.900. Cluster analysis showed that 6 samples dried at 50 ℃ after “green removing” processing with microwave and dried at 50 ℃ after “green removing” processing with blanching were grouped into the first category; 3 samples dried at 50 ℃ after “green removing” processing with steaming were grouped into the second category; 6 samples dried at 50 ℃ and dried in sun were grouped into the third category. The content determination results showed that there was no significant difference in the total content of seven lignans in the samples dried at 50 ℃ and dried in the sun (P>0.05). The total contents of seven lignans in the samples dried at 50 ℃ after “green moving” processing with microwave, blanching and steaming were significantly higher than those dried at 50 ℃ and dried in sun (P<0.01). CONCLUSIONS: The quality of S. chinensis samples dried after “green moving” processing with microwave and blanching is better than those directly dried in sun and dried in oven.
KEYWORDS Schisandra chinensis; Processing after harvested; HPLC fingerprint; Lignans
五味子为木兰科植物五味子Schisandra chinensis(Turcz.)Baill.的干燥成熟果实[1],是东北的道地药材。现代研究表明,五味子中以木脂素类、多糖类、挥发油类、有机酸类等化学成分为主,其中木脂素类化学成分为其重要的药理活性成分之一[2]。五味子属于浆果,为了便于贮藏和运输,五味子鲜果采摘后的干制是必不可少的一道初加工工序。五味子鲜果采摘后果实细胞仍会进行活跃的新陈代谢,这种现象称为“采后生理”,表现为未成熟的果实可以继续成熟、已成熟的果实会老化腐烂[3]。由于果实在采摘后光合作用基本停止,呼吸成为新陈代谢的主要过程,因此果实细胞会继续通过呼吸作用消耗有机物质,为生命活动提供能量[4]。“杀青”是指通过一定的方法和条件将采收获得的生物体或组织器官中相关酶系等灭活。对中药材采用适宜的工艺和技术方法进行“杀青”,破坏鲜活药材中的酶活性,有利于保留其功效物质和保持其良好品质,对药材品质的形成具有重要影响[5]。
五味子的传统干燥方法主要为自然晾晒、烘干或者晒烘结合,干燥周期较长,而干燥周期内果实细胞中的代谢酶会继续消耗内含物质,为其生命活动提供能量[4]。本课题组前期将五味子鲜果先进行微波“杀青”处理后再进行干燥,所得干燥品中五味子醇甲的含量明显高于传统晒干品,这提示五味子鲜果经“杀青”处理后可能有利于其木脂素类活性成分的保留,进而影响药材品质的形成。鉴于此,本研究拟采用高效液相色谱(HPLC)指纹图谱、聚类分析等方法,并结合五味子中主要的7种木脂素类成分(五味子醇甲、五味子醇乙、五味子酯甲、五味子酯乙、五味子甲素、五味子乙素和五味子丙素)的含量变化,考察五味子鲜果采后“杀青”加工对其品质的影响,为中药材产地加工的科学化、合理化提供新思路。
1 材料
1.1 主要仪器
本研究所用主要仪器有Thermo Ultimate 3000型HPLC仪(美国Thermo Fisher Scientific公司),FA2004型分析天平(上海津平科学仪器有限公司),Benchtop Pro 3L ES-55型冻干机(美国SP Scientific公司),M1-L202B型微波炉(广州美的厨房电器制造有限公司),GZX-9070MBE型电热鼓风干燥箱、XMTD-204型电热恒温水浴锅(上海博讯实业有限公司医疗设备厂),SFY-001型卤素水分测定仪(上海花潮实业有限公司)等。
1.2 主要药品与试剂
五味子鲜果于2018年9月20号采摘自黑龙江省通河县清河林业局红太阳五味子种植基地,经黑龙江中医药大学药学院吴修红教授鉴定为木兰科植物五味子S.chinensis (Turcz.) Baill.的成熟果实。五味子醇甲对照品(批号110857-201815,纯度99.7%)、五味子酯甲对照品(批号111529-201706,纯度95.2%)、五味子甲素对照品(批号110764-201915,纯度99.5%)、五味子乙素对照品(批号110765-201813,纯度99.1%)均购自中国食品药品检定研究院;五味子醇乙对照品(批号B21323,纯度≥98%)、五味子酯乙对照品(批号B21330,纯度≥98%)、五味子丙素对照品(批号B21321,纯度≥98%)均购自上海源叶生物科技有限公司;乙腈为色谱纯,其余试剂均为分析纯,水为屈臣氏饮用水。
2 方法与结果
2.1 五味子干燥品的制備
将采收的五味子鲜果分成15份,每份约200 g,每3份样品为一组,每组的鲜果采用同一种加工方式。分别采用50 ℃烘干、晒干、微波“杀青”后50 ℃烘干、烫漂“杀青”后50 ℃烘干、蒸制“杀青”后50 ℃烘干等5种方法对五味子鲜果进行初加工(所得样品的编号为S1~S15),具体制备方法见表1。加工过程中每间隔一定时间称取样品2 g,采用卤素水分测定仪测定样品中的水分含量。因2020年版《中国药典》(一部)五味子项下规定,五味子药材及其饮片的水分含量均不得高于16%[1],因此本研究选择各组样品均在干燥至其中水分含量约10%时即停止。
2.2 溶液的制备
2.2.1 混合对照品溶液的制备 精密称取五味子醇甲、五味子醇乙、五味子酯甲、五味子酯乙、五味子甲素、五味子乙素和五味子丙素对照品各约10 mg,分别置于不同5 mL量瓶中,用甲醇溶解并制备成上述对照品质量浓度分别为1.90、1.96、1.09、1.94、1.96、1.92、2.02 mg/mL的各单一对照品贮备液,备用。精密吸取上述7种单一对照品贮备液适量,置于同一10 mL量瓶中,加甲醇定容,摇匀,制成上述成分质量浓度分别为0.095、0.098、0.109、0.097、0.098、0.096、0.101 mg/mL的混合对照品溶液,备用。
2.2.2 供试品溶液的制备 取15份五味子干燥品粉末(过三号筛,下同)约5 g,精密称定,置于250 mL圆底烧瓶中,分别加85%乙醇100 mL加热回流提取3次,每次分别提取3、2、1 h;收集合并3次提取液的滤液,然后水浴蒸干溶剂,再将其转移至60 ℃烘箱中烘干,然后用甲醇溶解并定容至25 mL,以微孔滤膜(0.45 μm)滤过,即得[6]。
2.3 色谱条件
在文献[2,7]的基础上设置本研究的色谱条件。以Diamonsil C18为色谱柱(250 mm×4.6 mm,5 μm),以乙腈(A)-水(B)为流动相进行梯度洗脱(0~10 min,38%A→44A%;10~18 min,44%A→45%A;18~28 min,45%A→48%A;28~35 min,48%A→60%A;35~37 min,60%A→47%A;37~65 min,47%A→48%A;65~67 min,48%A→60%A;67~76 min,60%A→61%A;76~78 min,61%A→85%A;78~95 min,85%A→98%A;95~105 min,98%A);柱温为30 ℃,流速为1.0 mL/min;检测波长为217 nm;进样量为10 μL。
2.4 HPLC指纹图谱的建立及分析
2.4.1 精密度试验 取同一供试品溶液(样品编号为S1),按“2.3”项下色谱条件连续进样测定6次,记录峰面积。以1号峰(五味子醇甲)为参照峰,计算得各共有峰相对保留时间和相对峰面积的RSD均小于3%(n=6),表明仪器精密度良好。
2.4.2 重复性试验 取同一五味子干燥品(样品编号为S1)粉末6份,每份约5 g,精密称定,分别按“2.2.2”项下方法制备供试品溶液,然后按“2.3”项下色谱条件进样测定,记录峰面积。以1号峰(五味子醇甲)为参照峰,计算得各共有峰相对保留时间和相对峰面积的RSD均小于3%(n=6),表明本方法的重复性较好。
2.4.3 稳定性试验 取同一供试品溶液(样品编号为S1),分别于室温下放置0、4、8、12、18、24 h时按“2.3”项下条件进样测定,记录峰面积。以1号峰(五味子醇甲)为参照峰,计算得各共有峰相对保留时间和相对峰面积的RSD均小于3%(n=6),表明该供试品溶液在室温下放置24 h内稳定性良好。
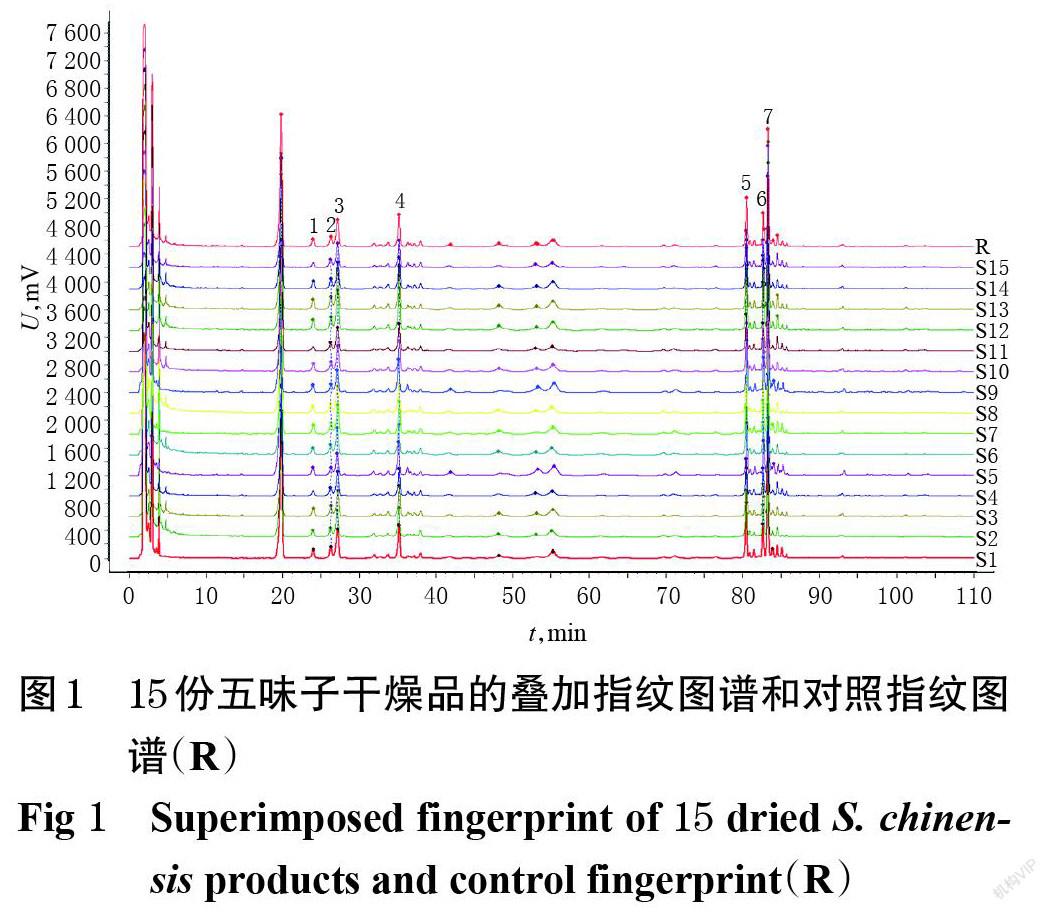
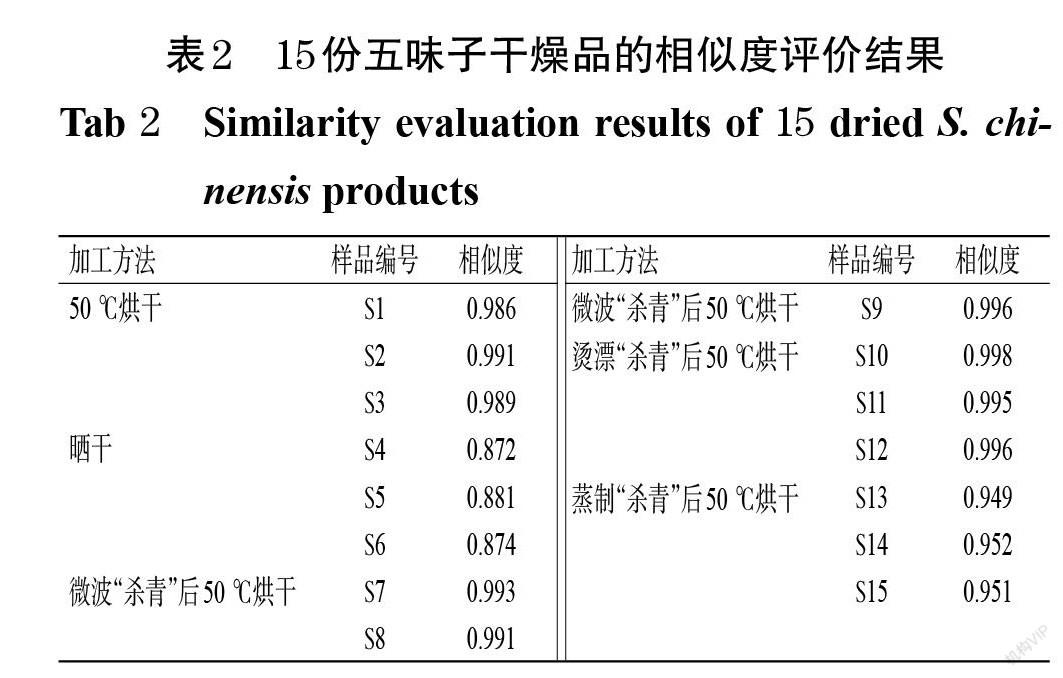
2.4.4 指纹图谱的生成及相似度评价 取“2.1”项下15份五味子干燥品各适量,分别按“2.2.2”项下方法制备供试品溶液后,按“2.3”项下色谱条件进样测定,记录色谱图。将15份五味子干燥品的色谱图分别导入《中药色谱指纹图谱相似度评价系统》(2012版)中,设置时间窗宽度为0.1 min,通过多点校正和色谱峰匹配生成样品叠加指纹图谱,采用中位数法生成对照指纹图谱(R),并以对照指纹图谱为参照对各样品的图谱进行相似度评价。结果显示,15份五味子干燥品共得到7个共有峰。相似度评价结果显示,除晒干品(S4~S6)外,其余各样品与对照指纹图谱的相似度均在0.900以上。这表明,不同加工方法对五味子药材的化学成分谱产生了一定的影响,尤其是晒干样品与其他方法加工样品的成分差异相对较大。15份五味子干燥品的叠加指纹图谱和对照指纹图谱(R)见图1,相似度评价结果见表2。
2.4.5 聚类分析 将15份五味子干燥品的7个共有峰峰面积除以称样量所得比值导入SPSS 23.0软件中,将测量度设置成平方欧氏距离,采用组间连接聚类分析法进行聚类分析,得到聚类分析树状图(图2)。结果显示,当平方欧氏距离为10时,15份五味子干燥品可被聚为3类:第1类包括S7~S12,即微波“杀青”后50 ℃烘干和烫漂“杀青”后50 ℃烘干的6个样品;第2类包括S13~S15,即蒸制“杀青”后50 ℃烘干的3个样品;第3类包括S1~S6,即晒干和50 ℃烘干的6个样品。
2.5 五味子干燥品中7种木脂素类成分的含量测定
2.5.1 线性关系考察 精密吸取“2.2.1”项下各单一对照品贮备液适量,置于同一10 mL量瓶中,加甲醇定容,制成五味子醇甲质量浓度分别为0.380 0、0.570 0、0.760 0、0.950 0、1.140 0 mg/mL,五味子醇乙质量浓度分别为0.076 0、0.114 0、0.190 0、0.228 0、0.266 0 mg/mL,五味子酯甲质量浓度分别为0.021 8、0.065 4、0.109 0、0.152 6、0.196 2 mg/mL,五味子酯乙质量浓度分别为0.038 8、0.097 0、0.155 2、0.213 4、0.271 6 mg/mL,五味子甲素质量浓度分别为0.078 4、0.117 6、0.196 0、0.235 2、0.274 4 mg/mL,五味子乙素质量浓度分别为0.076 8、0.153 6、0.230 4、0.307 2、0.384 0 mg/mL,五味子丙素质量浓度分别为0.121 2、0.202 0、0.282 8、0.363 6、0.444 4 mg/mL的系列混合對照品线性工作液。取上述线性工作液,分别按“2.3”项下色谱条件进样测定,记录峰面积。以各待测成分的进样量为横坐标(x,μg)、峰面积为纵坐标(y)进行线性回归。结果显示,各待测成分在其进样量范围内均与其对应峰面积呈良好的线性关系(r均大于0.999 0),详见表3。
2.5.2 精密度试验 取“2.2.1”项下混合对照品溶液,按“2.3”项下色谱条件连续进样测定5次,记录峰面积。结果显示,五味子醇甲、五味子醇乙、五味子酯甲、五味子酯乙、五味子甲素、五味子乙素、五味子丙素峰面积的RSD分别为0.98%、1.12%、1.36%、1.34%、1.28%、1.01%、1.89%(n=5),均小于2.00%,表明仪器精密度良好。
2.5.3 重复性试验 精密称取五味子干燥品粉末(样品编号为S1)6份,每份5 g,分别按“2.2.2”项下方法制备供试品溶液,然后按“2.3”项下色谱条件进样测定,记录峰面积并根据“2.5.1”项下标准曲线计算各成分的含量。结果显示,五味子醇甲、五味子醇乙、五味子酯甲、五味子酯乙、五味子甲素、五味子乙素、五味子丙素含量的RSD分别为0.91%、0.86%、1.77%、1.37%、0.99%、1.62%、1.83%(n=6),均小于2.00%,表明该方法的重复性较好。
2.5.4 稳定性试验 取供试品溶液(样品编号为S1)适量,分别于室温下放置0、4、8、12、16、20、24 h时按“2.3”项下色谱条件进样测定,记录峰面积。结果显示,五味子醇甲、五味子醇乙、五味子酯甲、五味子酯乙、五味子甲素、五味子乙素、五味子丙素峰面积的RSD分别为0.68%、0.84%、2.06%、1.43%、1.22%、1.71%、1.60%(n=7),表明该供试品溶液在室温下放置24 h稳定性良好。
2.5.5 加样回收率试验 精密称定已知含量的五味子干燥品粉末(样品编号为S7)1 g,共6份,分别按约1 ∶ 1(m/m)精密加入各对照品(加入按“2.2.1”项下方法制备的单一对照品溶液),按“2.2.2”项下方法制备供试品溶液,然后按“2.3”项下色谱条件进样测定,记录峰面积并计算加样回收率。结果显示,五味子醇甲、五味子醇乙、五味子酯甲、五味子酯乙、五味子甲素、五味子乙素、五味子丙素的平均加样回收率分别为99.41%、101.28%、100.72%、100.40%、100.22%、100.26%、101.42%,RSD分别为0.63%、1.40%、2.02%、1.40%、2.23%、1.83%、2.25%(n=6),表明本方法的准确度较好,详见表4。
2.5.6 含量测定 分别取15份五味子干燥品粉末(过三号筛)各约5 g,精密称定,每个样品平行称定3份。各样品分别按“2.2.2”项下方法制备供试品溶液,然后按“2.3”项下色谱条件进样测定,记录峰面积,根据“2.5.1”项下标准曲线计算7种木脂素类成分的含量及其总和。采用GraphPad Prism 8.0软件进行统计分析,多组间比较采用单因素方差分析,组间两两比较采用Dunnet检验,检验水准α=0.05。结果显示,五味子50 ℃烘干和晒干样品中7种木脂素成分的总含量差异无统计学意义(P>0.05);微波“杀青”后50 ℃烘干、烫漂“杀青”后50 ℃烘干和蒸制“杀青”后50 ℃烘干样品中7种木脂素类成分的总含量均显著高于50 ℃烘干和晒干样品(P<0.01)。不同干燥方法所得五味子样品中7种木脂素类成分的含量测定结果见表5。
3 讨论
在中药材的初加工过程中采用“杀青”方法进行处理已不鲜见。研究发现,“杀青”可以使中药材中分解代谢物的相关酶失活,从而影响药材中初级和次级代谢产物含量的高低和存在方式[5,8]。比如,贾金萍等[9]利用核磁共振氢谱代谢组学技术研究了青翘初加工过程中“杀青”对其代谢轮廓的影响,发现“杀青”这一过程可有效避免连翘中苯乙醇苷类成分(如连翘酯苷A等)、木脂素类成分(如连翘苷等)、黄酮类成分(如芦丁等)以及一些初级代谢产物(如蔗糖等)被酶解;苗远晴等[10]研究发现,“打顶”后微波“杀青”可明显提高初花期和盛花期肉苁蓉中松果菊苷和毛蕊花糖苷的总保留量;宋健等[11]研究发现,“杀青”和烘干的金银花中绿原酸和木犀草苷的含量均比鲜品晒干和鲜品阴干的样品高。
安开龙等[12]曾以11种木脂素类成分和5-羟甲基糠醛(5-HMF)的含量为指标,采用真空冷冻干燥、阴干、晒干、不同温度(40、50、55 ℃)热风烘干、不同温度(45、55 ℃)真空干燥的方法对五味子鲜果进行处理。结果显示,45 ℃真空干燥样品中五味子醇甲和11种木脂素类成分的总含量最高、有害成分5-HMF的含量较低,50 ℃热风烘干的样品次之,但差别不大。根据上述研究结果,笔者从成本、成分含量和实用性方面进行综合分析后,认为五味子可采用50 ℃烘干的方法进行处理。因此,本研究分别以50 ℃烘干和传统干燥方式——晒干的样品为对照,通过HPLC指纹图谱、聚类分析和7种主要木脂素类成分含量的变化来考察“杀青”处理对五味子药材品质的影响。
笔者通过HPLC指纹图谱和聚类分析发现,晒干样品与其他干燥方法处理的样品间的指纹图谱相似性有较大差异,说明初加工方法的不同能使五味子药材的化学成分谱产生一定改变。进一步进行定量分析发现,先“杀青”再干燥处理的五味子样品中7种木脂素类成分的总含量显著高于50 ℃烘干和晒干样品,尤以烫漂“杀青”后烘干的样品中总含量相对较高;而50 ℃烘干和晒干样品中7种木脂素类成分总含量差异不大。关于烫漂“杀青”后烘干样品中7种木脂素类成分的总含量较微波和蒸制“杀青”后烘干样品相对较高,笔者认为可能原因如下:烫漂能够快速破坏五味子鲜果中内源酶的活性,减少干燥过程中内源酶对五味子内含物质的分解和消耗;微波和蒸制“杀青”虽然同样能使五味子鲜果中的内源酶失活,但是处理时间相对较长,这亦会破坏五味子中木脂素类成分的稳定。关于50 ℃烘干样品与晒干样品中7种木脂素类成分总含量差异无统计学意义,笔者分析可能原因如下:虽然50 ℃烘干较晒干的耗时相对较短,但是这一温度也会在一定程度上增加果实中内源酶的活性,从而加剧干燥初期果实组织的呼吸活动,最终导致五味子内含物质的分解和消耗[13]。
综上所述,本研究结合HPLC指纹图谱、聚类分析和7种木脂素类成分的定量分析结果,初步证实了先采用烫漂、微波等方法“杀青”后再干燥处理的五味子样品的品质要优于直接晒干和烘干的样品。本研究后期拟通过多组学联合分析方法进一步深入研究五味子鲜果采后“杀青”对药材品质的影响,并结合加工成本与实际收益综合考量是否在五味子鲜果的初加工过程中加入“杀青”这一环节。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2020:68.
[ 2 ] 王书云,李钦,刘亚芳,等.五味子高效液相色谱指纹图谱研究[J].时珍国医国药,2018,29(11):2680-2683.
[ 3 ] 罗云波.果蔬采后生理与生物技术[M].北京:中国农业出版社,2010:13.
[ 4 ] 王鑫腾,张有林,袁帅.果品蔬菜采后生理研究进展[J].陕西农业科学,2012,58(5):98-102.
[ 5 ] 段金廒,宿树兰,严辉,等.药材初加工“杀青”环节与药材品质形成的探讨[J].中药材,2011,34(1):1-4.
[ 6 ] 田振坤,马英丽,吴伦,等.星点设计-效应面法优化北五味子果实提取工艺[J].中国实验方剂学杂志,2011,17(23):28-31.
[ 7 ] 周进东,陆兔林,毛春芹,等. HPLC测定五味子不同炮制品中6种木脂素类成分的含量[J].中国药学杂志,2011,46(17):1353-1356.
[ 8 ] 侯娅,马阳,邹立思,等.基于UPLC-Triple TOF-MS/MS技术分析不同产地太子参的差异化学成分[J].质谱学报,2015,36(4):359-366.
[ 9 ] 贾金萍,张福生,李震宇,等.基于1H-NMR代谢组学技术研究“杀青”对连翘化学成分的影响[J].中草药,2016,47(8):1375-1381.
[10] 苗远晴,郭晔红,李梅英,等.打顶和杀青方式对肉苁蓉有效成分保留量的影响[J].中药材,2017,40(4):823-827.
[11] 宋健,张会敏,石俊英.金银花最佳产地加工方法:杀青烘干干燥法[J].中药材,2008,31(4):489-491.
[12] 安开龙,李德坤,周大铮,等.不同干燥方法對五味子药材品质的影响[J].中国中药杂志,2014,39(15):2900-2906.
[13] 喻芬,万娜,李远辉,等.中药材干燥过程中的理化性质变化规律与机制分析[J].中草药,2021,52(7):2144-2153.
(收稿日期:2021-06-10 修回日期:2021-09-14)
(编辑:林 静)

