猪C1QTNF3基因可变剪接体的鉴定及介导miR-101调控成脂分化的研究
杨 阳,张雪莲,张万锋,李文霞,李文新,蔡春波,路 畅,高鹏飞,郭晓红,李步高,曹果清
(山西农业大学动物科学学院,太谷 030801)
补体C1q/肿瘤坏死因子相关蛋白3(C1q/tumor necrosis factor-related protein 3,C1QTNF3),又被称为CTRP3、CORS26或cartducin。C1QTNF3具有4个结构域:C-末端gC1q球型域、N-末端信号肽、可变域和胶原重复序列,其中,gC1q球型域是C1QTNF3发挥功能的主要结构域[1]。C1QTNF3属于CTRP家族的成员,是一种分泌蛋白,在体内各组织中广泛存在,在脂肪、软骨、心、肺、结肠和睾丸中表达量较高[2-3]。人类的C1QTNF3基因存在2种可变剪接体(亚型A和B),研究发现,HEK293细胞中共同过表达C1QTNF3A和C1QTNF3B后,C1QTNF3A具有保护C1QTNF3B免受蛋白酶体降解的作用[4],提示了C1QTNF3不同转录本之间存在一定的关联。小鼠的C1QTNF3基因也存在2种可变剪接体[1, 5]。查阅NCBI数据库发现,猪C1QTNF3基因只有1个确认的转录本,然而,许多猪转录组测序结果显示,猪C1QTNF3基因可能存在多种剪接体,但具体信息有待进一步验证。因此,深入研究猪C1QTNF3基因的可变剪接,对阐述C1QTNF3在生命活动中的具体作用有重要的意义。
C1QTNF3在软骨发育、内分泌、炎症反应、心血管疾病及脂肪细胞分化和代谢等多项生理活动中发挥着重要的调控作用[5]。作为一种脂肪因子,C1QTNF3的蛋白表达与组织的脂肪含量密切相关,在发生肥胖、胰岛素抵抗以及二型糖尿病的人和小鼠血液中,C1QTNF3的水平发生显著变化[6-9]。在3T3-L1前脂肪细胞成脂分化过程中,C1QTNF3基因表达量显著升高,添加C1QTNF3的重组蛋白抑制了3T3-L1细胞的成脂分化,降低了关键基因PPARγ和FABP4的表达[10]。此外,C1QTNF3还发挥着抑制肝细胞中的脂质沉积[11],参与调控其他脂肪细胞因子表达的功能[12]。综上所述,C1QTNF3是调控细胞分化和代谢的关键因子,鉴定靶向C1QTNF3的上游调控因子,可以为深入研究成脂分化的机制,缓解因脂肪组织过度发育而造成的相关代谢疾病提供调控手段。miRNA是一类重要的表观因子,可通过影响关键基因的表达,实现基因功能的调控。研究发现,在骨肉瘤细胞中,miR-495-3p可通过下调C1QTNF3抑制细胞增殖、迁移和侵袭[13],但靶向调控C1QTNF3表达的miRNA的研究还需深入探讨。
miR-101是重要肿瘤抑制miRNA,在多种疾病(尤其是恶性肿瘤)的发生和发展中起着关键作用,同时也广泛参与细胞增殖、凋亡、侵袭、迁移、成肌分化等生物学事件的调控[14-16]。研究显示,miR-101在肥胖的小鼠中表达量显著升高[17],且在细胞成脂分化过程中表达量显著升高[18-19],提示miR-101可能是成脂分化和脂质代谢新的关键调节因子。本研究利用生物信息学预测发现,miR-101与C1QTNF3基因3′UTR区域存在潜在的结合位点,暗示了miR-101可能与C1QTNF3基因存在靶向关系,但具体作用机制尚不清楚。
目前,有关猪C1QTNF3基因的可变剪接及靶向调控因子的研究还较少,本研究采用基因克隆和qRT-PCR技术鉴定猪C1QTNF3基因的不同转录本及在组织中的表达模式,并通过结合位点突变和qRT-PCR技术分析miR-101对C1QTNF3的靶向作用,在猪脂肪SV细胞中过表达miR-101,研究miR-101对成脂分化的调节作用。本研究丰富了miRNA调控脂肪细胞生成的调控网络,为探讨猪C1QTNF3基因的功能提供理论参考。
1 材料与方法
1.1 试验动物
本研究选取3头30日龄健康无病、体重相近的马身猪仔公猪,屠宰后,采集心、肝、脾、肺、肾、胃、股二头肌、腰大肌、皮下脂肪和背部脂肪样品。
1.2 主要试剂
胎牛血清(Gibco,美国);TRIzol、SYBR Premix ExTaqII、Prime Script RT reagent Kit(TaKaRa,大连);Green Taq Mix(Vazyme,南京);胰岛素和罗格列酮(Sigma,美国);青链霉素、地塞米松、胰蛋白酶、油红O、3-异丁基-1-甲基黄嘌呤(索菜宝,北京);猪miR-101 mimics、miR-NC和psiCHECK-2质粒(汉恒生物公司,武汉);Lipofectamine 2000(Invitrogen,美国)。
1.3 试验方法
1.3.1 总RNA提取和cDNA合成 马身猪的10个组织和皮下脂肪SV细胞的总RNA采用TRIzol试剂盒提取。将提取的RNA用PrimeScript RT reagent Kit试剂盒进行反转录。
1.3.2C1QTNF3转录本的扩增与克隆 在NCBI 上查找猪C1QTNF3基因的序列(登录号:NM_005672408.3),用NCBI Primer-BLAST和Oligo7软件针对C1QTNF3基因CDS区全长设计扩增引物P1,引物位置示意图见图1,引物序列见表1。将马身猪各组织的cDNA等比例混合,扩增猪C1QTNF3基因的不同可变剪接体。反应产物用1%的琼脂糖凝胶电泳进行检测,将不同的转录本片段胶回收后送华大基因公司确定序列。随后根据测序数据,针对C1QTNF3转录本特有的序列(图1中第1外显子的深色区域)设计上游引物F2,C1QTNF3-1转录本上第1外显子缺失219 个碱基,因此跨缺失区域设计第1和第2外显子的拼接上游引物F3,最后利用qRT-PCR特异性检测C1QTNF3和C1QTNF3-1的表达。qRT-PCR试验按照 SYBR Premix ExTaqII试剂盒进行(引物序列见表1),重复数n=3。定量结果应用2-△△CT法进行分析,选取18S rRNA作为内参基因,基因表达的差异用“平均值±标准误”表示。

表1 引物信息
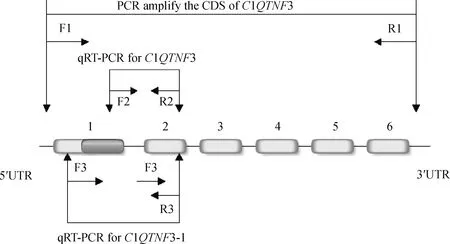
1~6代表外显子,深色区域为C1QTNF3-1转录本缺失序列;F/R.上/下游引物
1.3.3 序列生物信息学分析 生物信息学所用的软件工具见表2。

表2 分析软件信息
1.3.4 猪C1QTNF3基因的双荧光质粒的构建 设计扩增C1QTNF3的3′UTR同源重组引物(Wt-F: 5′-ATTCTAGGCGATCGCTCGAGAGT-TTTGCCTATCCCTTCCCAA-3′;Wt-R:5′-TTA-TTGCGGCCAGCGGCCGCAGGGTCAAAGACT-GACCTGAA-3′)及突变引物(Mut-F: 5′-CATGAGAATGTCGCGTAAATTCTGATGATAGT-ATCCAAAATTGG-3′; Mut-R: 5′-TACGCGA-CATTCTCATGAATATCATCTTGGCTAATT-3′)。以马身猪组织样cDNA为模板,扩增C1QTNF3的3′UTR 序列,胶回收产物与psiCHECK-2线性化载体通过Vazyme同源重组试剂盒进行连接。连接成功的质粒送华大基因公司进行测序。
1.3.5 细胞培养、转染和成脂诱导 原代猪脂肪SV细胞和293T细胞由实验室保存。细胞的生长培养基为含有10%胎牛血清和1%双抗的DMEM(高糖)培养基。将293T细胞接种到细胞板后,待细胞达到80%~90%融合度时,采用Lipo 2000转染试剂转染miR-101 mimics及对照、Sus-C1QTNF3-Wt-psiCHECK-2和Sus-C1QTNF3-Mut-psiCHECK-2,24 h后,检测荧光素酶活性。miR-101 mimics及对照序列见表3。

表3 miR-101 mimics/NC序列信息
猪脂肪SV细胞转染miR-101 mimics及对照后,采用“激素鸡尾酒”法诱导成脂分化,待细胞长满后,培养基中加入罗格列酮(1 μmoL·L-1)、胰岛素(10 μg·mL-1)、DEX(1 μmoL·L-1)和IBMX(0.5 mmoL·L-1)。2 d后,培养基更换为生长培养基+胰岛素(10 μg·mL-1)。2 d后,培养基换为生长培养基。油红O染色参照试剂盒操作规程进行,染色后在光学倒置显微镜下拍照。
1.3.6 统计与分析 猪C1QTNF3基因的组织表达差异利用SPSS 22.0软件的单因素方差分析进行;两样本间的差异分析利用独立样本T检验进行;P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 猪C1QTNF3基因可变剪切体的克隆及生物信息学分析
2.1.1 猪C1QTNF3基因可变剪接体的扩增 利用RT-RCR方法扩增猪C1QTNF3基因序列,结果显示,PCR产物具有两条带,大小分别为1 117和898 bp(图2A),序列比对分析发现,长片段(称为C1QTNF3)与NCBI公布序列相同,短片段(称为C1QTNF3-1)在第1外显子区域缺失了219 bp(图2B),利用ORF Finder检测发现,C1QTNF3-1含有一个长741 bp的开放阅读框。综上,克隆得到C1QTNF3的一个741 bp CDS全长的新转录本C1QTNF3-1(NCBI登录号:MN082631),编码246个氨基酸。

A.PCR扩增C1QTNF3的各转录本(1.阴性对照;M.DNA相对分子质量标准;2.C1QTNF3各转录本扩增结果);B.C1QTNF3和C1QTNF3-1的核苷酸序列比对结果
2.1.2 猪C1QTNF3蛋白质结构预测 SOPMA和PredictProtein软件的预测结果显示(图3A-B),C1QTNF3与C1QTNF3-1的蛋白质二级结构包含α-螺旋(h)、延伸(e)、β-折叠(t)和无规则卷曲(c),C1QTNF3分别占18.81%、16.30%、5.96%和58.93%,C1QTNF3-1分别占14.23%、22.76%、6.10%和56.91%。Phyre2.0软件预测蛋白三级结构(图3C)显示,C1QTNF3和C1QTNF3-1具有非常相似的3D结构。两个蛋白均是由9个β-折叠围成的结构。每两个β-折叠之间由无规则卷曲(disordered loop)相连。两个蛋白的结构差异主要体现在Loop1、4、6、8构象的不同。
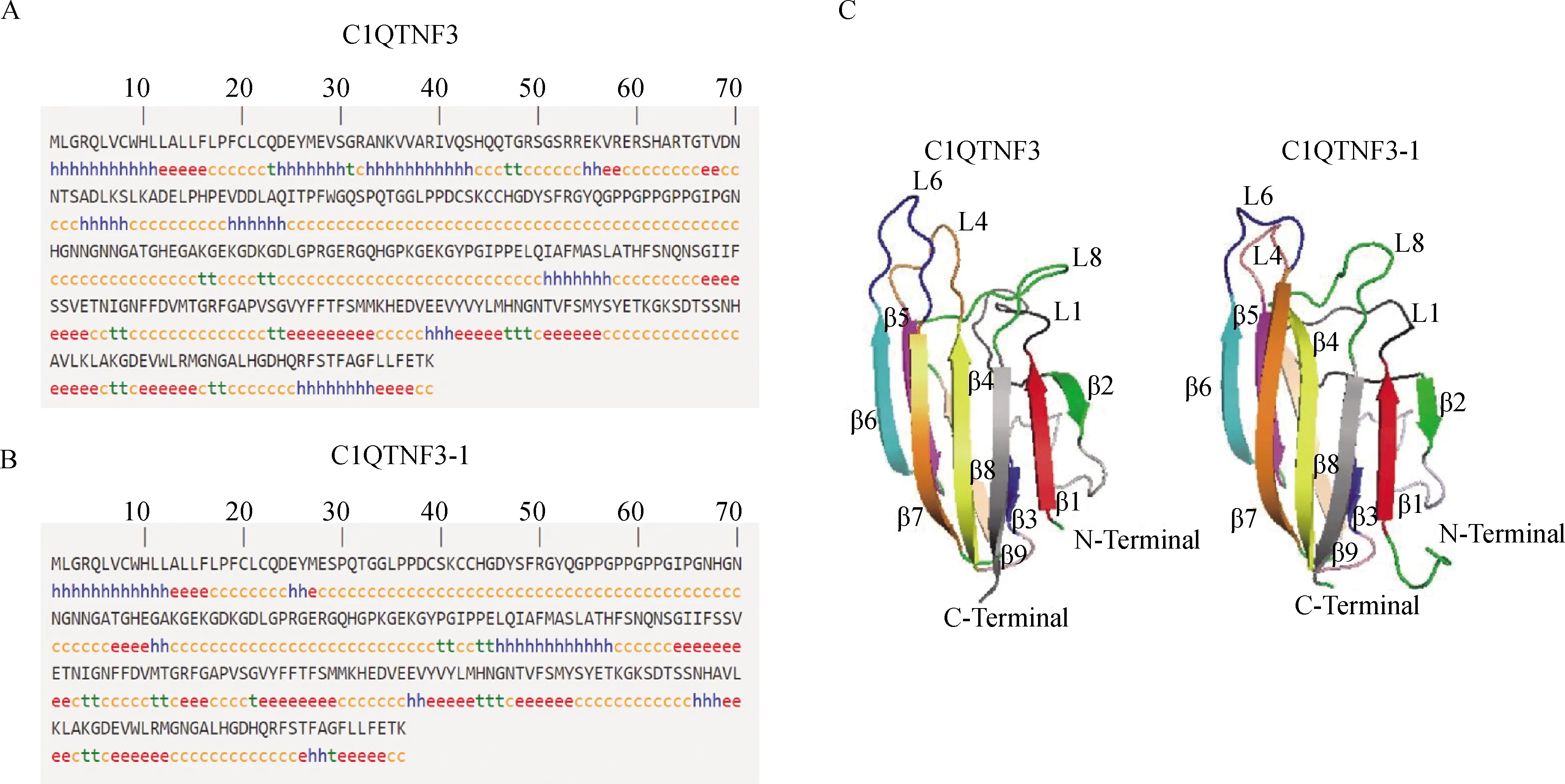
A、B.猪C1QTNF3与C1QTNF3-1蛋白质预测的二级结构;C.C1QTNF3与C1QTNF3-1蛋白质三级结构
2.1.3 C1QTNF3氨基酸序列进化树的构建 用NCBI BLAST检测包括猪、人、牛、山羊、北极熊等在内的14个物种C1QTNF3氨基酸的相似性,结果表明,猪的C1QTNF3-1(猪C1QTNF3 isoform X1)蛋白序列与北大西洋小须鲸C1QTNF3 isoform X3和北极熊C1QTNF3 isoform X3的同源性最高,达99.59%;与猪C1QTNF3、家猫C1QTNF3 isoform X3、夏威夷僧海豹C1QTNF3 isoform X3、白尾鹿德克萨斯亚种C1QTNF3 isoform X3、山羊C1QTNF3 isoform X1的同源性分别为99.54%、99.19%、99.19%、99.19%和99.09%。对上述14个物种进行进化树分析(图4),猪C1QTNF3-1与C1QTNF3的氨基酸序列单独聚为一个分支,表明二者亲缘关系最近,此外与人和马来亚穿山甲的遗传距离较近,暗示了C1QTNF3在猪和人的物种之间具有功能上的相似性。
2.2 C1QTNF3基因在猪不同组织的表达谱分析
本研究采用qRT-PCR方法研究了C1QTNF3基因在马身猪不同组织中的表达规律(图5),C1QTNF3和C1QTNF3-1在各组织中均有表达;C1QTNF3转录本在肌肉中表达量最高,在肝和脾中表达量较低;C1QTNF3-1在肺和背部脂肪中表达量较高,随后是肾、腰大肌、股二头肌、胃等。各组织中C1QTNF3-1的表达量均极显著高于C1QTNF3(P<0.01),推测C1QTNF3-1为主要亚型。
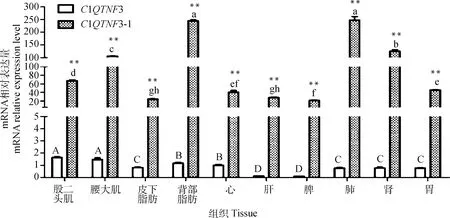
**.表示同一组织中C1QTNF3和C1QTNF3-1的表达量差异极显著(P<0.01)。小写字母(C1QTNF3-1)和大写字母(C1QTNF3)表示各组织中同一转录本的mRNA水平存在差异(P<0.05)
2.3 miR-101对C1QTNF3表达水平的影响
为鉴定猪C1QTNF3基因的上游调控因子,通过靶基因预测发现,miR-101的种子序列与猪C1QTNF3基因不同转录本下游1 266~1 656 bp的3′UTR序列均完全互补,即具有同一个结合位点(图6A)。推测C1QTNF3可作为miR-101潜在的靶向调控基因。随后,通过转染miR-101 mimics实现miR-101的过表达(图6B)。在293T细胞中共转染miR-101 mimics与C1QTNF3 的3′UTR双报告载体后,miR-101 mimics显著抑制了C1QTNF3 的3′UTR的荧光活性(P<0.01,图6C),将3′UTR区域的结合位点突变后,miR-101 mimics则不显著影响荧光素酶的活性。由此说明,miR-101与C1QTNF3的3′UTR确实存在结合位点,存在靶标关系。最后,过表达miR-101后,猪脂肪SV细胞中C1QTNF3基因表达量极显著降低(P<0.01,图6D),表明miR-101负调控C1QTNF3基因的表达。
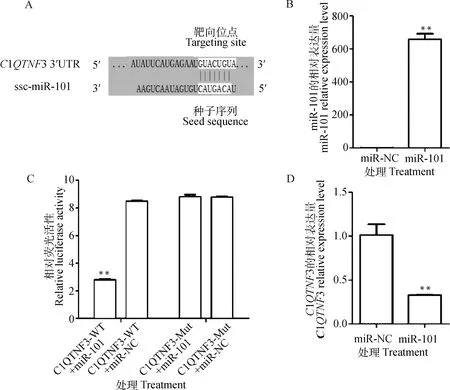
A.C1QTNF3基因与预测miRNAs的结合位点;B.miR-101过表达效率检测;C.C1QTNF3基因3′UTR双荧光质粒的相对荧光活性;D.过表达miR-101对C1QTNF3表达的影响。**.P<0.01,下同
2.4 miR-101对猪脂肪细胞生成的影响
为研究miR-101对成脂分化的调节作用,猪脂肪SV细胞转染miR-101 mimics成脂诱导8 d后,检测脂肪细胞生成的变化。结果显示,转染miR-101 mimics的猪脂肪SV细胞脂滴增加(油红O染色,图7A~B),进一步检测甘油三酯的含量发现,过表达miR-101显著增加了猪脂肪SV细胞的甘油三酯含量(P<0.01,图7C)。此外,qRT-PCR结果显示,转染miR-101 mimics后成脂关键基因PPARγ、C/EBPβ、SREBP-1c和FABP4的表达水平均极显著升高(P<0.01,图7D)。综上结果表明,过表达miR-101促进猪脂肪细胞成脂分化。

A、B.油红O染色结果(100×);C.甘油三酯含量检测;D.过表达miR-101对成脂关键基因表达的影响
3 讨 论
脂肪组织是机体内主要的储能器官,随着大量脂肪细胞因子的发现,脂肪组织也被认为是内分泌器官,在内稳态调节中发挥着重要作用[20]。C1QTNF3作为一个脂肪细胞因子,被报道在脂肪细胞生成的调控中发挥重要作用。Nishimoto等[10]研究发现,过表达C1QTNF3基因可能通过ERK1/2和Akt信号通路,抑制3T3-L1细胞的成脂分化。然而最近的一项研究却表明,C1QTNF3基因敲除的小鼠能有效缓解小鼠饲喂高脂日粮造成的肥胖,显著降低了附睾脂肪的比率和成脂关键因子的表达[21]。这表明C1QTNF3在脂肪细胞生成过程中扮演着复杂而关键的调控角色,但产生差异结果的机制却有待进一步研究。可变剪切是生物体内普遍存在的一种调控方式[22-24],与蛋白质功能的改变密切相关[25]。基因表达过程中发生的可变剪切事件直接影响顺式作用元件的作用和定位,并对细胞的增殖凋亡、信号转导和分化等过程都具有重要的作用[26-28]。本研究通过RT-PCR和克隆测序技术发现了C1QTNF3基因的两个转录本C1QTNF3和C1QTNF3-1,与C1QTNF3相比,C1QTNF3-1缺失了部分第1外显子,这与人和小鼠上C1QTNF3基因转录本结果相一致[1,5]。说明C1QTNF3在不同的物种之间可能具有相同的选择性剪接机制,使得研究C1QTNF3的功能具有普遍性,也为解释C1QTNF3在成脂分化中不同作用结果提供了思路。
研究表明,C1QTNF3基因敲除小鼠能够降低高脂日粮诱导肥胖小鼠的脂肪重,并调控附睾脂肪组织中成脂关键因子的表达[21]。此外,C1QTNF3能够上调成肌分化关键基因MyHC和MyoG的表达,并抑制notch受体的表达,从而调控成肌细胞的分化[29]。本研究结果也发现,C1QTNF3的不同转录本均在猪脂肪组织和肌肉组织中高表达,这与C1QTNF3影响动物脂肪细胞生成和骨骼肌生长发育的生理功能相吻合[21,29]。基因各转录本之间的表达趋势往往不同[30],本研究中,在猪30日龄的组织中C1QTNF3-1的表达量均极显著高于C1QTNF3(P<0.01),推测C1QTNF3-1为主要亚型。蛋白质结构预测显示,C1QTNF3和 C1QTNF3-1具有非常相似的蛋白质结构,说明C1QTNF3不同转录本蛋白质之间的功能存在相关性,但在三级结构预测中没有得到α-螺旋的结构,需要进一步利用晶体衍射研究其具体的蛋白质结构。
前期的研究显示,C1QTNF3在成脂分化中发挥着重要的作用,因此可以进一步靶向C1QTNF3建立一些调控手段,来调控脂肪发育。miRNAs作为重要的表观调节因子,通过影响关键基因的表达调控多种生理学和病理学过程。关于miRNA对C1QTNF3的表达调控研究已有报道,研究显示,过表达miR-495-3p可通过下调C1QTNF3基因表达,抑制骨肉瘤细胞增殖、侵袭及迁移[13]。本研究构建了包含有miR-101和C1QTNF3基因结合位点3′UTR 序列的psiCHECK-2 双荧光素酶报告载体,以及结合位点突变载体。共转染miR-101 mimic和双报告载体后,miR-101 mimic显著抑制了野生型载体的荧光活性(P<0.01),而突变型载体的荧光活性无显著变化,提示miR-101存在靶向调控C1QTNF3基因表达的情况。进一步研究显示,过表达miR-101可明显降低猪脂肪SV细胞中C1QTNF3的表达(P<0.01),提示miR-101与C1QTNF3基因存在显著的负调控。miR-101参与肿瘤抑制的调控,且在多种生物学事件中起着关键作用,例如细胞增殖、凋亡、血管生成、侵袭、迁移、分化等[14-16]。研究发现,miR-101可以通过EZH2/Wnt/β-catenin信号通路调控间充质干细胞的成骨分化[31],但miR-101对于成脂分化的研究还未见报道。本研究将miR-101 mimic转染猪脂肪SV细胞,并进行成脂诱导分化,结果表明,过表达miR-101可以增加细胞的脂质积累,PPARγ、C/EBPβ、SREBP-1c和FABP4等关键基因的表达量显著升高(P<0.01),说明miR-101具有促进猪脂肪SV细胞分化为成熟脂肪细胞的作用。
4 结 论
本试验获得了猪C1QTNF3基因的一个新转录本C1QTNF3-1(MN082631),与C1QTNF3基因相比,C1QTNF3-1第1外显子区域缺失了219 个碱基。分析猪C1QTNF3和C1QTNF3-1在各组织的表达规律发现,C1QTNF3-1可能为主要亚型。miR-101与C1QTNF3的3′UTR存在结合位点,过表达miR-101会抑制C1QTNF3基因的表达并促进成脂分化,这些结果说明了C1QTNF3基因与miR-101间的靶标关系,为进一步研究C1QTNF3对成脂分化和代谢的调控机制提供了理论基础。

