大同黄花菜茎段组织培养研究
韩志平, 王丽君, 张海霞, 张 琨
(1.山西大同大学生命科学学院/设施农业技术研发中心, 山西 大同 037009;2.大同黄花产业发展研究院, 山西 大同 037004; 3.山西大同大学后勤管理处, 山西 大同 037009)
黄花菜(HemerocalliscitrinaBaroni)为百合科萱草属多年生草本植物,对环境条件的适应性很强,在我国南北都有栽培[1]。黄花菜是我国特有的蔬菜,其花蕾含有丰富的蛋白质、糖类、维生素、氨基酸和钙、磷、铁等矿物质[2],还富含卵磷脂、甾类、硒等物质[3],加上花型优美、色泽鲜艳,根系发达,具有食用、药用、绿化观赏、水土保持等多种用途[4-5]。
大同市云州区是我国第二大黄花菜主产区,位于北纬39°45′~40°13′,属最适宜作物生长的黄金纬度带范围[6-7]。由于当地光照充足、昼夜温差大,加上大同火山群下土壤肥沃疏松[8],这里的黄花菜色泽金黄、角大肉厚、营养丰富、香味浓郁,外观品质和食用品质均为全国最优,还是大同市首个国家地理标志保护产品、全国百强农产品区域公用品牌产品[9]。目前,大同黄花菜种植规模已达1.73万hm2,仅云州区就有1.13万hm2,已经成为云州区“一区一业”的主导产业和脱贫攻坚的支柱产业。但是,目前采用的分株、切片、芽块等黄花菜种苗繁殖方法,受母株生长年限、自然生长环境和气候条件的限制很大,存在种苗成本高、纯度难以保证、繁殖系数低、周期长、繁殖时间受限、易带病虫草害等问题[10-11],难以满足种苗批量生产的需求。植物组织培养技术具有繁殖系数高、繁殖周期短、利于保持品种的优良性状、无病虫草害等优点,已经广泛应用于蔬菜、果树、花卉、园林植物等的快速繁殖[12]。20世纪80年代起,一些学者采用黄花菜的根、根状茎、叶、花等不同部位进行了黄花菜的组织培养研究[13-16],但至今黄花菜的组织培养技术仍不成熟,组织培养体系尚未建立,难以在生产上大规模应用。为此,本试验以大同黄花菜种子为材料,培养获得无菌苗后,以其根、茎、叶为外植体,初步研究了大同黄花菜组织培养的再生系统,为大同黄花菜组织培养体系的建立及其在生产中的应用奠定基础。
1 材料与方法
1.1 试验材料
试验在山西大同大学生命科学实验教学中心的植物学实验室进行。材料为采集自生命科学试验基地的大同黄花菜种子。供试激素包括生长素类的2,4-D和NAA、细胞分裂素类的6-BA。
1.2 试验方法
1.2.1种子灭菌和萌发预试验
为确定种子灭菌和萌发的适宜方法,设置4个处理:
1) 种子在水分充足的发芽盒中自然萌发;
2) 种子用无菌水浸泡12 h,吸干表面水分后直接接种于MS培养基上;
3) 种子用无菌水浸泡12 h,再用75%乙醇浸泡30 s,用无菌水冲洗3~4次,然后用0.1%升汞浸泡10 min,再用无菌水冲洗3~4次,用无菌滤纸吸干表面水分,接种于MS培养基上;
4) 种子用无菌水浸泡12 h,用无菌滤纸吸干表面水分后剥去种皮,按处理 3) 方法灭菌后接种于MS培养基上,培养中发现发霉的种子再次灭菌后重新接种。
1.2.2无菌苗培养与外植体的获取和培养
选取饱满、整齐的种子,按预试验处理4)方法浸种、去皮、灭菌、接种。种子萌发后待幼苗第1片叶长3~5 cm时,用无菌刀片将根、茎、叶分别切为长1 cm左右的节段,接种于诱导培养基上。培养1周后将形成不定芽的材料转移到继代培养基上,每隔1周转瓶继代1次。当第1片叶长达1 cm时,转移到生根培养基上。
种子去皮、灭菌及各阶段材料的接种均在超净工作台上进行,每个阶段每瓶接种4~5个材料,每次接种后立即置于人工气候培养箱中培养,培养条件为温度(25±2)℃、光照强度2 000~2 500 lx、光照时间12 h·d-1[17]。定期用75%酒精擦拭气候箱消毒,同时观察和记录种子萌发、无菌苗生长、芽分化、叶抽生、根诱导等生长情况。
1.3 培养基和激素成分
根、茎、叶3种外植体在诱导培养阶段均设置4种基本培养基单独处理:①MS;②1/2 MS;③N 6;④1/2N 6,但同种外植体的4种基本培养基上添加的激素种类和用量均相同(表1)。继代培养阶段3种外植体均采用MS培养基,但培养基上添加的激素种类和用量各不相同。
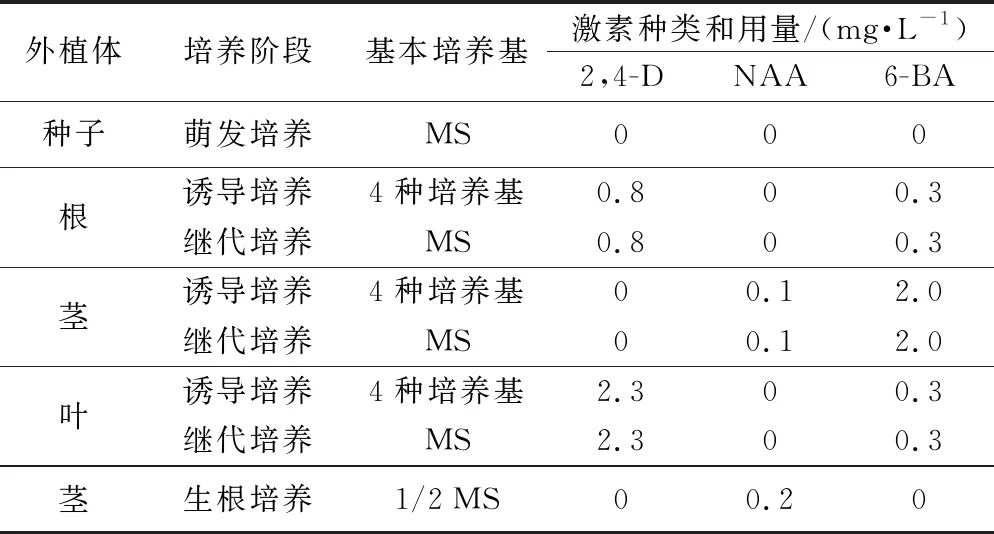
表1 不同外植体各培养阶段所用培养基和激素成分
2 结果与分析
2.1 种子灭菌和萌发预试验
黄花菜种子坚硬,吸水和萌发困难。为使种子顺利萌发并获得能够切取根、茎、叶等外植体的健壮无菌苗,用4种方法对种子进行处理。结果发现,1) 发芽盒自然萌发的种子培养2周后大部分种子仍未萌发,少数萌发的幼苗长势较弱、叶片细长。 2) 无菌水浸泡后直接接种于MS培养基上的种子,全部被黑色霉菌污染。 3) 无菌水浸泡后再用乙醇和升汞灭菌后接种于MS培养基上的种子,也全部被黑色霉菌污染。 4) 无菌水浸泡后去皮,再用乙醇和升汞灭菌,然后接种到MS培养基上的种子,污染率降低到37.5%;污染的种子再次灭菌后接种,污染率降低到0,种子萌发率达100%。因此,后续试验采用4) 处理方法进行无菌苗的培养。
2.2 种子萌发与无菌苗的形成
种子经浸种、去皮、灭菌后接种于MS培养基上,约5 d后开始萌发,萌发率100%。再经约3 d开始形成叶片,同时根系不断伸长。培养约2周后,无菌苗第1片叶长3~5 cm、根3~5条,即可取其根、茎、叶3部分,分别切成约1 cm长的节段备用(图1)。

注:A为接种;B为萌发;C为无菌苗。
2.3 外植体诱导培养
2.3.1不同外植体切段诱导结果
无菌苗的根、茎、叶切段分别接种于诱导培养基上,茎段培养1 d后开始形成不定芽,4 d后有不定芽形成叶片;培养8 d后,多数茎段诱导产生了不定芽,并有部分抽生叶片,将形成不定芽的茎段转移到继代培养基上。根和叶的切段在诱导培养过程中没有任何形态变化,既没有产生愈伤组织,也没有形成不定芽(图2)。结果说明,茎段比根、叶的切段更容易被诱导,且不经过愈伤组织阶段,直接诱导形成不定芽。

注:A为茎段接种;B为茎段突出;C为茎段出芽并抽叶;D为叶段接种;E为根段接种。
2.3.2不同培养基上茎段的诱导培养结果
茎段在4种诱导培养基上分别培养8 d后,均诱导形成了不定芽,并有部分抽生第1片叶,没有形成愈伤组织(表2和图3)。其中MS培养基诱导率最高,1/2 MS和N 6培养基诱导率次之,1/2 N 6培养基诱导率最低;从不定芽的形态和长势看,MS和1/2 MS培养基上形成的不定芽均较壮,N 6和1/2 N 6培养基上形成的不定芽长势一般,但4种培养基上形成的不定芽均无畸形。综合比较,茎段在MS培养基上诱导形成不定芽的几率最高且长势良好,是茎段诱导培养的最适培养基,1/2 N 6培养基诱导效果最差,不宜用于茎段的诱导培养。
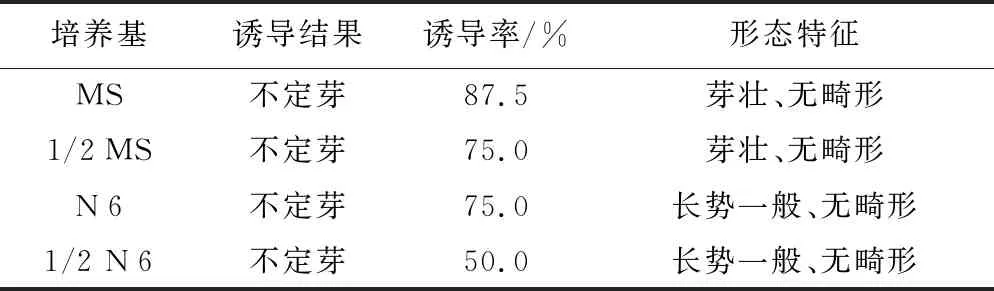
表2 不同培养基上茎段的诱导培养结果
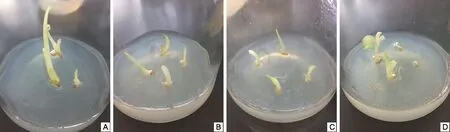
注:A为MS培养基;B为1/2 MS培养基;C为N 6培养基;D为1/2 N 6培养基。
2.4 继代培养
在继代培养过程中,已经抽叶的茎段材料叶片进一步生长,其他具有不定芽的材料也陆续抽生叶片,抽叶率100%,而后开始抽生第2片叶(图4)。部分已经抽叶的材料在培养过程中被污染,培养基表面着生黄色霉菌,材料软化腐烂。经过2次继代,最终形成叶片的茎段材料存活率为86.96%。继代培养2周,当第1片叶长1 cm时,将存活的茎段材料接种于生根培养基上诱导生根。根和叶的切段在继代培养基上仍没有任何形态变化,继代培养2次后丢弃。

注:A为第一次继代;B为第二次继代;C为诱导生根;D为完整组培苗。
2.5 诱导生根
具有叶片的无根苗在生根培养基上培养约2周后开始形成乳白色的幼根,再培养2周后生根率达45%,但根系较细,长势较弱。培养过程中,茎段材料继续抽生新叶,叶片不断伸长增宽。培养约1个月形成完整的试管苗,此时多数幼苗仅发生主根,根长约1 cm,叶子2~3片,最大叶长约3 cm,少数幼苗具有3条根,第1片叶长约5 cm。
3 讨论与结论
3.1 培养过程和结果
黄花菜种子浸泡、去皮、灭菌后接种于MS培养基上,5 d后开始萌发,再经8 d形成完整的无菌苗。取无菌苗的根、茎、叶3部分,分别切为1 cm长的切段后接种于诱导培养基上;其中茎段材料8 d后产生不定芽,并抽生叶片,而后转移到继代培养基上;培养2周后,第1片叶伸长至1 cm时,转移至生根培养基上;培养约2周后开始生根,再经2周45%的茎段材料形成完整的组培苗。根和叶的切段材料在诱导培养基上没有形成愈伤组织或不定芽,继代培养也无任何形态变化。
3.2 存在的主要问题
3.2.1污染问题
种子萌发阶段出现了萌发率低、容易发霉的问题。预试验发现,种子萌发率低的原因可能是种皮坚硬,难以萌发;发霉的原因是种皮表面凹凸不平,带有杂菌,灭菌消毒不彻底。去除种皮、并对种子进行二次灭菌后种子全部萌发,也没有发生霉变。继代过程中也出现了部分材料被污染的问题,可能是接种时器具或材料灭菌不彻底造成的[18]。应特别加强材料和接种器具的灭菌消毒,并及时清理被污染的材料。
3.2.2玻璃化现象
生根培养阶段有部分材料出现了玻璃化现象,叶片呈透明或半透明状态。原因可能是:1) 继代后期到生根阶段人工气候培养箱温度和湿度过高,光照较弱[19]; 2) 培养基中无机盐离子用量、激素种类和配比不利于材料的生长和光合作用[20]。将玻璃化材料移出气候箱,在自然光照射下逐渐回绿,但1周后叶片仍然萎蔫,地上部死亡。因此,需要进一步研究黄花菜组培苗玻璃化的原因和解决方法。
3.2.3弱根系问题
试验中组培苗的生根率较低,发生的根系较细,根数也少,多数仅有主根,长势较弱。可能是因为培养基中NAA浓度不适宜材料生根[16],也可能是继代培养后期叶片形成状况一般抑制了根的发生[21]。今后需从培养基及其添加的激素种类和浓度着手,探明根系发生少、生长弱的原因,进而解决该问题。
3.3 研究结论
本研究以大同黄花菜种子萌发形成无菌苗,再以其根、茎、叶的切段为外植体接种培养,结果只有茎段材料诱导形成了不定芽,进一步继代抽叶和诱导生根形成了完整的试管苗。说明黄花菜无菌苗的茎段可以再生为完整的组培苗,其培养途径为:去皮种子→无菌苗→茎段→不定芽→抽叶→生根→试管苗。同时发现,去皮的种子灭菌和萌发培养效果最好,MS培养基诱导不定芽的发生率最高。
试验中无菌苗的根段和叶段材料在4种培养基上单独诱导培养均没有任何形态变化,但植物细胞具有全能性,根和叶也具有培养成为完整植株的潜能[22]。今后可通过调整培养基激素种类和浓度及温、光、湿等条件,研究无菌苗的根、叶培养形成组培苗的方法和途径。此外,本研究仅对茎段诱导阶段所用培养基进行了筛选,继代和生根培养中适宜的培养基和激素配比对叶片形成、根系发生都具有重要影响,下一步需要针对该问题进行研究。
黄花菜的适应性很强,耐寒、耐旱、耐贫瘠,病虫害发生少,但生产中仍存在一些亟待改进的性状,如干旱时容易落蕾,对病毒和某些除草剂的抗性不强等[22]。利用组织培养技术可以提高花蕾品质和产量[23]。前人以黄花菜的根状茎、花器官等作为外植体进行组织培养获得成功[24-26],但是这些材料的取材和培养效果受到生长季节、材料的发育程度和生理状况等的影响,很难用于工厂化生产。利用种子萌发形成的无菌苗进行组织培养,不受时间限制,材料充足,能够培养形成完整植株,是一种简便易行的黄花菜植株再生方法,可进一步研究并建立其组织培养体系,为黄花菜的快速繁殖和工厂化育苗奠定基础。

