聚乙二醇浸种对高羊茅种子萌发的影响
霍可以, 刘 英, 向仰州, 岳雪娇, 姚 斌
(1.贵州省农业科学院农作物品种资源研究所, 贵阳 550006; 2.贵州师范学院生物科学学院, 贵阳 550018;3.贵州师范学院地理与资源学院, 贵阳 550018; 4.中国林业科学研究院荒漠化研究所, 北京 100091)
高羊茅又称苇状羊茅(FestucaarundinaceaL.),禾本科羊茅属多年生草种,是冷季型草坪草中的耐热草种,具有抗旱、抗病,绿期长,耐践踏、耐粗放管理等特性[1]。在我国城镇建设、高速公路绿化、退耕还林还草工程和矿业废弃地生态复垦等方面应用广泛[2-4]。但因国内高羊茅品质较差、优良品种缺乏、企业缺位等造成绝大多数高羊茅种子仍然依赖进口,且种子价格高昂[5]。鉴于此,采取适宜的方法提升高羊茅种子的发芽能力具有重要现实意义,国内已有学者尝试对此进行研究,并取得了一定的研究成果[1,6-7]。叶要妹等[6]采用GA3和KNO3处理高羊茅种子,发现0.2 mg·L-1的GA3浸种效果理想;朱旺生等[1]研究表明,0.2% NaClO和2.0% KNO3可以有效提高高羊茅的发芽率,其适宜播种温度为20 ℃。此外,适宜浓度的保水剂对提高高羊茅种子的萌发效率有积极作用[7]。
聚乙二醇(Polyethylene glycol,简称PEG)是一种高分子渗压剂和种子引发剂,预处理种子时通过渗透调节作用,促进种子缓慢吸水,增强细胞膜修复,减少营养物质渗漏,降低电导率,提高种子萌发速率,而其本身并不会渗入活细胞[8],故是一种较为理想的渗透调节剂和种子引发剂[9]。近年来,在种子萌发研究中,PEG(PEG-6000)处理已成为评价种子抗旱能力的重要标志[10-14],但评价不同分子量PEG在提高高羊茅种子萌发活力方面的报道较少[15],为了全面评价PEG对高羊茅种子萌发活力的影响,本实验采用正交设计,研究不同分子量PEG、不同浸种液浓度与不同浸种时间对3个高羊茅品种(维加斯,锐步和凌志Ⅱ)种子萌发的影响,为实际应用PEG作为渗透调节剂和种子引发剂促进高羊茅种子萌发活力提供科学依据和技术指导。
1 材料与方法
1.1 草种准备
供试高羊茅种子(维加斯、锐步和凌志Ⅱ)均购于百绿(天津)国际草业有限公司北京办事处,原产地美国。选取籽粒饱满、粒径相近的种子,并用0.5% KMnO4溶液消毒20 min[16],然后用去离子水冲洗3次,吸水纸吸干种子表面水分后备用。
1.2 PEG溶液制备
分别称取3个不同分子量(150 g、200 g、250 g)的PEG,加入盛有1 L去离子水的广口瓶中,轻轻振荡、摇匀,根据计算结果分别加入适量的去离子水配置成15%、20%和25%的PEG浸种液,备用。
1.3 试验设计
采用L9(34)正交试验设计进行研究,试验因素与水平见表1。

表1 PEG处理高羊茅种子实验因素与水平
1.4 种子处理
根据国际种子检验规程[17]。选取经过处理的备用种子放在预先做好标记且铺有2层滤纸的培养皿中,每个培养皿50粒种子,每个品种3次重复,保持种子间距一致。用移液管分别准确量取10 mL不同浓度的PEG溶液放入对应编号的培养皿中,用去离子水浸种作对照。PEG分子量、浸种浓度、浸种时间,对照处理时间为72 h。溶液浸种结束后用去离子水漂洗种子3次,吸水纸吸干种子表面水分,放入铺有2层滤纸且对应编号的培养皿中,加去离子水保湿供种子萌发需要,然后培养皿移至GXZ型光照培养箱(宁波江南仪器厂)进行培养。培养条件:温度(25±0.5)℃,光照12 h·d-1。培养箱每天打开换气2次,每次5 min。详细记录当天种子发芽数、未发芽数、腐烂粒及异状发芽粒。及时补水,水分以种子周围不出现水膜为度[6]。发芽标准按照国际种子协会(ISTA)规定,有明显的胚根“露白”认定为发芽[1]。
1.5 测定指标
以发芽势、发芽率、胚芽长、胚根长和苗干重作测试分析指标。
发芽势(%)=(发芽初期(规定日期内)正常发芽粒数/供试种子粒数)×100%,以第7天种子发芽数计算[15,18];
发芽率(%)=(发芽终期(规定日期内)全部正常发芽粒数/供试种子数)×100%,以第21天种子发芽数计算[15,18];
胚芽长和胚根长,直尺测量(精度0.05 mm);
干重,将幼苗放在80 ℃的恒温箱中烘干24 h后电子天平称重。
1.6 数据分析
对5个测试指标进行极差分析、方差分析和多重比较[19]。处理间平均数差异显著性的多重比较采用Duncan’s新复极差法,所有数据采用DPS 2000统计软件进行[20]。
2 结果与分析
2.1 不同处理对发芽势的影响
3个高羊茅种子发芽势极差大小顺序为RA>RD>RC>RB,影响发芽势的因素依次为品种>浸种品种>浸种浓度>浸种时间>PEG分子量(表4)。根据4因素均值最优组合为A3B3C2D1,即供试品种:凌志Ⅱ,PEG分子量为6000,浸种液浓度为20%。浸种时间为24 h(表3)。品种对发芽势的影响最大,浸种液浓度次之,浸种时间第三,三者差异均达到极显著水平(p<0.01);而PEG分子量的影响不明显。进一步作多重比较,品种间发芽势的高低顺序为A3>A2>A1,即凌志Ⅱ发芽势最高,锐步发芽势次之,而维加斯发芽势最低。浸种液浓度(C)的高低顺序为C2>C1>C3(表4)。C3与C2和C1之间差异极显著(p<0.01),C2和C1无显著差异,即PEG浸种液浓度为20%发芽势最高,15%次之,而25%最低。浸种时间(D)中D1与D2、D3之间差异均达到极显著水平(p<0.01),而D2与D3之间无显著差异。即浸种24 h发芽势最高,72 h次之,而48 h最低。与对照相比,维加斯的B2C2D2和B3C2D2对发芽势有抑制作用,抑制程度为6.00%~34.67%;而B1C1D1对发芽势产生促进作用,比对照高出15.33%。锐步、凌志Ⅱ各处理与对照比较,对发芽势的促进程度分别为15.33%~42.00%、8.27%~32.00%(表3)。
2.2 不同处理对发芽率的影响
4因素的极差大小顺序为RA>RC>RB=RD,表明其对发芽率影响作用的顺序为品种>浸种液浓度>PEG分子量=浸种时间(表2)。4个因素的最优组合为A3B3C2D1,即供试品种为凌志Ⅱ,PEG分子量为6000,浸种液浓度为20%,浸种时间为24 h(表3)。品种类型对发芽率的影响最显著,浸种液浓度次之,浸种时间和PEG分子量分别位居第三位和第四位,其对发芽率的影响差异均达到极显著水平(p<0.01)。进一步的多重比较结果显示品种发芽率为A2>A3>A1,即锐步的发芽势最高,凌志Ⅱ次之,而维加斯最低。PEG分子量(B)中B3与B1、B2之间皆存在极显著差异(p<0.01),而后两者无显著差异,即PEG-4000和PEG-2000对提高发芽率有促进作用。浸种液浓度(C)的高低顺序为C2>C1>C3(表4)。C3与C2、C1间均存在极显著差异(p<0.01),而C2和C1之间无显著差异,即PEG浸种液浓度为20%的发芽势最高,15%的次之,25%的最低。浸种时间(D)中D1与D2和D3之间差异达极显著水平(p<0.01),D2与D3之间无显著差异,即浸种时间为24 h发芽势最高,48 h次之,72 h最低。与对照相比,维加斯各处理对发芽率抑制程度为2%~56.96%。锐步的B3C1D2与对照比较,发芽势降低14.00个百分点;B1C2D3和B2C3D1发芽势比对照高10.67个百分点和12.00个百分点。与对照相比,凌志Ⅱ各处理对发芽率的促进程度为52.00%~68.67%(表3)。
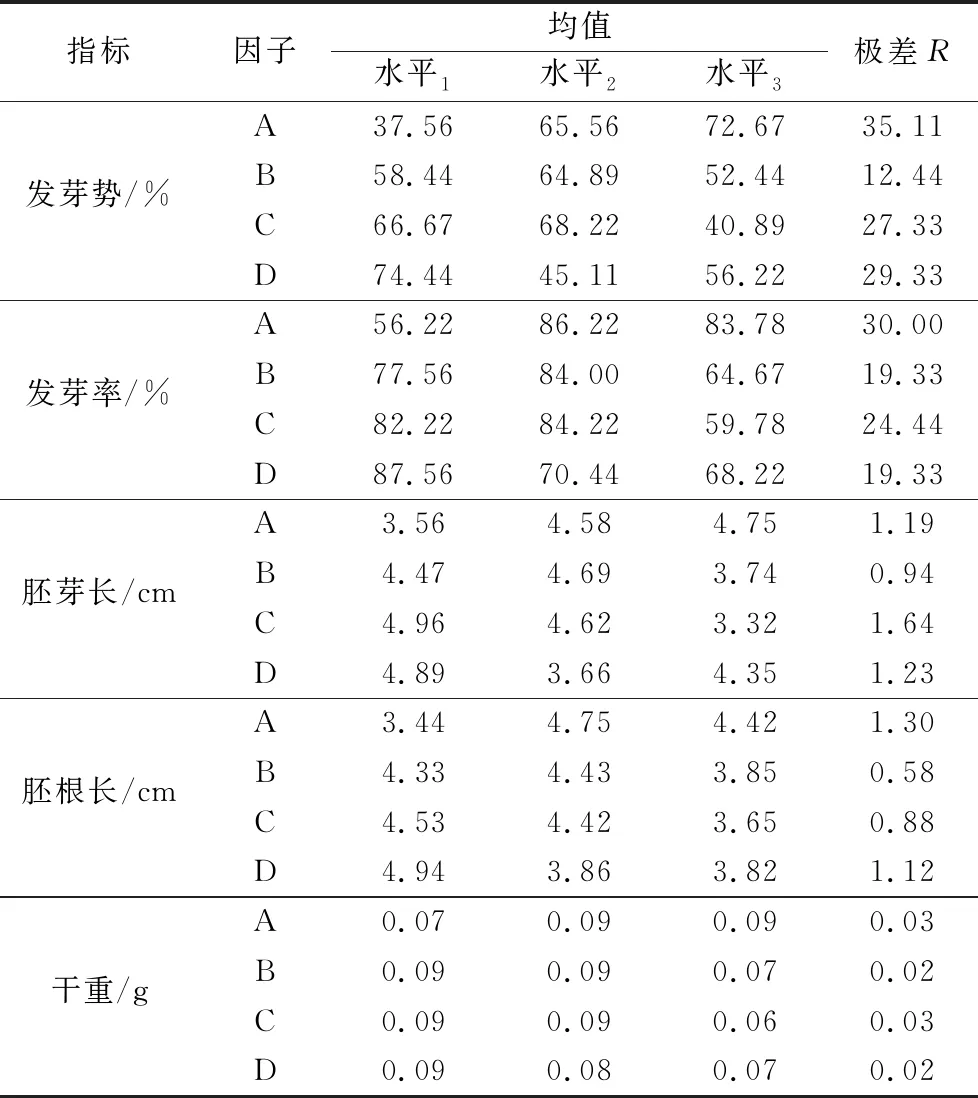
表2 PEG处理高羊茅种子极差分析结果

表3 PEG处理对高羊茅种子萌发状况的影响
2.3 不同处理对胚芽长的影响
胚芽长极差顺序为RC>RD>RA>RB,影响胚芽长的因素依次为浸种液浓度>浸种时间>品种>PEG分子量(表2)。4个因素的最优组合为A3B2C1D3,即供试品种为凌志Ⅱ,PEG分子量为4000,浸种液浓度为15%,浸种时间为72 h。浸种液浓度对胚芽长的影响差异极显著(p<0.01);品种和浸种时间的影响分别位居第二和第三,且二者差异显著(p<0.05);而PEG的分子量对胚芽长的影响不明显(表4)。进一步的多重比较结果显示,品种间胚芽的长短顺序为A3>A2>A1,即凌志Ⅱ的胚芽最长,锐步的次之,而维加斯的最短。浸种液浓度(C)影响排序为C1>C2>C3(表4)。C3与C2、C1间差异极显著(p<0.01),而C2和C1无显著差异,即PEG浸种液浓度为15%的胚芽最长,20%的次之,25%的最短。浸种时间(D)中D1与D2之间差异极显著(p<0.01),其他任意二者之间无显著差异,即浸种24 h胚芽最长,72 h次之,48 h最短。与对照相比,维加斯的B2C2D2和B3C2D2处理对胚芽抑制程度为1.30~2.84 cm,B1C1D1处理对胚芽的促进程度为0.07 cm。锐步和凌志Ⅱ与对照相比,各处理对胚芽长的促进程度分别为0.10~1.17 cm,0.93~3.47 cm(表3)。
2.4 不同处理对胚根长的影响
胚根长极差顺序为RA>RD>RC>RB。影响胚根长的因素排序为品种>浸种时间>浸种液浓度>PEG分子量(表2)。4个因子的最优组合为A2B2C3D1,即锐步+PEG-4000+浸种液浓度25%+浸种24 h。品种对胚根长的影响最大,其次是浸种时间,二者均达到显著差异水平(p<0.05);而浸种液浓度和PEG分子量对胚根长的影响不明显。4个因素对胚根长的影响显著性:品种>浸种时间>浸种液浓度>PEG分子量(表4)。多重比较分析结果(表4)显示,品种间胚根的长短顺序:A2>A3>A1,即锐步的胚根最长,凌志Ⅱ的次之,而维加斯的最短。浸种时间(D)中D1与D2和D3之间差异均达到显著水平(p<0.05),D2和D3之间无显著差异,即浸种24 h对胚根长效果最佳。与对照相比,维加斯3个处理对胚根的抑制程度在0.15~2.63 cm之间,锐步的B3C1D2处理对胚根的抑制程度为0.04 cm,B1C2D3和B2C3D1处理对胚根的促进程度为0.28~0.74 cm。凌志Ⅱ与对照相比,各处理对胚根长的促进程度为0.68~2.06 cm(表3)。
2.5 不同处理对干重的影响
干重极差顺序为RC>RA=RB=RD,由此得出干重的因素依次为浸种液浓度>品种=PEG分子量=浸种时间(表2)。4个因素最优组合为A2B1C2D3和A3B2C1D3即锐步+PEG-2000+浸种液浓度20%+浸种时间72 h和凌志Ⅱ+PEG-4000+浸种液浓度15%+浸种时间72 h。浸种液浓度对干重的影响作用最大,品种次之,而PEG分子量和浸种时间分别排第三和第四(表4)。进一步的多重比较结果(表4)表明,品种干重顺序为A3=A2>A1。A3、A2与A1之间差异极显著(p<0.01),即凌志Ⅱ和锐步的干重相等,且均大于维加斯干重。PEG的分子量(B)对干重影响为B2=B1>B3。B2、B1与B3之间差异均极显著(p<0.01),即PEG-4000和PEG-2000对干重有明显的促进作用。浸种液浓度(C)的高低顺序为C2=C1>C3(表4);C2、C1与C3之间差异极显著(p<0.01),即20%和15%的PEG浸种液浓度对干重的影响效果明显。浸种时间(D)中D1与D2之间差异达极显著水平(p<0.01),且二者均与D3差异显著(p<0.05),即浸种24 h对干重的促进作用显著。与对照相比,维加斯的B3C2D2对发芽势的抑制程度为0.04 g,而B1C1D1和B2C2D2处理对干重的促进作用比对照高0.01 g。锐步、凌志Ⅱ各处理与对照比较,对干重的促进程度分别为0.03~0.04 g和0.04~0.08 g(表3)。
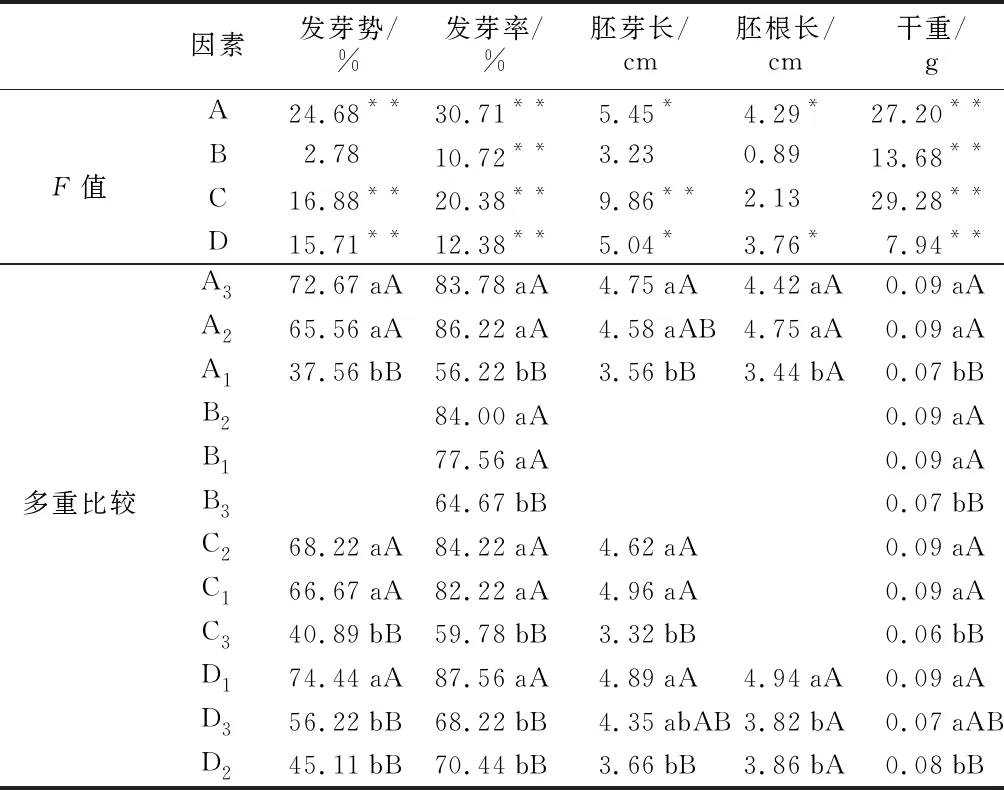
表4 PEG处理高羊茅种子萌发方差分析及多重比较
3 讨论与结论
植物在不同生长发育时期的抗逆性不同,是否能正常生长通常取决于种子萌发和成苗这2个关键阶段[21]。种子萌发期是植物生长史的关键时期之一,也是对外界环境十分敏感的时期,极易受到环境因子的影响[22]。水分是限制植物生长与分布的主要环境因素,同时也是限制种子萌发的主要生态因子。种子萌发时期极易受到水分的影响,如果水分条件差,将会导致种子死亡率上升,因此发芽率、发芽势、发芽指数、发芽速率、活力指数等反映种子萌发能力的常用评价指标可被用于衡量植物的抗逆性强弱,反映种子的萌发能力[23]。
影响种子萌发效果的因素有很多,如浸泡时间、培养温度、种子类型、贮藏年限以及引发剂种类等[24-25]。PEG是较理想的渗透调节剂和种子引发剂,可以提前启动萌发所需的物质代谢,使有害物质含量降低以及提高种子的发芽率[26]。近年来,在种子萌发研究中,PEG(PEG-6000)处理已成为评价种子抗旱能力的重要标志[10-14]。通常研究者在进行PEG对种子萌发影响研究时多考虑单因素对其影响,研究结果显示,PEG模拟干旱对蔬菜、花卉、水果种子发芽的影响表现出一定的差异性,有的种子随PEG浓度升高各指标处于下降趋势,而有的则呈低浓度促进高浓度抑制的趋势[10,27]。郑忠标,王澍[10]研究显示,PEG浓度低于5%时,对芡欧鼠尾草种子发芽具有促进作用;当PEG浓度高于5%时,会抑制芡欧鼠尾草种子的发芽,随着PEG浓度升高,芡欧鼠尾草种子的发芽指标呈先升高再降低的趋势。这一结果与朱灿灿等[27]的研究结果一致,而随着PEG浓度升高,芡欧鼠尾草种子根长呈整体下降趋势。王乐等[28]研究发现,马齿苋种子根长随PEG浓度的升高呈先升高再降低趋势。研究结果的不同可能与芡欧鼠尾草种子本身的特性有关。
为了全面评价PEG对高羊茅种子萌发活力的影响,本试验研究了不同分子量PEG、不同浸种液浓度与不同浸种时间对不同高羊茅品种(维加斯,锐步和凌志Ⅱ)种子萌发的影响。结果表明,PEG溶液浸种的3个高羊茅品种种子的发芽势、发芽率、胚芽长、胚根长、干重等5个指标与对照相比差异均达到显著水平(p<0.05),说明3个品种间有一定的差异性[6]。维加斯的所有指标均比凌志Ⅱ、锐步差。浸种液浓度为15%~20%对高羊茅萌发有促进作用,其中以20%的浓度比较明显;浸种24 h对锐步、凌志Ⅱ的发芽势、发芽率、胚芽长、胚根长、干重均有促进作用,这与马卉等[15]的存在区别,可能是因高羊茅品种的不同所致。以发芽率,胚根长和干重为评价标准,锐步的最佳浸种组合为:PEG-4000+25%(W∶V)浸种液+浸种24 h;以胚芽长和干重为衡量准则,凌志Ⅱ的较理想组合为:PEG-4000+15%(W∶V)浸种液+浸种24 h和PEG-4000+20%(W∶V)浸种液+浸种24 h。本研究未找到锐步的最佳浸种组合,有待进一步研究。

