右美托咪定抗缺血性心律失常作用及机制研究
郭悦平,刘 艳,刘 颖,于佳岐,王 超,周 杨,张海莹
(1. 海南医学院附属第一医院麻醉科,海南海口 570102;2. 海南医学院药学院、海南医学院热带转化医学教育部重点实验室,海南 海口 571199;3. 海南医学院第一临床学院,海南 海口 571199;4. 三亚中心医院,海南 三亚 572000;5. 哈尔滨医科大学药理教研室,黑龙江 哈尔滨 150081)
心律失常是心血管系统最常见的病症之一,同时也是心源性猝死的主要诱因。心血管疾病是全球第一大死亡原因[1,2]。据估计,到2030 年,每年将有2 360 万人死于心血管疾病[3]。各种原因导致的心肌缺血是围术期心律失常的重要诱因,其特点是发生率高,治疗难度大。除少部分心律失常首选电复律外,目前认为药物治疗仍是主要疗法。但由于许多药物缺乏注射剂型、起效缓慢、与麻醉药物相互作用、降低心肌收缩力、降低血压等问题,不适合围术期或术中使用。临床上仍然迫切需要适合围术期场景下使用的抗心律失常药物。
α2肾上腺素受体(α2-adrenergic receptor,α2-AR)为G 蛋白偶联受体超家族之一,在人类及其他哺乳动物体内均有表达。右美托咪定(dexmedetomidine,Dex)是一种高选择性α2肾上腺素受体激动剂,它作为中枢性镇静镇痛药被引入临床,主要用于围手术期镇静,镇痛,稳定血流动力学等[4-6]。然而,一些临床观察性研究发现,使用右美托咪定影响围术期心律失常的发生[7]。例如,在成人心脏手术围术期使用右美托咪定可以显著减少房颤及室性心动过速的发生率[8]。在儿童法洛四联征和完全性大动脉转位患者中右美托咪定可减少术后房颤发生[9]。而在另一项研究中,室间隔缺损修补术患者中给予右美托咪定可以减少交界性异位心动过速的发生[10,11]。我 们 在 临 床 实 践 中 发 现,α2受 体 激 动 剂 对某些类型的快速性心律失常具有治疗作用[12]。但是目前缺乏对α2受体激动剂用于治疗心律失常的机制研究,只有阐明其作用机制,才能明确适应证和禁忌证,在提高疗效的同时减少副作用的发生,安全用于围术期患者。因此,本研究采用体外分子生物学实验,旨在探究右美托咪定的抗心律失常作用及机制,以期为急性心肌梗死病程中缺血和再灌注心律失常的防治提供理论基础和实验依据。
1 材料与方法
1.1 实验动物
SPF 级雄性Wistar 大鼠,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,动物饲养在标准动物室条件下,温度为(23±1)°C,湿度为(55±5)%,给予适量的食物和水,通风良好。本课题动物的使用及实验过程均依照美国国立卫生研究院善待动物的实验准则,并得到海南医学院伦理委员会的批准。
1.2 实验材料及仪器
实验主要药物包括右美托咪定(江苏恒瑞医药股份有限公司),育亨宾(上海源叶生物科技有限公司),TTC 染色液(北京索莱宝科技有限公司)。主要仪器有小动物心电检测系统(美国Iworx 公司);小动物呼吸机(上海玉研科学仪器有限公司);可拍照光学显微镜(Olympus 公司);全细胞膜片钳(美国Axon 公司);电极控制仪(日本Narishige 公司)。
1.3 实验分组及给药
将50 只大鼠采用数字随机法分为假手术组(Ctl 组)、心律失常模型组(Model 组)、心律失常+右美托咪定组(Dex 组)、心律失常+育亨宾+右美托咪定组(Yoh + Dex 组)、心律失常+育亨宾组(Yoh 组),每组10 只。(1)假手术组:记录10 min 正常心电后,只穿线不结扎;(2)模型组:记录10 min正常心电后,结扎左冠状动脉前降支,持续记录心电2 h;(3)右美托咪定组:记录正常心电7 min 后,大鼠尾静脉注射右美托咪定(2.3 ng/mL),观察3 min后进行结扎;(4)育亨宾+右美托咪定组:记录正常心电,在给予右美托咪定的前2 min 给予育亨宾,其后操作同模型组;(5)育亨宾组:记录正常心电5 min,大鼠尾静脉注射育亨宾(7.8 mg/mL),5 min 后进行结扎,方法同模型组。
1.4 大鼠缺血性心律失常模型的建立
雄性Wistar 大鼠,戊巴比妥钠溶液(40 mg/kg)腹腔注射麻醉,仰卧固定于手术台上,接入生物机能实验系统,连续记录标准Ⅱ导联心电图。剔除小鼠胸前毛发,充分消毒后颈部正中开口,分离右侧颈总动脉,动脉插管后链接压力换能器,记录动脉血压,气管插管。开胸后接小动物人工呼吸机(潮气量6~10 mL,呼吸比1∶2,呼吸频率60 次/min),剪开心包膜,寻找左冠状动脉前降支,在其下穿线,待呼吸、血压平稳15 min 后,结扎左前降支,使其缺血30 min,以心电图ST 段抬高为结扎成功标志。实验结束后,迅速开胸,取下心脏,洗净并做简单修剪,立即进行检测,其余立即放入液氮中速冻,于-80 ℃冰箱中保存。
1.5 心电图记录
利用BL-420E 系统记录并分析心电图,统计心律失常出现时间,累积发生时间,室性期前收缩持续时间,房室传导阻滞出现及持续时间。根据心电图数据进行心律失常评分,统计给药前后RR 间期,PR 间期,QRS 间期以及QT 间期。计算校正QT 间期(QTc),公式QTc=QT/(RR/100)1/2。
1.6 心律失常评分方法
采用Curtis 和Walker 心率失常评分法:无心率失常0 分,偶发室性早搏1 分,频发室性早搏2 分,室性心动过速(1~2 次)3 分,室性心动过速(≥3 次)4分,室颤或死亡5 分。
1.7 TTC 染色测量心肌梗死面积
取大鼠心脏组织,放于-20 ℃冰箱中速冻20 min,然后切成2 mm 薄片。将切片置于1%的TTC溶液中,放于37 ℃烘箱15~30 min,避光,取出已染色的切片放于4%多聚甲醛溶液中固定12 h 后,拍照,观察染色结果,非梗死心肌组织为红色,缺血坏死心肌组织为苍白色。应用Image 软件分析测量缺血面积,计算缺血面积占心室面积百分比。
1.8 成鼠心肌细胞急性分离
成鼠经腹腔麻醉15 min 后,打开胸腔,迅速取出大鼠心脏,置于含钙的4 ℃台式液中,主动脉插入导管并与Langendorff 灌流装置连接,该过程注意防止灌流装置和导管连接处进气泡,灌流装置保持恒温37 ℃。心脏经无钙台式液灌流,待灌流速度稳定后,向灌流液中加入含有Ⅱ型胶原酶(1 mg/mL)和牛血清蛋白(BSA,0.75 mg/mL)的无钙台式液。随着灌流进行,在胶原酶作用下,心脏组织逐渐变软,失去弹性,待灌流液滴速出现明显增快现象时,取下心脏,停止灌流,将心脏左室置于含有CaCl2(200 μmol/L)和BSA(1%)的有钙台式液中,轻轻剪碎心脏组织成小块,100 目滤网过滤,滤液中的细胞即为分离得到的心肌细胞,显微镜下呈长杆状或矩形,条纹清晰,棱角分明,少部分细胞可自发性收缩。
1.9 全细胞膜片钳实验
首先,采用两步法拉制电极,使得拉制后,电极入液阻值在2~3 MΩ。实验开始前将灌注有电极内液的电极安装在夹持器上,并在浴槽中加入测钙外液。使得整个膜片钳系统预热0.5 h,减少电极漂移。打开Multiclamp 700B 控制面板和记录软件,将急性分离的大鼠心肌细胞转移至倒置显微镜(IX-70,Olympus)操作台上的浴槽内。实验前给予900 pA,10 ms,1 Hz 的刺激5 min,选择静息电位小于-70 mV 的细胞进行试验,记录稳定后各组心肌细胞的动作电位。
1.10 统计学处理
所有数据两组间比较应用非配对t检验,多组间差异比较应用单因素方差分析(ANOVA)的方法进行统计学分析。使用Graphpad Prism 7.0 软件进行数据分析及图表制作,所有数据以(xˉ±s)形式表示,P<0.05 为差异具有统计学意义。
2 结果
2.1 建立大鼠缺血性心律失常模型
采取结扎左冠脉前降支的方法建立大鼠室性心律失常模型,大鼠正常窦性心律(图1A),左冠脉结扎后可见心电图ST 段明显升高出现二联律(图1B),然后逐渐加重,出现多源性室早、短阵性室速,继而发展为持续性室性心动过速(图1C),甚至室颤(图1D)。证明缺血性心律失常模型建立成功。
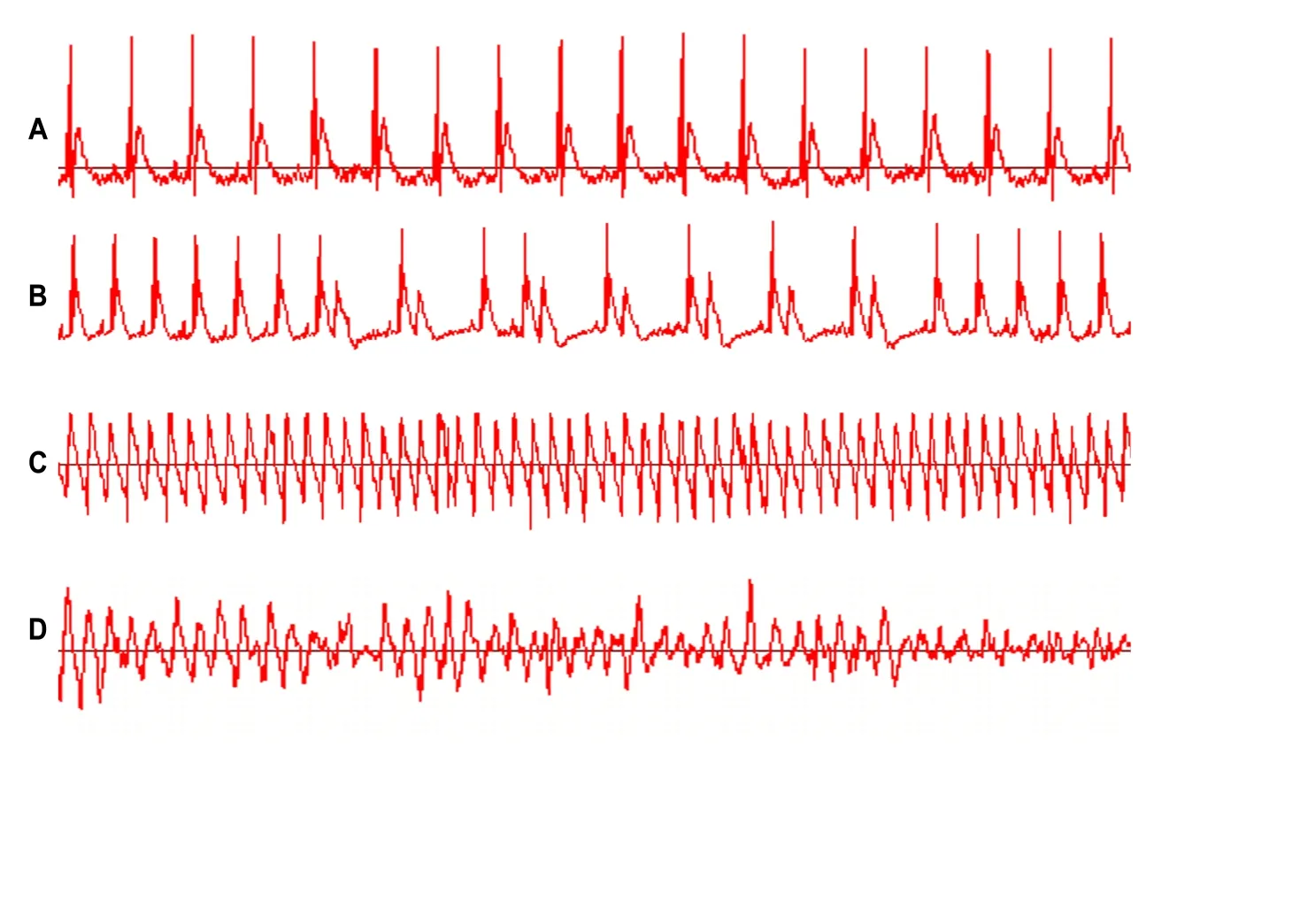
图1 各型心律失常心电图Fig 1 Arrhythmia results
2.2 筛选药物浓度
建立大鼠缺血性心律失常模型前给予Dex-10(2.3 ng/mL)、Dex-5(1.25 ng/mL)、Dex-1(0.23 ng/mL)3 种不同浓度的右美托咪定。对于心律失常的严重程度进行评分,如表1 所示,Dex-5 和Dex-1 预处理均能显著降低心律失常评分,其中以Dex-10 组效果最明显(F=25.87,P<0.001);同时给予高浓度的右美托咪定Dex-10 后,能明显降低房室传导阻滞(atrioventricular block,AVB)的 持 续 时 间(F=110.54,P<0.001),且这种作用也呈浓度依赖性。证明右美托咪定降低心律失常评分及房室传导阻滞具有浓度依赖性,并且Dex-10 对这种改变效果最显著。
表1 各组心律失常评分和房室传导阻滞情况(n=6,±s)Tab 1 Arrhythmia score and the occurrence of AVB(n=6,±s)
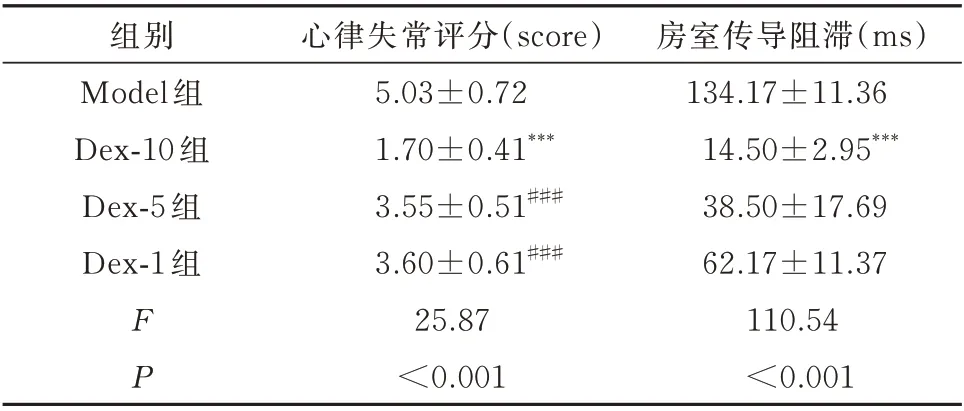
表1 各组心律失常评分和房室传导阻滞情况(n=6,±s)Tab 1 Arrhythmia score and the occurrence of AVB(n=6,±s)
注:与Model 组比较,***P<0.001,与Dex-10 组相比,###P<0.001。
房室传导阻滞(ms)134.17±11.36 14.50±2.95***38.50±17.69 62.17±11.37 110.54<0.001组别Model 组Dex-10 组Dex-5 组Dex-1 组FP心律失常评分(score)5.03±0.72 1.70±0.41***3.55±0.51###3.60±0.61###25.87<0.001
2.3 激动α2 受体可以降低心律失常评分及死亡率
建立大鼠缺血性心律失常模型前给予右美托咪定Dex-10(2.3 ng/mL),育亨宾于结扎前5 min 尾静脉注射7.8 mg/mL。对于心律失常的严重程度进行 评 分,Dex 组 明 显 低 于 模 型 组(F=12.98,P<0.001),给予α2受体阻断剂育亨宾后评分增加,右美托咪定抗心律失常作用被阻断;给予右美托咪定后,大鼠的死亡率较模型组降低20%,而育亨宾可以逆转右美托咪定的保护作用,见表2。证明右美托咪定可以减少室性心律失常的发生,并且这一作用是通过激动α2受体实现的。
表2 各组心律失常评分及大鼠死亡率(±s)Tab 2 Arrhythmia score and morality rate(±s)

表2 各组心律失常评分及大鼠死亡率(±s)Tab 2 Arrhythmia score and morality rate(±s)
注:与Model 组相比,*P<0.05,***P<0.001。
组别Model 组Dex-10 组Yoh 组Yoh+Dex 组统计量P大鼠死亡率(%)0.20 0.00*0.25 0.22—<0.05 n 8 10 6 7心律失常评分(score)5.03±0.72 1.70±0.41***5.02±1.09 4.70±1.33 12.98<0.001
2.4 激动α2受体减少心肌梗死面积
TTC 染色后,正常心肌组织呈鲜红色,而梗死的心肌组织呈白色。统计心肌梗死面积,用梗死区(苍白区)面积/全心面积(砖红色区+苍白区)的百分比(IS%)表示。大鼠右美托咪定预处理后,其心肌 梗 死 面 积 明 显 低 于Model 组(F=13.11,P<0.05),而Yoh 组逆转右美托咪定作用,使梗死面积增加,见表3。综上结果表明,右美托咪定能有效抑制大鼠缺血造成的心肌梗死,具有心肌保护作用。
表3 各组梗死区域面积定量分析(%,n=6,±s)Tab 3 Quantitative analysis of myocardial infarction size in each group(%,n=6,±s)
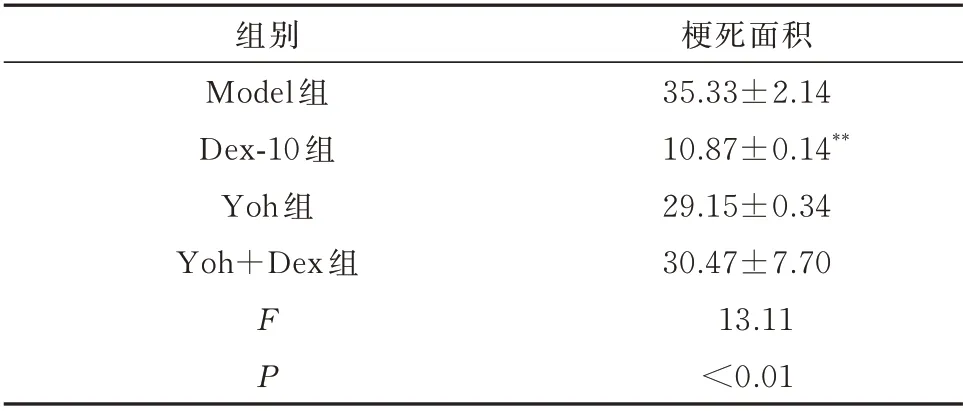
表3 各组梗死区域面积定量分析(%,n=6,±s)Tab 3 Quantitative analysis of myocardial infarction size in each group(%,n=6,±s)
注:与Model 组相比,**P<0.01。
梗死面积35.33±2.14 10.87±0.14**29.15±0.34 30.47±7.70 13.11<0.01组别Model 组Dex-10 组Yoh 组Yoh+Dex 组FP
2.5 激动α2受体缩短QT 间期
对给予右美托咪定前后检测的心电图进行分析,通过两个心室兴奋传播过程的电位变化显示右美托咪定对于结扎前心脏的QTc、PR、QRS、RR 间期并未产生影响(P>0.05),见表4。同时右美托咪定对于结扎左前降支后心脏的PR、QRS、RR 间期也并未产生影响(P>0.05),但是可以缩短结扎后QTc 间期(F=9.41,P<0.01),见表5。以上结果证明激动α2受体会影响动作电位的复极过程。
表4 手术前心电图检测结果(ms,n=6,±s)Tab 4 Preoperative ECG measurements(ms,n=6,±s)
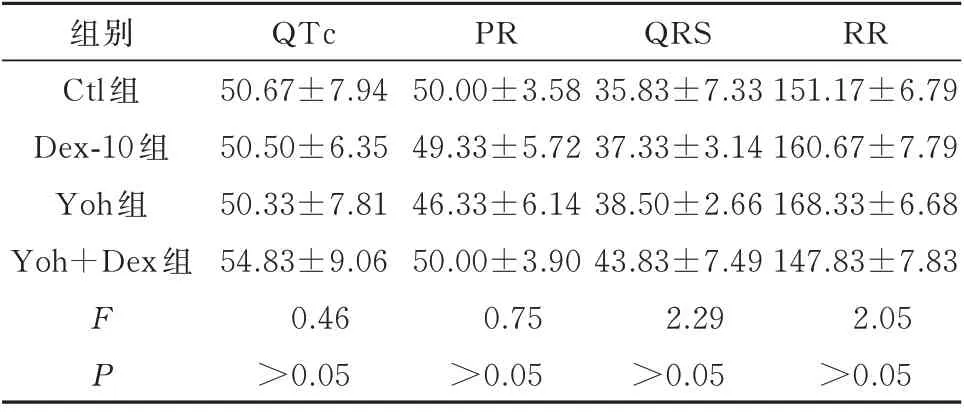
表4 手术前心电图检测结果(ms,n=6,±s)Tab 4 Preoperative ECG measurements(ms,n=6,±s)
组别Ctl 组Dex-10 组Yoh 组Yoh+Dex 组FP QTc 50.67±7.94 50.50±6.35 50.33±7.81 54.83±9.06 0.46>0.05 PR 50.00±3.58 49.33±5.72 46.33±6.14 50.00±3.90 0.75>0.05 QRS 35.83±7.33 37.33±3.14 38.50±2.66 43.83±7.49 2.29>0.05 RR 151.17±6.79 160.67±7.79 168.33±6.68 147.83±7.83 2.05>0.05
表5 手术后心电图检测结果(ms,n=6,±s)Tab 5 Postoperative ECG measurements(ms,n=6,±s)
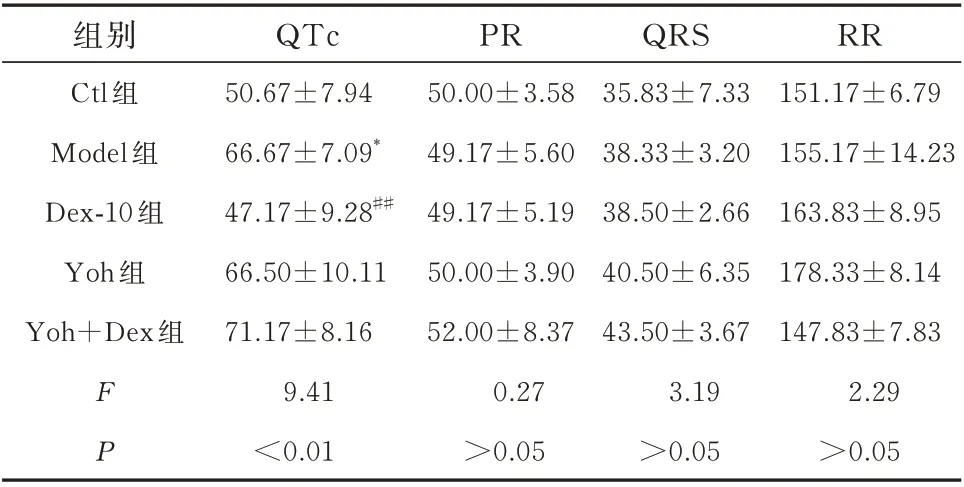
表5 手术后心电图检测结果(ms,n=6,±s)Tab 5 Postoperative ECG measurements(ms,n=6,±s)
注:与Ctl 组相比,*P<0.05,与Model 组相比,##P<0.01。
RR 151.17±6.79 155.17±14.23 163.83±8.95 178.33±8.14 147.83±7.83 2.29>0.05组别Ctl 组Model 组Dex-10 组Yoh 组Yoh+Dex 组F P QTc 50.67±7.94 66.67±7.09*47.17±9.28##66.50±10.11 71.17±8.16 9.41<0.01 PR 50.00±3.58 49.17±5.60 49.17±5.19 50.00±3.90 52.00±8.37 0.27>0.05 QRS 35.83±7.33 38.33±3.20 38.50±2.66 40.50±6.35 43.50±3.67 3.19>0.05
2.6 激动α2受体缩短动作电位时程
通过全细胞膜片钳技术对给予右美托咪定前后动作电位时程(action potential duration,APD)进行检测,结果显示,正常组心肌细胞动作电位复极50% 和90% 的 时 间(APD50和APD90)分 别 为(138.00±8.60)ms 和(174.67±11.95)ms,Dex 处理组APD50和APD90分别为(107.66±5.79)ms 和(154.33±11.84)ms,Dex 可以明显缩短APD50(t=4.136,P<0.05)与APD90(t=2.83,P<0.05),见 表6。综上结果进一步表明,右美托咪定激动心脏α2受体后影响心肌细胞动作电位的复极化过程,进而抑制心律失常的发生。
表6 右美托咪定对大鼠心肌细胞APD 的影响(ms,n=3,±s)Tab 6 Alterations of action potential duration after dex preconditioning(ms,n=3,±s)

表6 右美托咪定对大鼠心肌细胞APD 的影响(ms,n=3,±s)Tab 6 Alterations of action potential duration after dex preconditioning(ms,n=3,±s)
注:与Ctl 组相比,*P<0.05。
APD90 174.67±11.95 154.33±11.84*2.83<0.05组别Ctl 组Dex 组t P APD50 138.00±8.60 107.66±5.79*4.136<0.05
3 讨论
右美托咪定通过激活中枢α2受体减少交感神经活动,发挥心血管调节作用。最近有研究表明在心肌组织中也存在A 和C 两种α2受体亚型。预先给予右美托咪定可以激动心肌α2受体,减少心肌梗死面积,增加冠脉血流量,产生心肌保护作用[13]。个别临床研究也显示右美托咪定可通过多种信号通路起到心肌保护作用[14]。临床实践中发现,α2受体激动剂对某些类型的快速性心律失常具有预防和治疗作用[12,15]。总之,有限的临床研究中包括不同的患者群及不同临床场景,疗效报道结果不一致,有时甚至有导致心律失常发生的作用。例如,有研究认为右美托咪定并不能降低房颤发生率,甚至可能增加有房颤病史患者再发[16,17]。上述研究中涉及的患者多为心脏外科手术,大都因进行体外循环经历心肌缺血,但是病种及年龄存在的差异可能产生心肌结构和离子通道表达的区别,即在各自病理情况下心肌已发生某种程度的结构重建和电重建,这也是导致对右美托咪定抗心律失常作用改变的原因,表现为临床报道疗效不一致。所以,阐明右美托咪定治疗心律失常的机制,对于判定α2受体激动剂适用于哪些类型心律失常的治疗、何种情况下具有致心律失常作用非常关键。
本研究观察到给予大鼠α2受体激动剂右美托咪定后可显著降低心肌缺血导致的室性心律失常评分及死亡率,而这种作用可被α2受体阻断剂育亨宾所阻断。证明激活α2受体具有一定抗心律失常作用。但同时右美托咪定的另一种更为重要的抗心律失常机制也可能存在:直接作用于心肌α2受体,影响到心肌细胞的动作电位过程,进而减少心律失常的发生。
心肌细胞膜离子通道表达或功能异常是形成心律失常最重要的病理生理基础[18,19]。药物作用于离子通道可以起到对抗或导致心律失常的作用,离子通道遗传基因的变异和多态性会影响到药物对心肌细胞的作用。参与心肌细胞动作电位产生的通道主要有钠通道,钙通道,钾通道等,分别发挥重要作用[20]。心肌复极化过程主要与钙离子和钾离子通道有关,一项临床观察分析了儿童的12 导联心电图,发现给予右美托咪定后心率校正的QTc 间期缩短[21]。据此推测,激动α2受体可能作用于动作电位复极过程,影响参与复极的相关离子通道和电流来产生抗心律失常作用。本研究通过对比大鼠给予右美托咪定前后心电图显示,激动α2受体可以缩短QTc 间期,而对P-R、QRS、R-R 间期未产生影响。其次,本研究采用全细胞膜片钳技术检测了激动α2受体后动作电位时程的变化,结果显示APD50与APD90同样被缩短。表明α2受体影响动作电位复极化过程,进而产生抗心律失常作用。
综上所述,本研究发现右美托咪定通过激活心脏α2受体,影响动作电位的复极化过程,进而减少缺血性心律失常的发生。该研究结果为α2受体激动剂作为抗心律失常药物在围术期合理应用奠定坚实的理论基础,有助于明确其适应证和禁忌证,提高临床疗效,降低副作用发生率。同时,也为未来此类药物研发提供了基础。但目前本研究虽然提出了α2受体是围术期心律失常治疗新靶点,但仍需进一步明确α2受体调控离子通道表达及电流变化的分子机制,以期解析心律失常的发病机制,为制定更好的治疗方案提供依据。

