子宫腺肌病患者内膜组织淋巴增强结合因子1、β-连环素表达及临床意义
黄先华 刘 婷 王 青
湖北省宜昌市夷陵区妇幼保健院(443000)
子宫腺肌病是育龄妇女常见病,子宫内膜间质及腺体侵入子宫肌层生长,同时伴有周围平滑肌细胞代偿性增生及肥大[1]。可降低女性生育能力,严重危害妇女生殖健康及生活质量[2]。因此,寻找子宫腺肌病发病相关因子,探寻其发病机制,进而制定有效治疗方案成为临床需要。淋巴增强结合因子1(LEF1)在多种癌症中异常表达,与癌症发生发展密切相关[3]。Matt等[4]研究表明,LEF1过表达与子宫内膜癌前腺体有关。β-连环素(β-catenin)是一种转录共调节因子,作为Wnt/β-catenin信号通路中的核心分子,可能在子宫内膜异位症中发挥重要作用[5]。LEF1、β-catenin虽均与子宫内膜病变有关,但二者在子宫腺肌病中的作用有待进一步探究。因此,本研究通过探究子宫腺肌病患者在位、异位内膜组织中LEF1、β-catenin的表达及与临床特征关系,为子宫腺肌病发病机制研究提供理论基础。
1 资料与方法
1.1 一般资料
选取2019年1月-2020年3月因子宫腺肌病于本院就诊并行子宫切除术(切除时间均为月经结束后10天)的89例患者为研究对象,收集患者痛经、月经量、子宫病灶大小等临床资料,以内膜组织在位或异位分为在位内膜组与异位内膜组;同期宫颈原位癌患者86例正常子宫内膜组织作为对照组。纳入标准:①符合子宫腺肌病诊断标准[6],且经术后病理证实;②术前1个月内未接受激素类药物治疗;③临床资料完整;④无肝脏疾病、糖尿病及恶性肿瘤;⑤符合伦理学标准,受试对象均签署知情同意书。排除标准:①存在内分泌及免疫代谢性疾病;②伴有急性炎症;③生殖器官发育不良。本研究经本院伦理委员会审批。
1.2 主要试剂与仪器
RNA提取试剂盒(上海恒斐生物科技有限公司);反转录试剂盒(购自上海振誉生物科技有限公司);SYBR Premix Ex Taq Ⅱ(北京百奥创新科技有限公司);Rox reference dye(南京北鱼生物科技有限公司);免疫组化试剂盒(德国Roche公司);LEF1抗体(购自武汉菲恩生物科技有限公司);β-catenin抗体(武汉益普生物科技有限公司)。qRT-PCR仪(美国Applied Biosystems公司)。
1.3 研究方法
1.3.1样品采集及保存行子宫切除术时取子宫腺肌病患者在位、异位内膜组织以及宫颈原位癌患者正常子宫内膜组织后立即处理,所有组织标本均采用4%多聚甲醛固定、石蜡包埋、连续切片,置-80℃保存待测。
1.3.2内膜组织LEF1 mRNA、β-catenin mRNA检测采用RNA提取试剂盒提取内膜组织总RNA,反转录得cDNA。采用实时荧光定量PCR(qRT-PCR)仪对目的基因LEF1、β-catenin和内参GAPDH进行扩增。反应体系共10 μl:cDNA模板(50 ng/μl)1 μl,SYBR Premix Ex Taq Ⅱ(2×)5 μl,Rox reference dye(50×)0.2 μl,ddH2O 3.0 μl,上下游引物(10 μM)各0.4 μl,引物由上海生工生物工程公司设计并合成,引物序列见表1。反应条件:95℃ 5 min;94℃ 5 s,58℃ 30 s,72℃ 20 s,40个循环。样品重复3次,采用2-△△CT法对LEF1 mRNA、β-catenin mRNA表达水平进行相对定量分析。
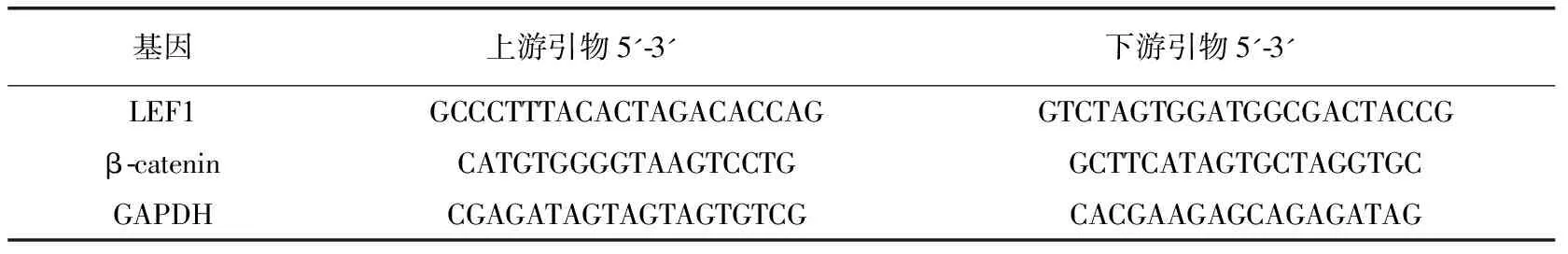
表1 qRT-PCR引物序列
1.3.3内膜组织LEF1、β-catenin蛋白检测采用免疫组织化学法检测内膜组织LEF1、β-catenin蛋白表达情况。10%甲醛固定标本后,梯度脱水、透明、浸蜡、包埋及切片(4 μm)。依据免疫组化试剂盒常规操作(一抗为LEF1、β-catenin抗体),对组织切片染色,随机选5个高倍镜视野观察,采取半定量法评分,按染色强度计分:棕褐色3分,棕黄色2分,浅黄色1分,无色0分;按照阳性细胞率计分,阳性细胞百分数≥76%为4分,51%~75%为3分,26%~50%为2分,6%~25%为1分,≤5%为0分。将两项得分相乘,总分<5分为阴性(-),≥5分为阳性(+)。每张切片分别由2名病理科医师判读。
1.4 统计学分析

2 结果
2.1 LEF1 mRNA、β-catenin mRNA表达水平
子宫腺肌病组患者年龄(45.8±4.7)岁(31~50岁),对照组患者年龄(44.6±5.0)岁(31~50岁),两组患者年龄比较无差异(P>0.05)。子宫腺肌病患者中, LEF1 mRNA、β-catenin mRNA表达水平异位内膜组最高、在位内膜组居中、对照组最低(P<0.05)。见表2。
表2 各组LEF1 mRNA、β-catenin mRNA表达水平比较
2.2 LEF1、β-catenin蛋白表达情况
LEF1、β-catenin蛋白阳性表达率异位内膜组最高、在位内膜组居中、对照组最低(P<0.05)。见表3、图1(1542页)、图2(1542页)。

表3 各组LEF1、β-catenin蛋白阳性表达比较[%(例)]
2.3 不同内膜组织LEF1 mRNA与β-catenin mRNA表达水平相关性
子宫腺肌病患者在位、异位内膜组织LEF1 mRNA与β-catenin mRNA表达水平均呈正相关(r=0.475、0.658,P<0.05);对照组内膜组织LEF1 mRNA与β-catenin mRNA表达水平无相关性(r=0.151,P>0.05)。见图3(1542页)、图4(1542页)、图5(1542页)。
2.4 子宫腺肌病不同内膜组织LEF1、β-catenin蛋白表达与临床特征关系
根据子宫腺肌病患者在位或异位内膜组织LEF1、β-catenin蛋白阳性表达情况,将其分为LEF1阳性表达组、LEF1阴性表达组及β-catenin阳性表达组、β-catenin阴性表达组。结果显示,在位、异位内膜组织中LEF1、β-catenin蛋白表达水平与其患者月经量、痛经无关(P>0.05);LEF1、β-catenin阳性表达组与阴性表达组患者的子宫大小/腺肌病灶比较有差异(P<0.05)。见表4、表5。
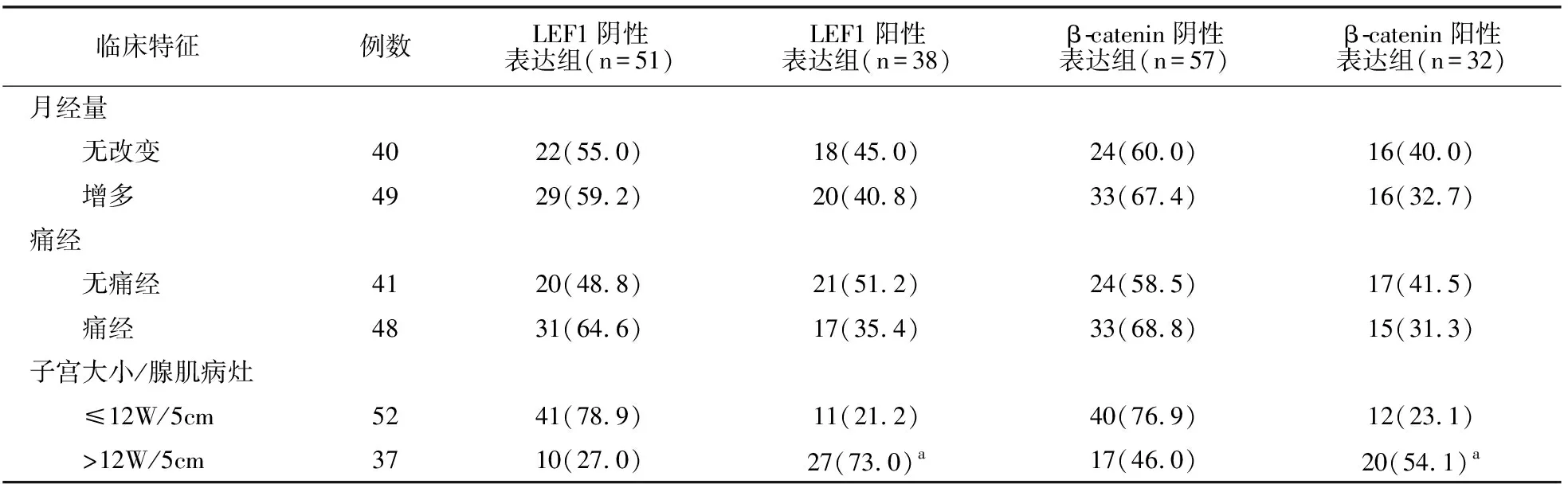
表4 子宫腺肌病在位内膜组织蛋白表达与临床特征关系[例(%)]
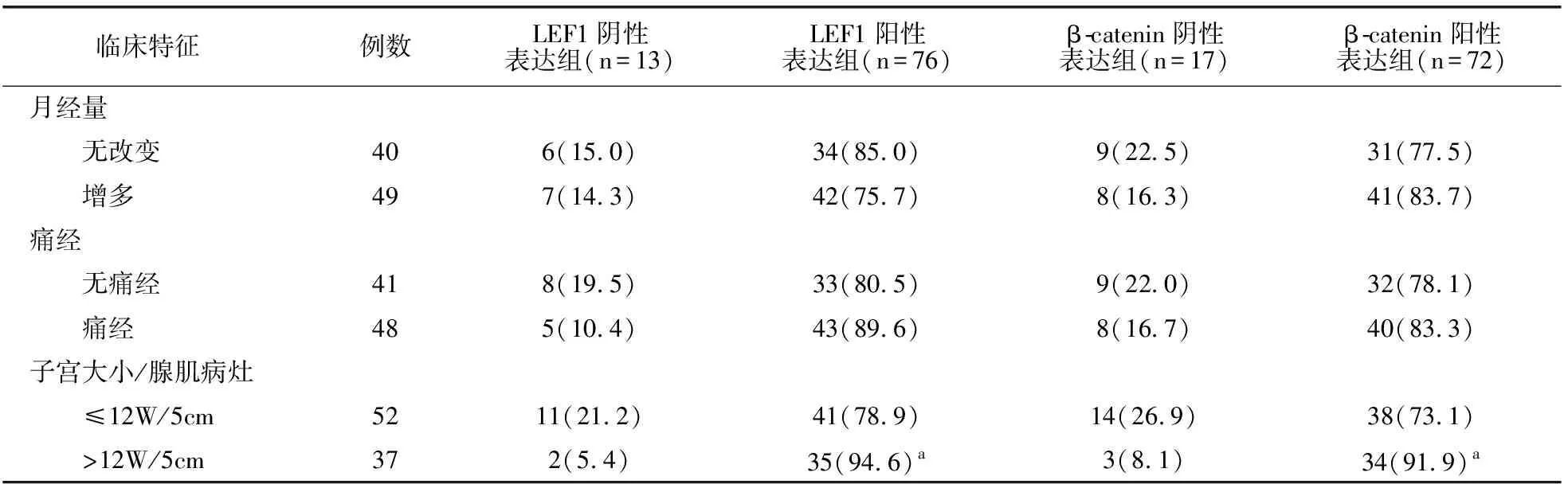
表5 子宫腺肌病异位内膜组织蛋白表达与临床特征关系[例(%)]
3 讨论
子宫腺肌病的发病率近年来有上升趋势,其主要临床症状有月经不调、痛经及不孕等[7]。目前国内外研究学者从遗传学、免疫学、流行病学等各角度对子宫腺肌病进行研究,但因其发生发展涉及孕产史、宫腔操作史、细胞凋亡、性激素以及血管生成等多方面因素,因此目前子宫腺肌病发病机制仍不十分明确[8]。目前研究表明,子宫腺肌病临床症状的严重程度与异位病灶的渗透深度有关,而异位病灶的渗透又与周围血管的建立及扩展有关[9]。因此,探究异位病灶内血管生成相关调控因子,可能对子宫腺肌病的研究有重要意义。
LEF1是T细胞转录因子家族成员,属于Wnt/β-catenin信号通路下游效应分子之一[10]。LEF1有双向调节功能,一方面能与β-catenin结合后形成转录复合体,参与活化Wnt信号通路下游多种靶基因的转录过程;另一方面可募集协同抑制因子,抑制转录的执行[11]。朱小琳等[12]研究表明,Wnt/β-catenin信号通路激活后,通过活化其下游相关靶基因表达,促使细胞生长和分化,进而促进异位内膜细胞的侵袭、黏附和血管生成,参与子宫内膜异位症的发生发展。另有研究表明,LEF1在造血干细胞的维持、增殖及分化等方面发挥较重要作用,进而参与造血调控及血管新生[13]。本研究结果显示,子宫腺肌病患者的异位内膜组织中LEF1、β-catenin mRNA表达水平及蛋白阳性表达率均高于在位内膜组织和对照组,且在位、异位内膜组织LEF1 mRNA与β-catenin mRNA表达水平均呈正相关。提示LEF1、β-catenin高表达可能参与了异位病灶的发生发展,推测患者处于病理状态时Wnt/β-catenin信号通路被活化,β-catenin降解减少,异位内膜组织中β-catenin表达量增多,β-catenin与下游转录因子LEF1结合形成转录复合体,发挥调控靶基因转录的作用,进一步参与血管新生。
白冀蓉[14]及Li等[15]研究表明,子宫腺肌病患者多出现痛经及月经量增多等临床症状。有研究证实,子宫腺肌病患者月经量增多是由于子宫内膜功能层毛细血管面积及数量增多,痛经是由于异位病灶内血管增多后使得异位病灶进一步侵入和扩展[16-17]。本研究结果显示,LEF1、β-catenin表达与痛经及月经量增多无关,可能与本研究纳入患者量少及不同地区差异有关,需进一步丰富样本量验证。此外,本研究中LEF1、β-catenin表达与子宫大小/腺肌病灶有关。提示LEF1、β-catenin高表达与子宫体积增大及异位病灶扩展有关,推测LEF1、β-catenin表达量增多后可能参与了患者血管新生,而异位病灶内血管增多会进一步促进异位病灶的侵入和扩展。
综上所述,LEF1、β-catenin在子宫腺肌病患者在位、异位内膜组织中表达水平均高于正常子宫内膜组织,且在异位内膜组织中变化更为显著,二者可能以不同的方式协同促进子宫腺肌病病情发生发展。有望LEF1、β-catenin成为一组有潜力的子宫腺肌病诊断标志物,但本研究结果可能因为样本量及所选样本地区而存在一定差异,尚需结合细胞分子实验及动物实验进一步深入分析。

