炎性因子联合CD4在炎症性肠病患者中的表达及与肠道菌群的关系研究
杨文宏,孙惠芳,邱 方*
(1.秦皇岛市第一医院 内科ICU;2.秦皇岛市第一医院 重症医学科一科,河北 秦皇岛066000)
炎症性肠病是一种累及回肠、直肠及结肠的特发性肠道炎症性疾病,包括:溃疡性结肠炎和克罗恩病两种[1]。目前,临床上对于炎症性肠病发病机制尚未阐明,其发病多与环境、免疫因素、感染及遗传有关,临床表现为腹痛、腹泻及血便等[2]。既往研究表明[3],炎症性肠病的发生多与炎性因子、免疫水平有关,如:白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、超敏C反应蛋白(hs-CRP)及T淋巴细胞等有关。在正常生理状态下,肠道菌群处于动态平衡,而当机体免疫抵抗力降低、长期服用广谱抗生素等,均会引起肠道菌群紊乱[4]。研究表明[5],肠道菌群异常常伴有肠道免疫耐受,可造成机体免疫功能异常,增加肠道炎症发生率。但是,临床上炎症性肠病患者肠道菌群与机体炎性因子及免疫功能的关系研究较少。因此,本研究以炎症性肠病患者及健康体检者为对象,探讨炎性因子联合CD4在炎症性肠病患者中的表达及与肠道菌群的关系,报道如下。
1 资料与方法
1.1 临床资料
选择2019年5月-2021年2月炎症性肠病患者157例设为观察组,根据疾病类型分为克罗恩病组和溃疡性结肠炎组。克罗恩病89例,男51例,女38例,年龄(22-61)岁,平均(43.69±4.51)岁;体质量指数(BMI)(18-29)kg/m2,平均(23.52±3.26)kg/m2;病程(1-8)周,平均(4.27±0.41)周;溃疡性结肠炎68例,男41,女27例,年龄(23-62)岁,平均(44.11±4.57)岁;BMI(19-30)kg/m2,平均(24.18±3.32)kg/m2;病程(1-9)月,平均(4.31±0.45)月;选择同期健康体检者53例设为对照组,男31例,女22例,年龄(24-66)岁,平均(45.64±6.42)岁;BMI(17-28)kg/m2,平均(24.97±3.31)kg/m2。
1.2 纳入、排除标准
纳入标准:(1)符合炎症性肠病诊断标准[6],均经临床检查确诊;(2)均完成炎性因子、CD4及肠道菌群测定,且患者均可耐受;(3)具有较为完整的检查报告单及随访资料。排除标准:(1)精神异常、血液系统疾病或自身免疫系统性疾病;(2)其他炎性疾病或结肠切除术患者;(3)凝血功能异常、严重肝肾异常者。
1.3 方法
1.3.1炎性因子及CD4测定
(1)标本采集。观察组住院次日取外周空腹血3 ml,对照组健康当天取3 ml外周空腹血,30 min离心,速度4 500 rpm,操作完毕后置于低温下备用;(2)检测方法。采用酶联免疫吸附试验测定患者白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)水平;采用免疫比浊法测定患者超敏C反应蛋白(hs-CRP)水平;采用流式细胞仪测定患者CD4+T淋巴细胞水平,试剂盒均购自于美国RayBiotech公司,所有操作均遵循仪器说明书完成[7]。
1.3.2肠道菌群测定
(1)肠道菌群测定。采用实时荧光定量PCR法检测3组肠道菌群总负荷及2种肠道益生菌(如:双歧杆菌、乳酸杆菌)及6种肠道致病菌(大肠杆菌、葡萄球菌、韦荣球菌、幽门螺杆菌、链球菌、铜绿假单胞菌)水平。采集粪便300 mg(中段粪便),根据粪便细菌基因组DNA提取试剂盒(购自于北京天根生化科技有限公司)说明书完成粪便细菌DNA,并完成PC反应,反应引物参考文献报道进行设计,借助Blast在线完成特异性核实后,完成引物设计(限于实验室条件,引物设计由上海英俊生物技术有限公司完成)。根据检测内容完成相关参数测定:30℃下操作10 min;42℃处理30 min;99℃下处理5 min;5℃下处理5 min,合计完成循环35个,最终10 min延长,温度72℃。每次实验同时设标准品校正和阴性对照,反应完毕后根据溶解曲线分析PCR产物的特异性,将最终获得的产物置于浓度为1.5%琼脂凝胶电泳,结果以细菌拷贝系数采用对数/g粪便表示[8-9]。
1.3.3相关性分析
为了进一步分析炎症性肠病患者炎性因子、CD4与肠道菌群的关系,本研究的采用Pearson相关性分析软件对其进行相关性分析。
1.4 统计分析
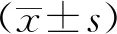
2 结果
2.1 3组炎性因子及CD4比较
克罗恩病组与溃疡性结肠炎组CD4水平差异无统计意义(P>0.05),但均低于对照组(P<0.05);克罗恩病患者IL-6、TNF-α、hs-CRP水平均高于溃疡性结肠炎患者(P<0.05);观察组IL-6、TNF-α、hs-CRP水平均高于对照组(P<0.05),见表1。
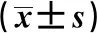
表1 3组炎性因子及CD4比较
2.2 3组肠道菌群比较
3组葡萄球菌、铜绿假单胞菌及韦荣球菌含量无统计意义(P>0.05);观察组双歧杆菌及乳酸杆菌含量低于对照组(P<0.05);大肠杆菌、幽门螺杆菌、链球菌含量多于对照组(P<0.05);克罗恩病双歧杆菌及乳酸杆菌含量低于溃疡性结肠炎(P<0.05);大肠杆菌、幽门螺杆菌、链球菌含量多于溃疡性结肠炎(P<0.05),见表2。
2.3 炎症性肠病患者炎性因子、CD4与肠道菌群关系
Pearson相关性分析结果表明:炎症性肠病患者炎性因子、CD4与葡萄球菌、铜绿假单胞菌及韦荣球菌含量无相关性(P>0.05);炎症性肠病患者炎性因子与大肠杆菌、幽门螺杆菌、链球菌含量呈正相关性(P<0.05);与双歧杆菌及乳酸杆菌含量呈负相关性(P<0.05);CD4与大肠杆菌、幽门螺杆菌、链球菌呈负相关性(P<0.05);与双歧杆菌和乳酸杆菌呈正相关性(P<0.05),见表3。
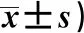
表2 3组肠道菌群比较(对数/g粪便,

表3 炎症性肠病患者炎性因子、CD4与肠道菌群关系(r,P)
3 讨论
炎症性肠病是一种以肠道黏膜慢性、非特异性炎症反应为主要表现的肠道炎性疾病。目前,临床上对于炎症性疾病发生机制尚未阐明,普遍认为与环境因素、饮食、遗传及肠道菌群等有关[10]。研究表明[11]:炎症性肠病的发生与炎性因子有关,且炎性因子表达越高,患者病变范围越大、病情越重。本研究中,观察组CD4水平低于对照组(P<0.05);IL-6、TNF-α、hs-CRP水平均高于对照组(P<0.05),从本研究结果看出,炎症性肠病患者发病后常伴有炎性因子异常,且患者CD4T淋巴细胞水平降低。国外学者研究表明[12]:血清炎性因子对细胞功能和体内生理平衡的调节具有重要的作用,促炎因子与抗炎因子表达失衡可加剧疾病的发生、发展。而CD4是人体免疫系统中重要的免疫细胞,主要由辅助T细胞表达,是Th细胞TCR识别抗原的受体,能直接参与Th细胞抗原识别过程,其表达水平能反映机体免疫水平。从本研究结果看出,炎症性肠病患者常伴有CD4水平降低,说明免疫调节能直接参与炎症性肠病的发生、发展。
近年国内外研究结果证实,肠道微生态紊乱在炎症性肠病患者中较为常见,患者发病后肠道菌群失衡能通过菌群-脑-肠轴影响神经-免疫-内分泌系统,从而损伤中枢神经系统[13]。由于各种原因引起肠道菌群失衡后,则会引起多种疾病的发生,增加胃肠溃疡、脑卒中等疾病发生。本研究中,观察组双歧杆菌及乳酸杆菌含量低于对照组(P<0.05);大肠杆菌、幽门螺杆菌、链球菌含量多于对照组(P<0.05),说明炎症性肠病患者伴有有益菌数量的减少和有害菌数量的增多。既往研究表明[14]:当肠道微生态失衡、有益菌减少时,将会产生大量的内毒素,损害全身多个组织、器官,增加中枢神经系统损害风险。此外,肠道中有益菌的减少及有害菌群的增多,能对患者神经-内分泌系统产生影响,导致神经递质紊乱。为了进一步分析炎症性肠病患者炎性因子、CD4与肠道菌群的关系,本研究中对其进行相关性分析,结果表明:炎症性肠病患者炎性因子与大肠杆菌、幽门螺杆菌、链球菌含量呈正相关性(P<0.05);与双歧杆菌及乳酸杆菌含量呈负相关性(P<0.05);CD4与大肠杆菌、幽门螺杆菌、链球菌呈负相关性(P<0.05);与双歧杆菌和乳酸杆菌呈正相关性(P<0.05),从本研究结果看出,炎症性肠病患者炎性因子联合CD4与肠道菌群存在强相关性,加强患者炎性因子联合CD4水平测定能评价患者疾病严重程度,预测患者肠道菌群紊乱情况,有助于指导临床治疗[15]。
综上所述,炎性因子、CD4在炎症性肠病患者中表达异常,二者存在紧密的联系,且患者常伴有肠道菌群紊乱,从而提示炎症因子水平改变与肠道菌群失衡有密切的关系,二者可作为有效免疫细胞因子,对临床诊疗、评估疾病进展具有重要意义。

