4种市售水产品抗生素耐药基因和intⅠ1实时荧光定量PCR检测
毛海萍,叶 繁,赵巧灵,金仁耀,吴佳佳*,戴志远
(1 浙江工商大学海洋食品研究院 杭州 310012 2 舟山市食品药品检验检测研究院 浙江舟山 316000)
抗生素被广泛用于人类、畜牧业及鱼类养殖的疾病预防和治疗,抗生素诱导细菌产生的抗生素耐药基因(Antibiotic resistant genes,ARGs)已成为一种新型环境污染物,其污染分布广泛且危害持久。ARGs 借助质粒、转座子、整合子等可移动的基因元件在不同的细菌菌群间发生水平转移,同时,菌体裂解释放的ARGs 能够被其它细菌再次捕获、整合,从而使其在微生态环境中迁徙、污染[1]。
水产养殖是中国农业结构中发展最快的产业之一,2018年中国水产养殖产量超5 000 万t(占水产总量的78%),为居民提供了丰富的优质蛋白供给[2]。然而,养殖水环境抗生素污染引起的水产品ARGs 污染问题也日趋严重而不容忽视。医疗及畜牧养殖废水中抗性基因或耐药菌会通过污水排放、水循环进入养殖水体,造成养殖环境抗生素和ARGs 本底水平升高[3]。同时,水产养殖过程中大量投放的抗生素进一步诱导ARGs 的产生并促进其转移[4],养殖水体环境正在逐渐成为一个巨大的ARGs 储存库。张瑞泉等[5]测定鱼塘养殖环境中11 种四环素类耐药基因(tetA,tetB,tetC,tetD,tetA,tetM,tetO,tetQ,tetS,tetW,tetX),3 种磺胺类耐药基因(sul1,sul2,sul3),2 种整合酶基因(int1,int2)的分布特征及丰度水平,结果显示:14 种抗生素耐药基因及2 种整合酶基因在鱼塘养殖环境中广泛检出,表明养殖鱼塘及污水环境广泛受到抗生素耐药基因的污染。马辰婕等[6]发现与细菌多重耐药性快速传播相关的复合I 型整合子在水产养殖环境中并不少见,且存在于多种细菌中。水产品中携带抗生素耐药基因的耐药菌株的种类和数量日益增加,不仅影响抗生素的治疗效果,抗生素耐药基因向环境和食物链的迁移,也对环境及人类健康造成极大威胁[7]。
本研究选取杭州市菜场销售的鲫鱼、黄颡鱼、大黄鱼和沼虾4 种常见水产品,选择水产养殖中常用的磺胺类、四环素类、氨基糖苷类、β-内酰胺、喹诺酮类、氯霉素类几种抗生素对应的抗性基因作为研究对象,对其常见基因tetA、sul2、blaPSE、cmlA、qnrS、aac(6')-Ib、intⅠ1 进行检测。采用实时荧光定量,以水产品携带细菌总DNA 为模板,探究其常见ARGs 和I 类整合子的数量及分布。
1 材料与方法
1.1 材料
1.1.1 阳性菌株 实验室分离出分别携带四环素耐药基因tetA、磺胺类耐药基因sul2、β-内酰胺类耐药基因blaPSE、氯霉素耐药基因cmlA、喹诺酮类耐药基因qnrS、氨基糖苷类耐药基因aac(6')-Ib、整合子基因intⅠ1 的阳性对照菌株。
1.1.2 样品采集 沼虾(40±5)g、鲫鱼(100±10)g、黄颡鱼(120±10)g、大黄鱼(600±50)g,杭州市西湖区某菜市场。
1.1.3 主要试剂 LATaqDNA 聚合酶、100 bp DNA Ladder、大肠杆菌(E.coli)DH5α 感受 态细胞、TB Green Premix Ex Taq 聚合酶预混液、pTG19-T Vector 载体,大连Takara 生物公司;Safe Green 核酸染料,莫纳生物科技有限公司;UNIQ-10 柱式琼脂糖凝胶DNA 回收试剂盒、质粒小量提取试剂盒,生工生物工程(上海)股份有限公司。
1.2 仪器与设备
凝胶电泳仪、T100 型PCR 仪、Mini Opticon Monitor 3 实时荧光定量PCR 仪,美国Bio-Rad 公司;BSA124S-CW 电子天平,北京赛多利斯科学仪器有限公司;Fresco 21 型高速冷冻离心机,美国Thermo Fisher 公司;Evolution 60s 紫外可见光分光光度计,美国Thermo 公司;LRH-150-S 型恒温恒湿培养箱,上海沪粤明科学仪器有限公司;MLS-3781L-PC 高压蒸汽灭菌器,松下电器有限公司。
1.3 试验方法
1.3.1 目的基因片段扩增 通过煮沸法裂解阳性菌菌体,提取DNA 模板。采用25 μL 反应体系进行PCR 扩增,扩增反应体系:1.5 μL 10×LA buffer(Mg2+plus),2 μL dNTP Mix(2.5 mmol/L),上、下游引物各1 μL,0.1 μL LATaq(5 U/μL),2 μL DNA 模板,17.4 μL ddH2O。tetA、sul2、blaPSE、cmlA、qnrS、aac(6')-Ib、intⅠ1、16S rDNA 的引物序列见表1,由金斯瑞生物科技股份有限公司合成。扩增反应条件为:94 ℃预变性5 min;94 ℃变性60 s,60 ℃退火60 s,72 ℃延伸60 s,34 个循环;72 ℃延伸10 min。产物经琼脂糖电泳检测后,按照UNIQ-10 柱式微量琼脂糖凝胶DNA 回收试剂盒的说明书进行DNA 纯化和回收。

表1 目的基因的扩增引物Table 1 The primers for selected genes
1.3.2 阳性质粒的构建 将目的基因tetA、sul2、blaPSE、cmlA、qnrS、aac(6')-Ib、intⅠ1 分别连接到pTG19-T Vector 后转化至大肠杆菌Escherichia coliDH5α,构建重组质粒。
1.3.3 目的基因标准曲线建立 以重组质粒作为阳性模板建立实时荧光定量PCR 标准曲线。拷贝数的计算公式:拷贝数=(质量/分子质量)×6.02×1023。根据1A260nm=50 μg/mL 计算质粒质量浓度。
以起始模板拷贝数的对数为横坐标,对应Ct值为纵坐标,构建各体系的标准曲线。计算曲线的R2值,扩增效率E= [10(-1/slope)-1]×100%。获得各耐药基因和内参基因16S rDNA 的标准曲线。用于标准曲线的质粒浓度范围为101~109拷贝/μL。所得标准曲线应满足以下要求:相关系数R2≥0.99,扩增效率E为90%~110%[16]。
1.3.4 市售水产品菌体总DNA 提取 无菌条件下分别收集鱼鳃、肠道、体表粘液或虾线、虾头,捣碎后取10 g 样品加至含90 mL 无菌生理盐水的三角瓶中,充分摇匀,2 000 r/min 离心5 min,收集上清液,10 000 r/min 离心5 min,以500 μL 无菌水悬浮菌体沉淀后,沸水浴5 min,冰浴2 min,5 000 r/min 离心1 min,取上清为DNA 模板。
1.3.5 qPCR 反应 qPCR 反应体系:10 μL TB Premix Ex Taq,引物各0.4 μL,2 μL DNA 模板,7.2 μL ddH2O。反应条件为:95 ℃预变性30 s;95℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,40 个循环[17]。每个样品设置3 个重复。Ct 取31 为检出限,即Ct 值大于30 时,判断结果为阴性[18]。ARGs 的绝对拷贝数和内参基因16S rDNA 绝对拷贝数的比值得到该基因的相对丰度,用来比较待测样品中ARGs 的相对含量[19]。
1.3.6 数据分析 通过Microsoft Excel 2007 和IBM SPSS Statistics 19 软件分析处理数据,利用Origin 2017 制作图表。采用Spearman 相关性分析目的基因之间的相关性。用SPSS 软件进行Duncan 单因素方差分析,显著性水平设定为0.05,当P<0.05 时,即为差异显著。
2 结果与分析
2.1 阳性重组子验证
PCR 扩增阳性重组子中的目的基因片段后对其进行测序分析,测序结果在NCBI 网站上进行比对,且与NCBI 数据库中对应基因的同源性≥99%。筛选所获的重组子均能用于标准曲线的绘制。
2.2 标准曲线绘制
利用阳性重组子绘制的7 个ARGs 和16S rDNA 标准曲线如表2所示。Ct 值与目的基因拷贝数之间的扩增效率E在90.42%~106.23%之间,扩增效率在qPCR 效率范围内(90%~110%),相关系数R2均大于0.99,一般满足R2>0.985 时,所得曲线即可被称为合格的标准曲线,当R2越接近1.00 时,则曲线越可信,说明所有曲线都有较好的精确度和重复性[20]。曲线的斜率在-3.1811~-3.5752 之间,满足qPCR 试验的要求(-3.1~-3.59),相对标准偏差(RSD)均小于5.1%。说明8条标准曲线具有良好的线性关系,可用于计算待测样品中各基因的拷贝数。Ct 取31 为检出限,已建立的qPCR 方法对blaPSE 的最低检出限为6.6×104拷贝/μL,对其它6 种ARGs 的最低检出限在11.5~202 拷贝/μL 之间。
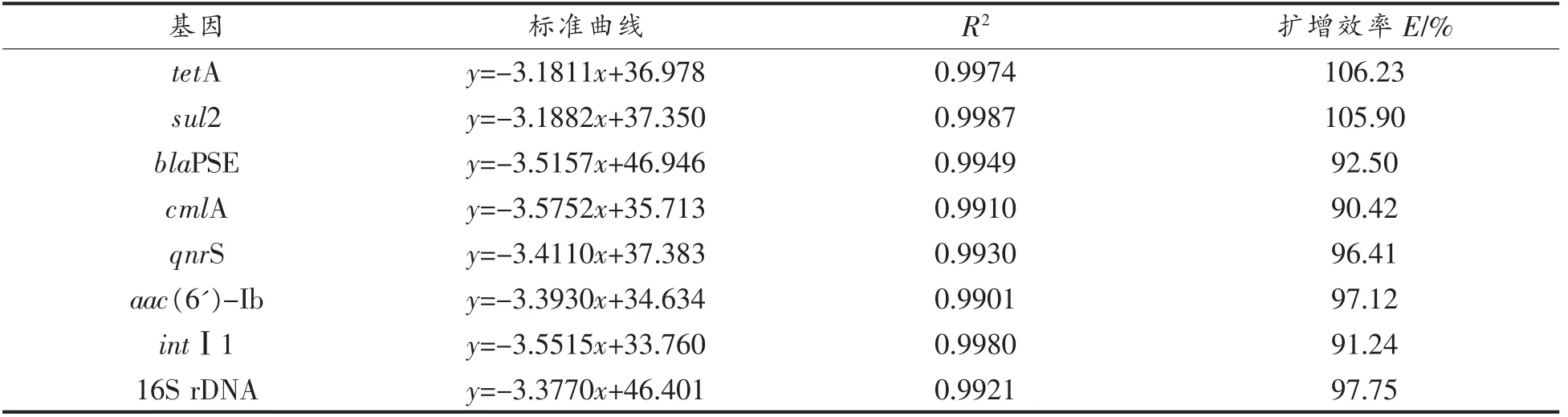
表2 目的基因标准曲线Table 2 Standard curve of selected genes
2.3 市售水产品耐药基因的定量测定
利用本试验建立的qPCR 方法对市售沼虾、鲫鱼、黄颡鱼、大黄鱼中的ARGs 携带情况进行定量分析。如图1所示,6 种ARGs 在4 种水产样品中均有检出,基因拷贝数跨越6 个数量级,最小值为2.90×102拷贝/g(沼虾样品,喹诺酮耐药基因aac(6')-Ib),最大值为3.97×107拷贝/g(鲫鱼样品,β-内酰胺类耐药基因blaPSE)。四环素耐药基因tetA、磺胺类耐药基因sul2 和β-内酰胺类耐药基因blaPSE 在所有样品中都有较高的拷贝数。
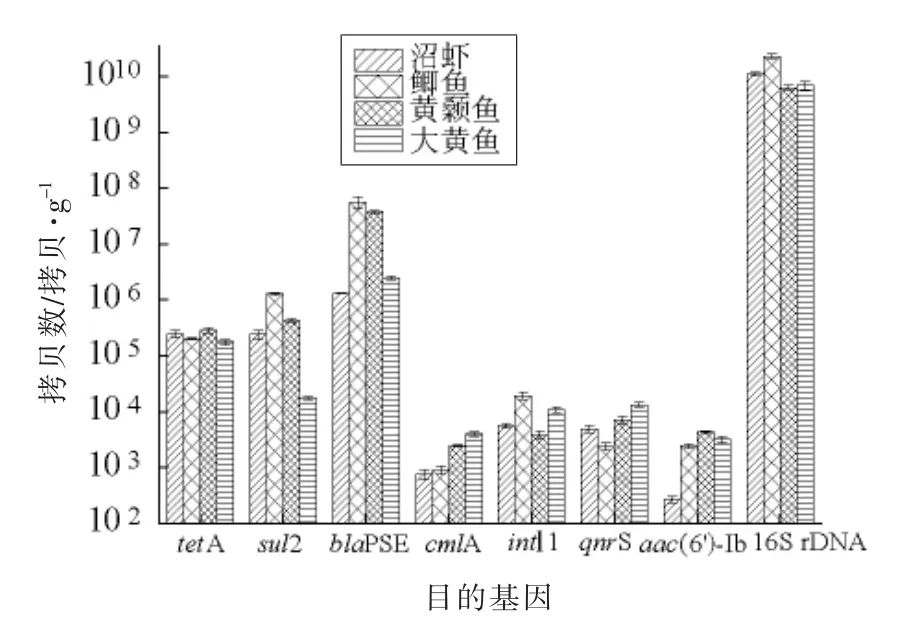
图1 市售水产品中ARGs 的绝对丰度Fig.1 The abundance of selected genes in samples
由于不同样品携带微生物总量不同,为降低偏差,加入16S rDNA 作为内参基因计算ARGs污染水平用相对丰度,如图2所示。总体而言,4种水产样品中各耐药基因的相对丰度和绝对丰度存在高度一致性。6 种抗性基因在4 种水产样品中均有检出,说明ARGs 污染普遍存在于不同的食用水产品中。其中,部分耐药如编码β-内酰胺酶的blaPSE、磺胺类耐药基因sul2 和四环素耐药基因tetA 具有较高的相对丰度,说明水产品源微生物携带此类耐药基因的比例较高。
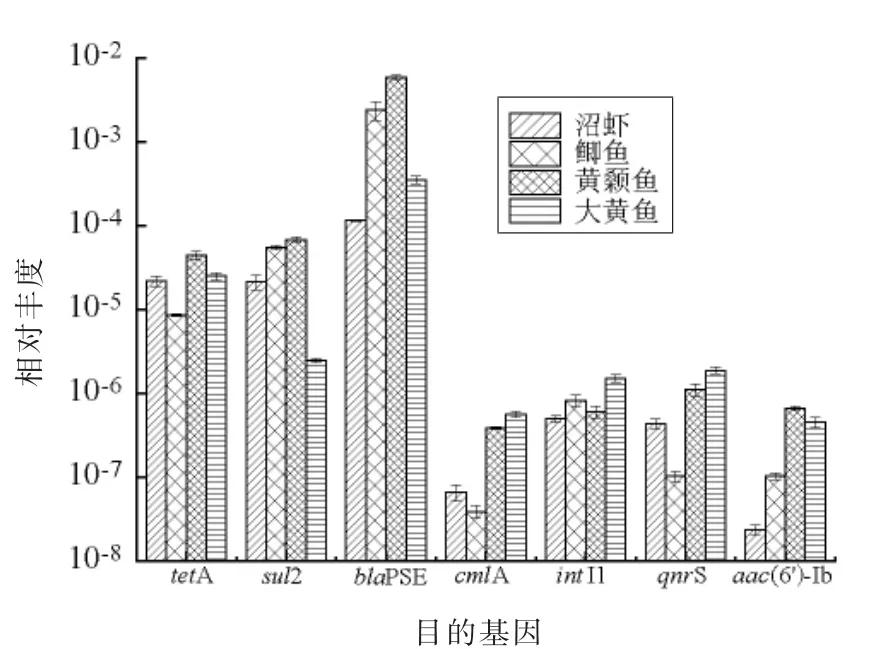
图2 市售水产中ARGs 的相对丰度Fig.2 The relative abundance of ARGs in samples
本研究对水产品中常见的1 型整合子携带情况进行分析,发现4 种样品中intI1 的拷贝数均高于103拷贝/g。推测IntI1 的高携带率可能与水产品中多重耐药菌检出相关。整合子基因能够促进外源性基因的获得和表达,并通过可移动遗传因子、质粒和转座子等在细菌群落之间传播。
2.4 ARGs、intⅠ1 间的相关性分析
如表3所示,sul2 和blaPSE 之间呈显著正相关,blaPSE 和aac(6')-Ib 之间呈显著正相关,cmlA 与qnrS 呈显著正相关,这些ARGs 之间可能存在相同的宿主菌[21]。研究表明,某些微生物总是携带特定的ARGs[22],即ARGs 的增值和分布与相关特定菌属有关,例如:梭菌属(Clostridium)通常携带tetO、tet32 和ermB,埃希氏菌(Escherichia)携带acrA、mdtH、mdtL 和mdtO[23],气微菌属(Aeromicrobium)和sul2 之间呈显著正相关[24]。本试验中的6种ARGs 与intⅠ1 丰度之间不显著相关。

表3 ARGs 与intⅠ1 之间的相关性Table 3 Correlation coefficients between the relative abundances of ARGs and intⅠ1
3 讨论
目前关于抗生素抗性基因在畜禽、果蔬及水产品中检出的报道逐渐增多,水产品因其生产环境中耐药基因污染加剧,极易受到耐药基因污染。本研究选取的4 种水产品受β-内酰胺酶的blaPSE、磺胺类耐药基因sul2 和四环素耐药基因tetA 污染较为严重。
已知质粒介导的blaPSE 是编码β-内酰胺酶的常见基因,在本研究选取的4 种样品中blaPSE的携带数量均最高,拷贝数均高于106拷贝/g 在1.2×10-4~6.0×10-3之间。β-内酰胺类抗生素因具有低毒和广谱抗菌而被临床和养殖业长期广泛使用,其产生的细菌耐药问题日趋严重。产超广谱β-内酰胺酶革兰氏阴性菌数量和种类不断上升,其携带的各类可移动基因元件及耐药基因能够在不同微生物间发生转移,进而造成耐药基因的广泛传播[25]。β-内酰胺类bla基因已经在养殖场的废水、污水处理厂以及地表水中被检出[26]。bla基因常与其它抗性微生物的抗性基因共存,并与可移动遗传元件相关联,因而增加了多重药物耐药性和环境传播的可能[27]。
磺胺类耐药基因sul2 在沼虾、鲫鱼和黄颡鱼3 种淡水养殖产品中含量均高于105拷贝/g,四环素耐药基因tetA 在4 种样品中的拷贝数均高于105拷贝/g。Gao 等[28]研究发现磺胺类和四环素耐药基因在水产养殖场中广泛存在,使得水产品有极大可能受这2 种ARGs 污染。王慧平等[29]对广州市天河区水产品耐药基因携带研究也发现,四环素抗性基因及磺胺类抗性基因在水产品中含量高于其它几种抗生素抗性基因。磺胺类sul2 常常位于细菌的质粒上,更容易出现耐药基因的水平转移,使得其在样品中有较高的含量,且磺胺类耐药细菌在水体中十分稳定,在环境中耐受性较强以及代谢速度慢,促进了其在环境中的扩散与传播。
本研究中所有样品中tetA 拷贝数均高于105拷贝/g,推测与养殖中四环素的使用相关。四环素水溶性较好且在环境中不易发生生物降解,因而容易在养殖环境中残留和蓄积,进而诱导养殖环境或养殖动物体内微生物对其产生抗性,形成持续性的污染。阮晓慧等[30]和Huang 等[31]研究均发现tetA 和tetG 基因丰度随四环素暴露浓度的增加总体呈现上升趋势。推测本研究中tetA 在各样品中含量高可能与养殖过程中四环素类药物广泛使用有关。
氯霉素耐药基因cmlA、氨基糖苷类耐药基因aac(6')-Ib 和喹诺酮类耐药基因qnrS,在本研究选取的4 种水产品中存在丰度均较低。氯霉素被作为水产养殖禁药后,降低了其诱导产生ARGs的风险,一定程度上减少了该类ARGs 对水产品的污染[32],而氯霉素类残留周期长,且已有耐药基因能在不同微生物间传播,也会造成氯霉素耐药基因禁用多年后仍能频繁检出。氨基糖苷类和喹诺酮类抗生素在水产养殖中被广泛应用于细菌性疾病的治疗,研究发现鱼源性气单胞菌、无乳链球菌、弧菌、肠道菌等致病菌和共生菌中均携带氨基糖苷类和喹诺酮类抗生素相关的多种抗性基因。本研究中,cmlA、aac(6')-Ib 和qnrS 在市售水产中丰度虽然较低,但此3 类耐药基因均容易随着整合子等可移动遗传组件在菌株间进行水平传播,导致不同种类的细菌产生耐药性[33]。
此外,整合子作为基因捕获系统,可以将外源基因整合到基因盒中,是ARGs 水平转移的重要分子元件。有研究表明,整合子与某些ARGs 的存在具有一定的相关性。Luo 等[14]研究发现intⅠ1 与sul1 的相对丰度间存在显著相关性,序列分析说明sul1 基因位于Ⅰ类整合子的保守段(3'-CS)[34],而sul2 通常与小型非接合质粒或具有多重耐药性的质粒相结合[14]。肖鑫鑫等[35]发现intⅠ1 与tetG、tetM、sul1 和qnrD 存在显著正相关。然而本研究选取的6 种ARGs 与intⅠ1 丰度间之间相关性不显著。intI1 的存在通常与细菌的多重耐药密切相关,由于抗生素耐药机制复杂而耐药基因种类繁多,因此,后续研究需针对常用抗生素选择多种相应的ARGs 进行检查,更加全面、系统地分析intI1与样品中ARGs 的相关性。
4 结论
本研究针对水产养殖环境污染较多的6 种ARGs 及intI1 建立了实时荧光定量检测方法,并利用此方法对4 种市售水产品中ARGs 及intI1进行了定量分析,结果显示,6 种ARGs 及intI1 在常见市售水产品中均有不同程度的检出,表明抗生素耐药相关基因污染较为普遍。blaPSE、sul2、tetA 在各类样品中都具有较高的相对丰度,intI1的普遍检出也预示着水产样品中可能存在多重耐药菌。
水产养殖过程中由于水体环境抗生素污染加剧,加之养殖过程中大量抗生素被用于疾病预防和治疗,使得水产养殖微生态环境以及养殖动物携带细菌中ARGs 不断蓄积。ARGs 通过食物链迁移将对人体健康构成极大威胁,对常见ARGs 进行检测将对预防ARGs 经食物链进入人体,提高食品安全性具有重要意义。鱼虾等水产品为人类提供了优质的动物蛋白,然而其耐药基因污染及迁移的问题需引起更多的关注。

