胺鲜酯对铬胁迫下白三叶种子萌发特性的影响
王 铎,田雨龙,张鸿建,张庆庆,陈柯如,李 州
(四川农业大学草业科技学院,四川 成都 611130)
白三叶(Trifolium repens)又名荷兰翘摇、白花苜蓿、白车轴草,为豆科三叶草属(Trifolium)多年生草本植物,广泛分布于温带及亚热带地区,在我国淮河以南和西南地区均有广泛栽培种植。白三叶是优质牧草,具有茎叶细软、叶量丰富、粗蛋白含量高、粗纤维含量低等特点,既可喂养牲畜,又可饲喂草食性鱼类,具有良好的经济价值[1]。因其植株低矮、匍匐生长特性强、叶形和花色优美,也被作为优良的水土保持及园林绿化植物应用于球场、公园、小区、游憩绿地等地[2]。但白三叶多生长于冷凉湿润的环境,其自身根系较浅,抗蒸腾能力较差,易受干旱、高温、金属离子毒害等非生物胁迫的影响,使其品质、产量及观赏价值降低[3]。铬(chromium, Cr)为地球上第七大元素[4],在自然界中以不同氧化价态的化合物形式稳定存在[5]。其中三价和六价是铬最稳定和最常见的两个价态,三价铬为人体必需微量元素,参与血糖调节并起重要作用[6],但六价铬毒性为三价铬的百倍,具有严重毒害作用[7],且由于其化学活性较三价铬更高,也更易被植物吸收。近年来,由于工业污染、农药过量施用等导致土壤重金属含量严重超标。在云南、四川、甘肃、内蒙古等地,铬均为导致当地土壤污染的主要重金属。以四川为例,姚学良和廖远安[8]在四川成都金牛区50 km2调查范围的农业土壤中发现镉、砷、铬等有害金属污染的耕地面积约占50%以上。由此可见,重金属铬是致使白三叶等优质牧草和作物减产的重要非生物胁迫因素。
胺鲜酯(diethyl aminoethyl hexanoate, DA-6)是一种高效植物生长调节物质,具有较高生物活性,对多种农作物具有显著的增产、提高抗逆性、增强抗病性、改善品质等功效。DA-6 可单独使用,也可与肥料、杀菌剂、杀虫剂和除草剂等复配使用,起到协同增效作用[9-13]。已有研究发现,使用DA-6 处理番茄(Lycopersicon esculentum)幼苗可通过调控细胞分裂素提高番茄的耐低温能力[14];利用DA-6 处理玉米(Zea mays)叶片可增加种子内蛋白质含量,进而提高种子活力[15]。此外,DA-6 浸种可显著提高藜麦(Chenopodium quinoa)、 水 稻(Oryza sativa)、 椰枣(Phoenix dactylifera)种子的萌发率,并使水稻在低温胁迫下保持较高的蛋白质水平,提高水稻抗寒性,而且能有效缓解盐胁迫对椰枣种子发芽造成的毒害作用[16-18]。
已有研究证实DA-6 作为一种有效的植物生长调节剂具有显著提高种子萌发率、种子活力及抗逆性的功能,但关于其是否有助于提高植物萌发期对重金属离子胁迫抗性方面的研究较少,尤其是关于种子萌发期耐Cr 性的研究更是鲜有人涉足。因此,本研究采用白三叶品种‘海发’为供试材料,深入研究使用DA-6 浸种是否能够有效提高白三叶萌发期的耐Cr 性,从渗透调节、氧化伤害及抗氧化防御等生理水平揭示DA-6 提高种子萌发期耐Cr 性的机理,以期为白三叶在重金属含量相对较高地区的栽培管理提供新方向。
1 材料与方法
1.1 试验材料
供试材料为白三叶中被广泛栽培的品种‘海发’(Trifolium repens‘Haifa’),于2019 年在四川农业大学第六教学实验楼草业工程实验室开展试验,种子购置于四川百绿时代园林绿化有限公司;种子的初始净度为98%,萌发率为94%。DA-6 及配置Cr6+溶液(K2Cr2O7)等所需化合物均为分析纯试剂。
1.2 试验设计
先测试白三叶种子在不同Cr6+浓度(0、5、7.5、10 mmol·L−1)胁迫下的萌发情况,测得白三叶种子在7.5 mmol·L−1浓度的Cr6+胁迫下萌发率接近60%,故选取该浓度进行下一步试验。随机称取1 g 白三叶种子,用200 mL 蒸馏水浸泡1 h,再分别置于不同浓度(20、40、60、100、200 mmol·L−1)的200 mL DA-6溶液中浸种2 h;对照组使用200 mL 蒸馏水浸泡3 h,不进行DA-6 预处理。浸种后从每个处理中随机挑选50 粒健康、饱满的种子置于垫有4 层滤纸的玻璃培养皿中,此后分别在蒸馏水(对照组) 和7.5 mmol·L−1Cr6+溶液(处理组)中发芽。试验共12 个处理:CK (蒸馏水浸种后在蒸馏水中发芽)、Cr6+(蒸馏水 浸 种 后 在Cr6+溶 液 中 发 芽)、20 mmol·L−1DA-6(20 mmol·L−1DA-6 浸 种 后 在 蒸 馏 水 中 发 芽)、20 mmol·L−1DA-6 + Cr6+(20 mmol·L−1DA-6 浸 种 后在Cr6+溶 液 中 发 芽)、40 mmol·L−1DA-6 (40 mmol·L−1DA-6 浸种后在蒸馏水中发芽)、40 mmol·L−1DA-6 +Cr6+(40 mmol·L−1DA-6 浸 种 后 在Cr6+溶 液 中 发 芽)、60 mmol·L−1DA-6 (60 mmol·L−1DA-6 浸种后在蒸馏水 中 发 芽)、60 mmol·L−1DA-6 + Cr6+(60 mmol·L−1DA-6 浸种后在Cr6+溶液中发芽)、100 mmol·L−1DA-6(100 mmol·L−1DA-6 浸 种 后 在 蒸 馏 水 中 发 芽)、100 mmol·L−1DA-6 + Cr6+(100 mmol·L−1DA-6 浸 种后在Cr6+溶液中发芽)、200 mmol·L−1DA-6 (200 mmol·L−1DA-6 浸 种 后 在 蒸 馏 水 中 发 芽) 和200 mmol·L−1DA-6 + Cr6+(200 mmol·L−1DA-6 浸 种 后 在Cr6+溶 液中发芽),每个处理设置5 次重复。将培养皿置于生长室中,以种子发育长成具备正常种苗结构为萌发标准(胚根长度与种子长度等长时即为发芽),于每日12:00 记录种子发芽数并补充蒸馏水。于第3 天测定发芽势,第7 天测定萌发率,并计算其发芽指数及平均萌发时间。由上述试验得出60 mmol·L−1DA-6浸种处理可显著缓解Cr6+对白三叶种子萌发的胁迫,故后续试验设置蒸馏水浸种和60 mmol·L−1DA-6浸种两个处理,分别在正常条件和7.5 mmol·L−1Cr6+溶液胁迫处理下进行后续萌发试验,共4 个处理,每个处理设置4 个重复。于种子萌发第7 天进行表型分析并测定其生理生化指标,分析DA-6 浸种提高白三叶种子萌发期耐铬性的相关机理。
1.3 测定指标与方法
1.3.1 种子萌发指标测定
萌发率 = (n/N) × 100%。式中:n为发芽种子总数,N为供试种子总数。
发芽势 = 发芽3 d 种子发芽总数/供试种子总数 × 100%。∑

式中:MGT(mean germination time)为平均发芽时间,D为从种子置床起计算的天数,n为相应隔天的萌发率。
每个处理组中随机选取3 组发芽第7 天时完整、健全的幼苗,每组15 株,用直尺测量胚芽长和胚根长。
1.3.2 生理生化指标测定
在种子萌发第7 天时选取生长状况一致的白三叶幼苗进行生理生化指标测定,除可溶性糖指标外其余指标均取0.1 g 鲜样进行测定;可溶性糖则取0.05 g 干样进行测定,每组数据进行4 次重复。采用蒽酮乙酸乙酯比色法测定可溶性糖(soluble sugar,WSC)含量[19];采用磺基水杨酸法测定游离脯氨酸(free proline, Pro)含量[20];采用李州等[21]的方法测定渗透势(osmotic potential, MPa);采用磺胺法测定超氧阴离子(superoxide anion, O2·−)产生速率[22];采用碘化钾法测定过氧化氢(hydrogen peroxide, H2O2)含量[23];采用硫代巴比妥酸法测定丙二醛(malondialdehyde,MDA)含量[24];采用常规电导率仪法测定电导率(electrolyte leakage, EL)[25];采用核黄素-NBT 法测定超氧化物歧化酶(superoxide dismutase, SOD)活性[26];采用愈创木酚显色法测定过氧化物酶(peroxide,POD)活性[27];采用紫外吸收法测定过氧化氢酶(catalase, CAT)活性[27];采用Nakano 和Asada[28]的方法测定抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性;采用Cakmak 等[29]的方法测定脱氢抗坏血酸还原酶(dehydroascorbate reductase, DR)、谷胱甘肽还原酶(glutathione reductase, GR)和单脱氢抗坏血酸还原酶(monodehydroascorbate reductase, MR)活性。
1.4 统计分析
数据采用Excel 2016 软件进行分析,使用Origin 9.0 软件进行绘图,使用SPSS 23.0 软件进行方差分析和显著性检验(P< 0.05)。
2 结果与分析
2.1 铬胁迫对白三叶萌发特性的影响
试验结果表明,5 mmol·L−1Cr6+胁迫能显著降低白三叶种子的萌发率、发芽势和发芽指数(P<0.05),且上述3 项指标均随Cr6+溶液浓度升高而逐渐降低(图1)。种子平均发芽时间随Cr6+溶液浓度升高而增加。7.5 mmol·L−1Cr6+胁迫下的白三叶种子萌发率接近60%。

图1 不同浓度铬胁迫对白三叶种子发芽指标的影响Figure 1 Effects of different concentrations of Cr6+ on seed germination parameters of Trifolium repens
2.2 铬胁迫下DA-6 浸种对白三叶萌发特性的影响
正常萌发条件下,40、60 和100 mmol·L−1DA-6浸种并未显著影响白三叶种子的萌发率(P> 0.05),但这3 个浸种浓度均显著提高了种子在Cr6+胁迫下的萌发率和发芽势(P< 0.05),其中60 mmol·L−1DA-6 浸种效果最显著,这个浓度也能显著缩短Cr6+胁迫下种子的平均发芽时间(P< 0.05) (表1)。中高浓度的DA-6 (100 mmol·L−1)浸种对白三叶种子在正常条件和Cr6+胁迫下的萌发特性影响不大,但高浓度的DA-6 (200 mmol·L−1)浸种则显著降低了白三叶在正常条件和Cr6+胁迫下的萌发率和发芽势(P<0.05),并延长种子平均发芽时间。60 mmol·L−1的DA-6 有效缓解了Cr6+胁迫对种子萌发的抑制,正常条件下对种子萌发也具有一定的促进作用(图2)。Cr6+胁迫显著降低白三叶种子萌发时的根长和茎长(P< 0.05),但使用DA-6 浸种后显著减小了茎长的下降幅度(P< 0.05)。Cr6+胁迫处理7 d 时,Cr+ DA-6处理种子的根长和茎长相较于Cr6+处理分别提高了13.64%和37.04% (图2)。

图2 铬胁迫下胺鲜酯(DA-6)浸种对白三叶种子萌发过程中表型变化、根长和茎长的影响Figure 2 Effects of soaking seeds in diethyl aminoethyl hexanoate (DA-6) on phenotype and root and stem length of Trifolium repens during seed germination under Cr6+ stress

表1 Cr6+胁迫下胺鲜酯(DA-6)浸种对白三叶种子发芽指标的影响Table 1 Effects of soaking seeds in diethyl aminoethyl hexanoate (DA-6) on seed germination parameters of Trifolium repens during germination under Cr6+ stress
2.3 铬胁迫下DA-6 浸种对白三叶种子渗透调节指标的影响
Cr6+胁迫下白三叶种子发芽时的可溶性糖含量较CK 显著降低(P< 0.05),此时Cr 和Cr + DA-6 处理组的可溶性糖含量分别仅为CK 和CK + DA-6的48.26%和61.82%,Cr 组的可溶性糖含量显著低于Cr + DA-6 组(P< 0.05) (图3)。Cr6+胁迫下游离脯氨酸含量显著提高(P< 0.05),此时CK 和CK + DA-6处理组的游离脯氨酸含量分别为Cr 和Cr + DA-6的40.81% 和26.21%,Cr + DA-6 组的游离脯氨酸含量显著高于Cr 组(P< 0.05)。此外,Cr6+胁迫下种子渗透势较CK 显著增加(P< 0.05),而经DA-6预处理后,在正常条件下种子渗透势显著降低(P< 0.05),在Cr6+处理条件下种子渗透势显著升高(P< 0.05)。
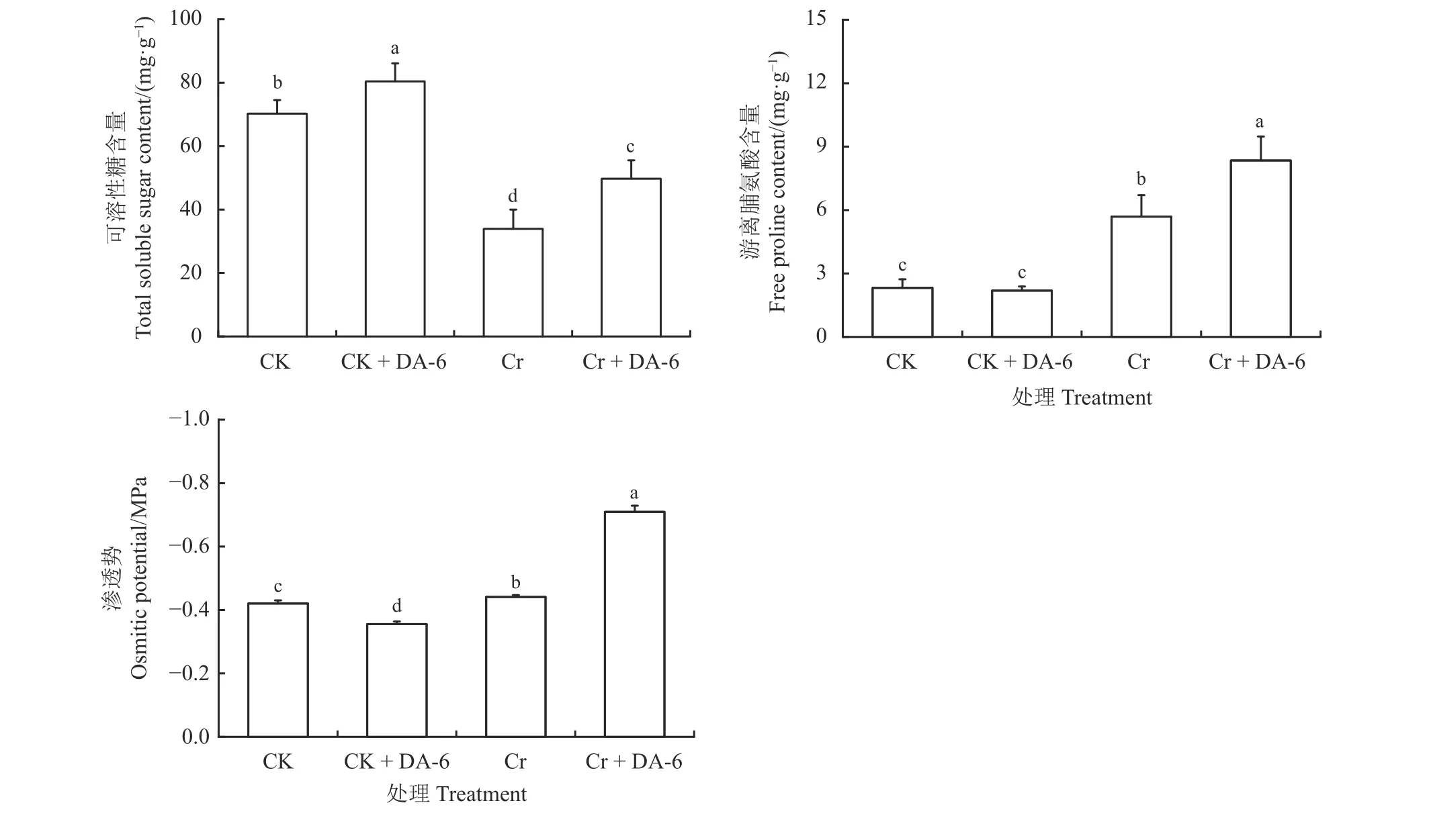
图3 铬胁迫下胺鲜酯(DA-6)浸种对白三叶种子萌发过程中可溶性糖含量、游离脯氨酸含量和渗透势的影响Figure 3 Effects of soaking seeds in diethyl aminoethyl hexanoate (DA-6) on soluble sugar content, free proline content, and osmotic potential of Trifolium repens during germination under Cr6+ stress
2.4 铬胁迫下DA-6 浸种对白三叶种子抗氧化代谢的影响
DA-6 浸种在正常条件下显著降低了白三叶种子发芽过程中MDA 含量(P< 0.05),但不影响O2·−产生速率、H2O2含量和EL (图4)。Cr6+胁迫下各项生理指标均得到显著提高(P< 0.05),加剧了细胞氧化伤害程度,但经DA-6 浸种后O2·−产生速率、H2O2含量、MDA 含量和EL 较Cr6+胁迫均显著降低(P< 0.05),Cr + DA-6 处理的O2·−产生速率、H2O2含量、MDA 含量和EL 比Cr 处理分别降低了52.09%、14.85%、31.81%和15.48%。
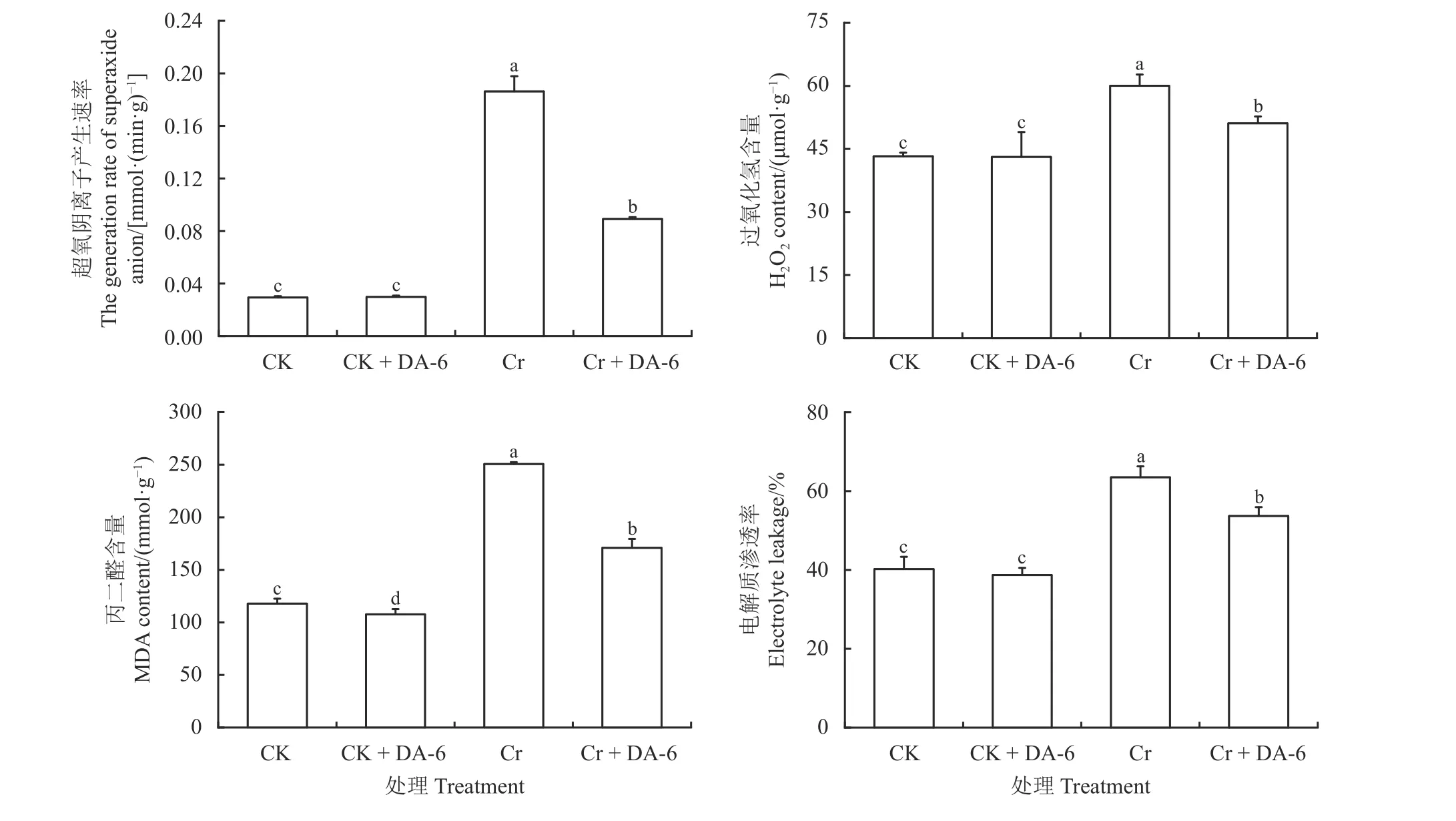
图4 铬胁迫下胺鲜酯(DA-6)浸种对白三叶种子萌发过程中活性氧、丙二醛含量和电解质渗透率的影响Figure 4 Effects of soaking seeds in diethyl aminoethyl hexanoate (DA-6) on reactive oxygen species, malondialdehyde (MDA)content, and electrolyte leakage of Trifolium repens during germination under Cr6+ stress
2.5 铬胁迫下DA-6 浸种对白三叶种子萌发过程中抗氧化保护酶活性的影响
正常条件下,DA-6 浸种对白三叶种子萌发过程中POD 和CAT 活性无显著影响(P> 0.05),但显著提高了SOD 活性(P< 0.05) (图5)。相较于CK组,Cr6+胁迫显著降低了SOD 和POD 活性(P< 0.05),但显著提高了CAT 活性(P< 0.05)。Cr + DA-6 处理的SOD、POD 和CAT 活性显著高于Cr 组(P< 0.05)。

图5 铬胁迫下胺鲜酯(DA-6)浸种对白三叶种子萌发过程中抗氧化酶活性的影响Figure 5 Effects of soaking seeds in diethyl aminoethyl hexanoate (DA-6) on antioxidant enzyme activities of Trifolium repens during germination under Cr6+ stress
2.6 铬胁迫下DA-6 浸种对白三叶种子萌发过程中抗坏血酸-谷胱甘肽循环关键酶活性的影响
DA-6 浸种在正常条件下对白三叶种子萌发过程中APX、DR、GR 和MR 活性均无显著影响(P>0.05) (图6)。相 对 于CK 而 言,Cr 处 理 的APX 和GR 活性显著降低(P< 0.05),DR 活性显著提高(P<0.05),而MR 活性无显著影响(P> 0.05)。Cr6+胁迫下经DA-6 浸种后APX、DR、GR 和MR 活性均较Cr6+胁迫显著提高(P< 0.05),Cr + DA-6 处理的APX、DR、GR 和MR 活性比Cr 处理分别提高了780.18%、5.91%、37.79%和57.38%。

图6 铬胁迫下胺鲜酯(DA-6)浸种对白三叶种子萌发过程中抗坏血酸-谷胱甘肽循环关键酶活性的影响Figure 6 Effects of soaking seeds in diethyl aminoethyl hexanoate (DA-6) on key enzyme activities of the AsA-GSH cycle of Trifolium repens during germination under Cr6+ stress
3 讨论与结论
重金属Cr 胁迫不仅影响植物种子萌发,而且能通过阻碍根系、茎秆和叶片生长,进而降低植物干物质产量。此外,Cr 的毒害作用还体现在破坏植物细胞膜及内部组分,改变植物体内相关酶活性,抑制作物正常生长发育[30]。前人研究表明,Cr 胁迫能显著抑制甜瓜(Cucumis melo)[31]和黄麻(Corchorusspp. 和Hibiscusspp.)[32]种子的萌发率,但低浓度Cr胁迫对青菜(Brassica chinensis)种子萌发起到促进作用,且随Cr 浓度升高逐渐表现为抑制效应[33]。本研究结果显示,白三叶种子在7.5 mmol·L−1Cr6+胁迫下其萌发率、发芽势、发芽指数显著降低,且平均发芽时间显著增加。受Cr6+胁迫的白三叶幼苗较正常处理下的幼苗其根长和茎长显著降低,根茎出现黄化。适当浓度(40、60、100 mmol·L−1)的DA-6 浸种使白三叶种子在Cr6+胁迫下的萌发率、发芽势、发芽指数得到显著提高,60 mmol·L−1DA-6 浸种也能显著降低Cr6+胁迫对茎长的抑制,表明适宜浓度的DA-6浸种能够有效缓解Cr6+胁迫对种子萌发的抑制作用。但高浓度(200 mmol·L−1)的DA-6 浸种加剧了Cr6+的胁迫效果,进一步降低种子在Cr6+胁迫下的萌发率,表明DA-6 提高白三叶种子萌发期抗性具有低浓度促进高浓度抑制的特点。
渗透调节是植物适应重金属胁迫的重要机制之一,为适应重金属胁迫,植物体内会合成和积累可溶性糖、游离脯氨酸、渗调蛋白等渗透调节物质,以保持细胞和组织渗透平衡[34]。本研究中,Cr6+胁迫下的白三叶种子萌发时可溶性糖含量较正常生长条件下显著降低,其原因可能是由于淀粉酶、麦芽糖酶活性受到抑制,阻碍了淀粉和麦芽糖的分解[35]。在经DA-6 浸种后可溶性糖含量得到显著提高,表明DA-6 可有效缓解Cr6+对淀粉代谢的抑制效应。已有研究表明,外施DA-6 能显著提高水稻叶片中可溶性糖的积累,有助于提高植物抗冷性[36];DA-6 浸种处理决明子(Cassia obtusifolia)种子能显著提高种子萌发期可溶性糖含量,进而提高种子萌发期的耐盐性[37]。细胞积累脯氨酸来调节渗透势是植物提高自身抗逆性的重要机制[38]。研究发现,Cr6+胁迫显著提高玉米[39]和小麦(Triticum aestivum)[40]的脯氨酸含量,DA-6 处理可显著增加水稻[36]和草莓(Fragaria×ananassa)[41]在胁迫条件下的脯氨酸含量。本研究结果显示,在Cr6+胁迫下白三叶种子萌发时游离脯氨酸含量显著升高,且DA-6 浸种进一步提高了白三叶在Cr6+胁迫下的游离脯氨酸含量,表明DA-6 调节Cr6+胁迫下白三叶渗透调节能力与促进脯氨酸的积累有关。此外,DA-6浸种显著降低了Cr6+胁迫下白三叶种子萌发过程中的渗透势。由此表明,DA-6 能通过提高可溶性糖和游离脯氨酸的积累有效缓解Cr6+胁迫导致的细胞渗透调节失衡,进而提高白三叶种子在Cr6+胁迫下的萌发能力。
金属离子毒害同时会引起植物细胞大量产生活性氧,活性氧过量积累致使细胞膜发生氧化损伤,细胞透性增加,进而影响植物正常生长发育[30,42]。Cr6+胁迫下,植物叶片膜脂过氧化产物MDA 含量显著升高,细胞膜氧化伤害增大,植物生长受损严重[43-44]。本研究中,Cr6+胁迫下白三叶种子萌发时相较于CK 组其O2·−产生速率、H2O2含量、MDA 含量和EL 显著升高,经DA-6 浸种后胁迫下O2·−产生速率、H2O2含量、MDA 含量和EL 较Cr6+胁迫均显著下降,表明DA-6 浸种有效缓解了Cr 胁迫导致的细胞氧化伤害。正常条件下,植物体内活性氧物质的产生与分解处于动态平衡,当其受到Cr 等重金属离子胁迫时,会破坏细胞氧化还原平衡。植物为抵御氧化伤害会激活SOD、CAT、POD 等抗氧化酶以及参与抗坏血酸-谷胱甘肽循环的关键酶(APX、DR、GR 和MR)。SOD 能将超氧阴离子歧化生成H2O2和无毒的氧,是抵御活性氧的第一道防线[45]。H2O2被POD 和CAT 进一步催化生成氧和水,过量的超氧阴离子得到清除,从而有效减轻了活性氧在细胞内的积累[46]。已有研究表明,处于Cr6+胁迫下植物的抗氧化酶活性会出现先增高后降低的趋势[47-48],其原因为当Cr6+浓度较低时,Cr6+作为信号分子启动植物抗氧化防御机制,当Cr6+浓度较高时,抗氧化酶活性则会逐渐下降。已有研究表明,使用DA-6 处理草莓可提高草莓在不同光强下的抗氧化酶活性,降低O2·−产生速率,防止活性氧对细胞膜系统和叶绿素结构的破坏[49];DA-6 处理多年生黑麦草(Lolium perenne)可提高多年生黑麦草在Cd2+胁迫下的抗氧化酶活性,降低活性氧自由基浓度,从而缓解重金属Cd 胁迫造成的膜脂过氧化加剧现象[50]。本研究中,Cr6+胁迫下O2·−产生速率和H2O2含量显著提高,表明Cr6+胁迫使种子萌发时受到氧化伤害,但白三叶自身可通过提高CAT 和DR 活性来减缓胁迫伤害。经DA-6 浸种后白三叶在Cr6+胁迫下萌发过程中抗氧化酶(SOD、POD 和CAT) 及抗坏血酸-谷胱甘肽循环关键酶(APX、DR、GR 和MR) 活性均较Cr6+胁迫显著增强,同时O2·−产生速率和H2O2含量显著降低,表明DA-6 可增强白三叶清除活性氧自由基的能力,进而有效缓解了活性氧对细胞膜的伤害,提高种子在萌发期的耐Cr 性。
综上所述,Cr6+胁迫显著抑制白三叶种子萌发及其根茎生长,适宜浓度(40、60、100 mmol·L−1)的DA-6 浸种处理可显著提高白三叶种子在Cr6+胁迫下的萌发特性,其中60 mmol·L−1处理效果最佳。但高浓度的DA-6 (200 mmol·L−1)浸种处理则进一步加剧白三叶种子的受胁迫程度。表明DA-6 提高白三叶种子萌发期抗性的效应具有低浓度促进、高浓度抑制的特点,类似于其他植物生长调节剂。在7.5 mmol·L−1Cr6+胁迫下,60 mmol·L−1DA-6 浸种处理提高了白三叶种子萌发期可溶性糖和游离脯氨酸含量,并降低细胞渗透势,进而有效维持渗透平衡。此外,DA-6 通过提高抗氧化酶及抗坏血酸-谷胱甘肽循环关键酶活性,增强白三叶清除活性氧自由基的能力,有效缓解了细胞氧化损伤,从而使种子萌发期的耐Cr 性得到提高。

