镉胁迫下水培杞柳生理特性及镉吸收转运
尹泽润,罗宝利,罗 锋,戴凤宾,诸葛玉平,娄燕宏,王 会,潘 红,崔秀敏,范利荣
(1. 土肥资源高效利用国家工程实验室/山东农业大学资源与环境学院,山东 泰安 271018;2. 山东莒南县农业农村局,山东 临沂276600;3. 邹城市农业农村局,山东 济宁 273500;4. 邹城市良种繁育中心,山东 济宁 273518)
在工矿业迅速发展的同时,污水灌溉及工矿业污染导致大量农田土壤镉含量迅速上升[1]。当前,我国耕地污染状况不容乐观,根据2014 年发布的全国土壤污染状况调查公报,我国土壤点位镉超标率高达7%[2]。镉是一种生物生长非必需的剧毒重金属元素,极易通过具有较高镉富集系数的作物进入食物链威胁人体健康[3]。自20 世纪50 年代日本发生因误食“镉米”而导致“水俣病”后,土壤镉污染便引起学者的广泛关注[4-5]。 依据我国2018 年8 月1 日实施的最新土壤环境质量标准(GB 15618-2018)[6],全国43% 的稻田土壤镉浓度超过其污染风险值[7],由此来看,镉污染土壤修复已迫在眉睫。
植物修复是一种环境友好型的重金属污染土壤修复方式[8-10],而用于土壤污染修复的植物多是重金属的超富集植物与具有较高累积能力的高生物量植物。柳属(Salix)植物是用于镉污染土壤植物修复的一类高生物量植物[11-12]。其中,杞柳(Salix integra)是柳编织品的重要原料,具有适应性强、易繁殖、生长迅速等优点,在我国广泛栽培,具有重要的经济价值。当前有研究表明杞柳对镉胁迫具有一定耐受性且对镉具有一定的吸收能力[13-14]。同时,杞柳可有效促进镉污染土壤中微生物的代谢活性、丰度及多样性指数,还可提高土壤养分水平[15],但杞柳对镉胁迫的生理响应以及对镉的富集转运特性仍有待进一步研究。同时,杞柳作为一种依靠营养体扦插繁殖的植物,其根系建成受镉胁迫的影响仍缺乏更加深入的探索,限制了对杞柳修复镉污染土壤可行性的认识。因此,本研究通过水培扦插杞柳苗的方式,研究镉对杞柳根系构型的影响及其生理响应机制,明确杞柳对镉的吸收转运特性,以期为杞柳在镉污染土壤修复中的应用奠定理论基础。
1 材料与方法
1.1 试验材料
供试杞柳品种为大青叶,繁育保存于山东农业大学试验站。剪取杞柳的顶端枝条(17 cm),去掉顶部嫩芽(2 cm),扦插于盛有1/2 Hoagland 营养液的水培箱中,培养至长出3~5 条不定根和嫩叶后,选取长势一致的杞柳苗进行试验。
1.2 试验设计
试验于2018 年4 月 - 5 月在山东农业大学温室中(22 ± 4 ℃)进行。采用水培试验,将长势一致的杞柳苗分别移入1 L 的塑料瓶中(每个塑料瓶中移入1 棵杞柳苗),加入1/2 Hoagland 营养液并将相应浓度的CdCl2(分析纯) 溶解其中,进行镉胁迫试验。以只用1/2 Hoagland 营养液的对照处理记为CK,镉处理分别记为C10、C20、C30和C40,对应的镉浓度分别为10、20、30 和40 mg·L−1。每个处理4 次重复,随机排列。处理14 d 后,将植株取出,先将根系浸泡于20 mmol·L−1EDTA Na 溶液中30 min,再用双蒸水洗净以去除螯合附着在根系表面的镉,随后对样品进行检测。
1.3 测定指标与方法
1.3.1 生长指标
分别于处理开始前和处理结束后获取始末生物量(干重),并计算相对生长速率(relative growth rate,RGR)[16]。
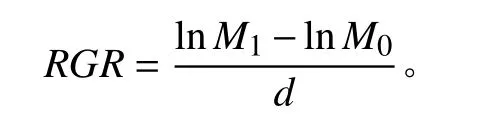
式中:M0为处理前杞柳干重,M1为处理后杞柳干重,d为处理时间(14 d)。
处理结束后,把植株按照茎、茎表皮、叶片、根系分离,测定根系构型后称取测定生理指标用样品,其余样品置于105 ℃杀青30 min,80 ℃烘干至恒重,得到样品干重。
1.3.2 根系构型
把根系放入根系扫描仪Epson V700 的玻璃槽中,注入1 cm 深的去离子水使根系充分散开,必要时使用镊子将根系调整散开以避免根系重叠交叉,扫描获取图像,将图像导入Win RHIZO 根系分析系统中进行分析获取根系形态数据(根系总长度、平均直径、体积、表面积、分形维数、连接数、节点数、根尖数、分叉数)。
1.3.3 生理指标
参考高俊凤[17]的方法,准确称取0.5 g 叶片(根系) 置于预冷处理的研钵中,用液氮研磨后,加入5.0 mL 磷酸缓冲液(pH 7.0)转移到离心管中,4 ℃离心10 min,收集上清液用于杞柳叶片和根系产生的超氧阴离子活力单位、谷胱甘肽(glutathione, GSH)含量和过氧化氢酶(catalase, CAT)活性的测定;参考Halliwell 和Foyer[18]的方法测定谷胱甘肽还原酶(glutathione reductase, GR)活性。
1.3.4 镉的吸收转运
将烘干样品磨碎过0.25 mm 筛,分别称取样品(根系0.1 g,叶片、茎表皮和茎分别称取0.2 g)置于石墨坩埚中,在马福炉490 ℃下灰化50 min。将灰化好的材料,加入15 mL 混合酸(HCIO4∶ HNO3体积比为1 ∶ 4),转移至消煮管中消煮至澄清,定容至50 mL 容量瓶中,用原子吸收分光光度计测定溶液中镉浓度,计算各器官镉含量,并按以下公式计算镉的去除率[19]、转移系数(translocation factor, TF)[20]、富集系数(bioconcentration factor, BCF)[21]:
去除率 = 植株吸收富集的镉含量/处理前营养液中的镉含量 × 100%;
富集系数 = 植株富集镉浓度/营养液中镉浓度;
转移系数 = 地上部镉浓度/地下部镉浓度。
1.4 数据分析
所有数据均为4 次重复的平均值,使用Excel 2010 进行做图和数据处理。采用SPSS 软件17.0 通过Probit 回归分析计算IC50(半抑制浓度),并进行方差分析(多重比较方法为Duncan),比较不同处理间在P< 0.05 的显著性水平。
2 结果与分析
2.1 镉胁迫对杞柳生长及根系构型的影响
2.1.1 镉胁迫对杞柳生长影响
镉胁迫下杞柳的相对生长速率有显著降低(P<0.05),且抑制作用随胁迫浓度增加而增大(图1),下降幅度为8.88%~59.21%,但C30与C40处理间无显著差异(P> 0.05);分析得出,杞柳镉胁迫的半抑制浓度为25 mg·L−1。在高浓度的镉胁迫下(C30、C40),其生长虽然受到抑制,但仍能存活并保持一定的相对生长率[15.85~17.61 mg·(g·d)−1],表明杞柳对镉胁迫具有较强的耐受性。

图1 不同处理杞柳的相对生长率Figure 1 Relative growth rate of Salix integra following different treatments
杞柳各部位生物量在不同镉浓度胁迫下所受影响不同(表1)。茎和茎表皮生物量在不同镉浓度处理下显著下降(P< 0.05),C10、C20、C30处理间差异不显著(P> 0.05),且均大于C40(P< 0.05);叶片生物量在C20处理下显著下降(P< 0.05),C10、C20处理显著大于C30、C40(P< 0.05),C10和C20处理之间、C30和C40处理之间差异均不显著(P> 0.05);杞柳根系生物量与CK 相比,仅在C40处理下显著下降43.23%(P< 0.05)。可见,杞柳地上部对镉胁迫的抑制作用更为敏感,而根系对镉胁迫具有更强的耐受性。
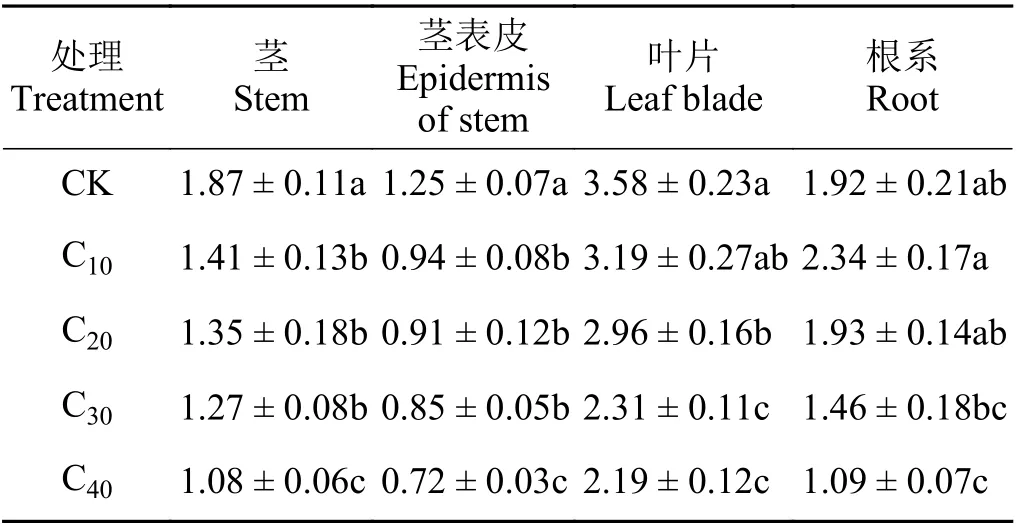
表1 不同处理杞柳各部位生物量Table 1 Biomass of different parts of Salix integra following different treatments g
2.1.2 杞柳根系生长构型
对照处理下杞柳根系发达且侧根茂密,而镉胁迫下侧根随胁迫浓度升高而逐渐稀疏(图2)。镉胁迫对杞柳根系总长度的影响表现为“低促高抑”的趋势,C10较CK 显著提高8.85% (P< 0.05);C20、C30与CK 差异不显著(P> 0.05),而C40较CK 显著下降21.45% (P< 0.05),且镉处理间随浓度提高根系总长度显著下降(P< 0.05) (图3)。较CK,镉胁迫显著降低了根系表面积、平均直径和体积(P< 0.05),且下降幅度随处理浓度提高有增加趋势。C10、C20处理平均直径显著大于C30、C40(P< 0.05),且C10与C20、C30与C40处理间均无显著差异(P> 0.05);根系体积随镉处理浓度增加而显著降低(P< 0.05);C10、C20处理根系表面积显著大于C30、C40(P< 0.05),且C10、C20间差异不显著(P> 0.05),但C30处理的根系表面积显著大于C40(P< 0.05)。因此,杞柳在镉胁迫下根系建成受到抑制,根系表面积、平均直径和体积均下降,尽管根系总长度在低浓度下受刺激增长,但镉胁迫浓度继续增加后,根系总长度也逐渐降低。

图2 不同处理杞柳根系扫描图Figure 2 Root system scan of Salix integra following different treatments
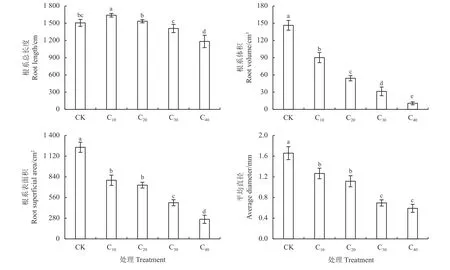
图3 不同处理杞柳根系总长度、平均直径、体积、表面积Figure 3 Root total length, average diameter, volume, and superficial area of Salix integra following different treatments
较CK 处理,镉处理的杞柳分形维数、分叉数均无显著差异(P> 0.05);连接数仅C40处理显著提高22.06% (P< 0.05),其余镉处理均与CK 无显著差异(P> 0.05);根系节点数和根尖数在各镉处理下较CK 均显著增加(P< 0.05),增加幅度在43.57%~51.98%和17.52%~28.73% (表2)。分形维数在各镉处理间,仅C40较C30显著下降了29.84% (P< 0.05),其余镉胁迫处理间均无显著差异(P> 0.05);杞柳根系连接数、节点数、根尖数和分叉数均在各镉胁迫处理间差异不显著(P> 0.05)。
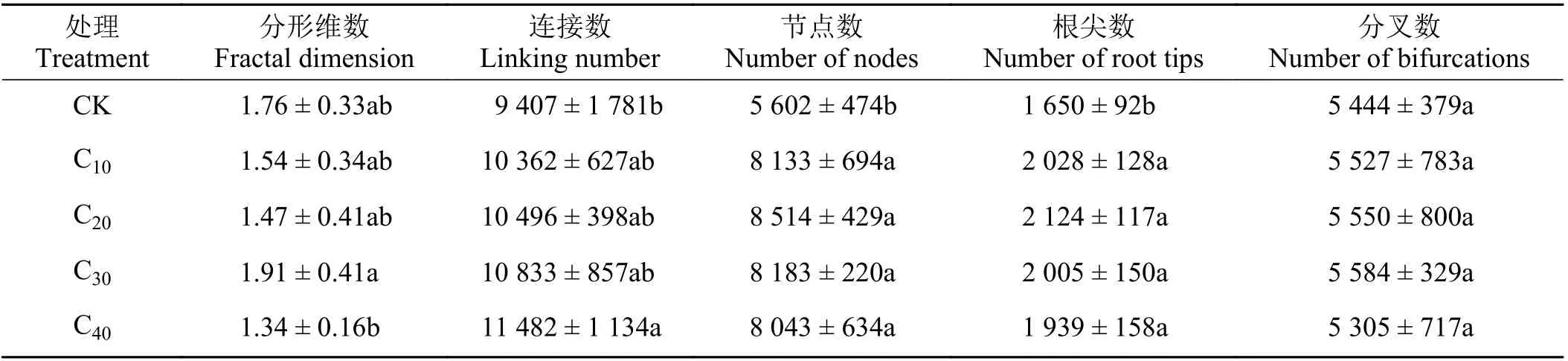
表2 不同处理杞柳根系构型指标Table 2 Root configuration index of Salix integra following different treatments
2.2 镉胁迫对杞柳抗氧化酶活性的影响
与CK 相比,仅C40处理下杞柳叶片产生超氧阴离子活力单位无显著差异(P> 0.05),其他镉处理下杞柳根系和叶片的产生超氧阴离子活力单位显著上升24.12%~55.12% (P< 0.05),且杞柳根系和叶片中产生超氧阴离子活力单位均随镉处理浓度增加表现为“先增后减”,并在C20处理下达到最高水平(图4)。镉胁迫处理显著提高了杞柳体内的CAT酶活性(P< 0.05),根系和叶片中分别上升了7.60%~26.90%与41.95%~135.29%,但叶片中CAT 酶活性随镉处理浓度增加先上升后下降,在C20处理下最高,且C10、C30、C40处理间差异不显著(P> 0.05),而根 中CAT 酶 活 性C10、C20处 理 显 著 小 于C30、C40处理(P< 0.05),但C10与C20、C30与C40处理间差异均不显著(P> 0.05);C20、C30和C40较CK 处理显著降低了叶片和根系的GSH 含量(P< 0.05),但C10与CK 处理间差异不显著(P> 0.05);镉处理显著降低了杞柳根系和叶片GR 酶活性35.59%~58.25% (P<0.05),叶片中GR 酶活性C10、C20处理显著大于C30、C40处理(P< 0.05),但C10与C20、C30与C40处理间差异均不显著(P> 0.05),根系GR 酶活性在各镉处理间,仅C40显著小于C20处理,下降26.94% (P<0.05),其余镉处理间均无显著差异(P> 0.05)。
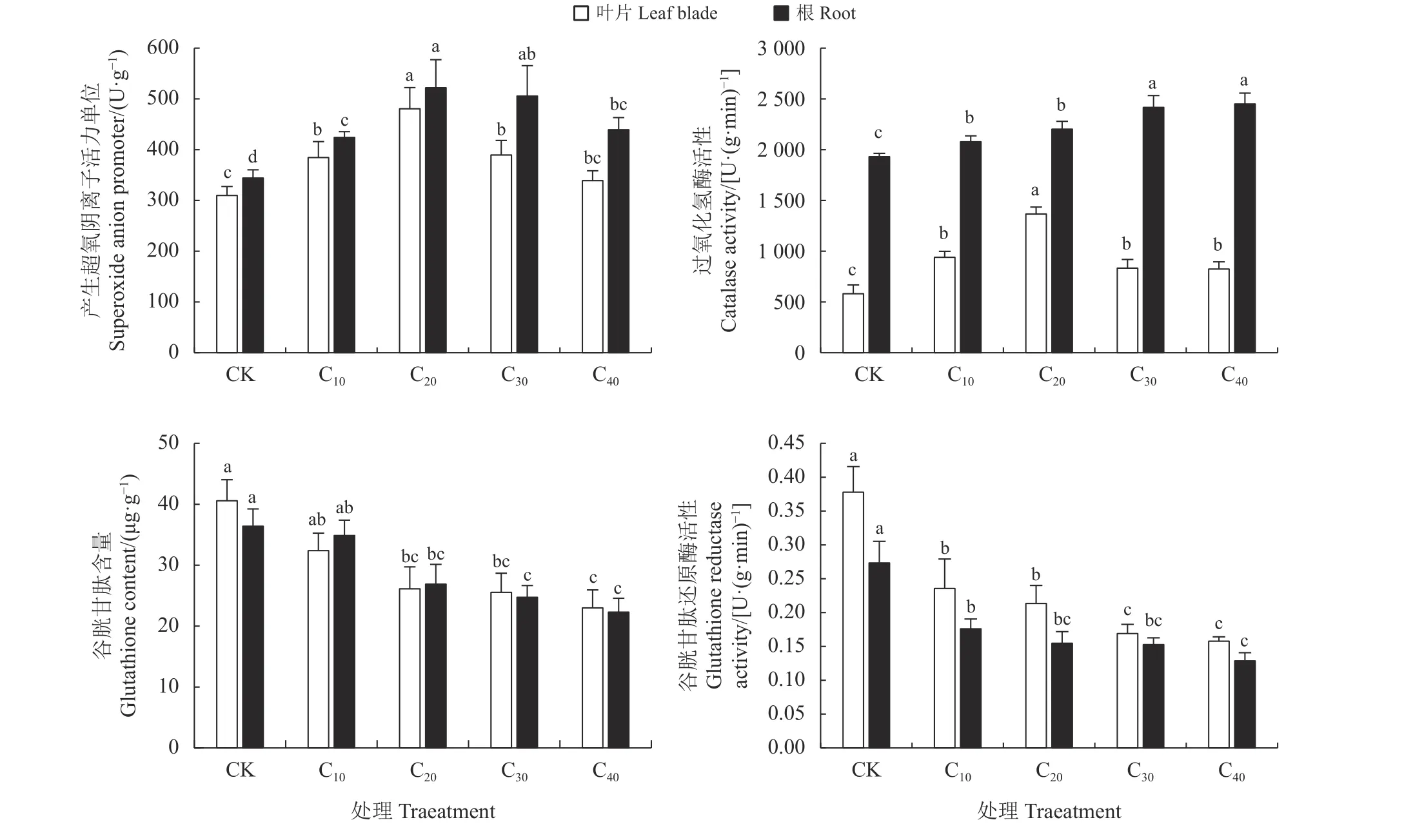
图4 不同处理杞柳的产生超氧阴离子活力单位、过氧化氢酶活性、谷胱甘肽含量、谷胱甘肽还原酶Figure 4 Superoxide anion promoter, CAT, GSH, GR of Salix integra following different treatments
2.3 杞柳对镉的吸收转运
杞柳对镉的吸收转运特性是其对镉污染土壤修复潜力的重要体现,随着镉浓度的不断增加,杞柳地上、地下部镉的富集浓度均持续显著上升(P<0.05),各个镉胁迫处理下杞柳地上部镉浓度均大于100 mg·kg−1(表3)。在C10处理的去除率最高(27.35%),C20、C30和C40处理的去除率显著小于C10(P< 0.05),但C20、C30和C40间差异不显著(11.27%~14.97%)(P> 0.05),且杞柳吸收的镉主要富集在叶片中,其次为根系、茎表皮中,茎最低(图5)。C20、C30、C40处理的杞柳转移系数显著大于C10(P< 0.05),但C20、C30、C40处理间差异不显著(P> 0.05)。此外,杞柳富集系数随镉处理浓度增加而显著下降(P< 0.05),表明高浓度的镉胁迫处理促进镉从根系到地上部的运移,但杞柳的富集能力会受到高浓度镉胁迫的限制。
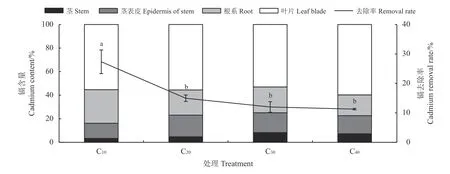
图5 不同处理杞柳植株镉的分配及镉去除率Figure 5 Distribution of Cd in plants and removal rate of Cd in Salix integra following different treatments

表3 不同处理下杞柳植株镉浓度及吸收转运特性Table 3 Cd concentration in plants, absorption and transportation characteristics of Salix integra following different treatments
3 讨论
杞柳有抗雨涝、生根迅速、根系发达、生长快速、易繁殖等特点,具有作为镉污染修复材料的潜力。已有研究主要通过描述镉胁迫下杞柳生物量的变化以表征杞柳的耐镉性[13-14],而本研究依据不同浓度的镉胁迫处理下杞柳生物量的变化,通过统计分析得出镉胁迫对杞柳的半抑制浓度为25 mg·L−1,进一步明确杞柳对镉胁迫的耐受性。同时,因为杞柳具有一次扦插多年收割的特性,地上部大量富集的镉可通过收割来提取,从而达到修复镉污染的目的[22]。为了进一步了解镉在杞柳植株体内的分配,将杞柳分为茎、茎表皮、叶片、根系四部分进行镉浓度测定,得出镉富集的表现为叶片 > 根系 > 茎表皮 >茎。而杞柳茎是良好的编制材料,茎中镉的低积累也为其作为产品创造经济效益而无安全风险提供了理论支撑。但是,这与张晓丽等[23]对27 种无性柳的研究不一致,其富集的镉多集中于根系,这种差异可能是因品种不同而异。本研究发现,在大于10 mg·L−1的镉污染营养液中,杞柳地上部镉浓度均大于100 mg·kg−1,且其转运系数大于1[24],表明杞柳对镉不仅具有较强的耐受性,而且可作为新型的超积累植物应用于镉污染土壤修复。
镉胁迫下,植物细胞受过量镉的影响产生大量超氧阴离子,从而导致植物体内的D1 蛋白受到氧化损伤[25],超氧阴离子生成速率的增加将导致植物衰老死亡[26]。同时,植物体内也会激发相应的抗氧化机制来清除细胞内过量的过氧化物质,过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)和谷胱甘肽(GSH)均为植物抗氧化系统的重要组成部分[27-29]。杞柳在受到镉胁迫后,叶片与根系中的产生超氧阴离子活力单位上升,表明镉胁迫致使杞柳体内形成氧化胁迫。而杞柳叶片和根中CAT 酶活性在镉胁迫下上升,有研究表明CAT 酶可有效清除植物细胞内的过氧化物质,因此,杞柳通过提高体内CAT 酶活性来缓解自身所受氧化胁迫[30]。同时,杞柳叶片CAT 酶活性随镉处理浓度增加呈“先升后降”的变化趋势,这与郭艳阳等[31]发现玉米(Zea mays)叶片在氧化胁迫下CAT 酶活性随胁迫增强表现为先上升后下降的结果相一致。有研究认为,中度氧化胁迫促使植物体内抗氧化酶活性上升以清除过氧化物质,但严重的氧化胁迫会抑制植物抗氧化酶的活性[32]。GR 酶是维持抗坏血酸-谷胱甘肽(AsA-GSH)平衡的关键酶,可将氧化型谷胱甘肽(GS-SG)还原为谷胱甘肽(GSH) 来缓解植物所受胁迫[33]。本研究还发现,叶片和根系的GSH 含量随着镉浓度增加而逐渐下降,这可能是与其大量合成植物螯合素与镉螯合缓解杞柳镉胁迫密切相关[34]。有研究表明植物和分裂酵母菌可以合成镉结合肽,用于响应和抵御镉胁迫,这种植物螯合素是从GSH 衍生而来[35]。此外,杞柳叶片和根系GR 活性在镉胁迫下显著降低(P<0.05),这与王红等[36]发现镉胁迫降低水稻(Oryza sativa) GR 酶活性的结果相一致。
杞柳主要通过扦插进行繁育,因此研究镉胁迫对杞柳根系生长发育的影响,可进一步明确其作为镉污染修复植物的潜力[37]。试验表明,杞柳根系的响应分为两方面,一方面是杞柳根系体积、表面积等随镉浓度的上升而受到抑制,根系体积在C10处理时下降38.39% (P< 0.05),并且胁迫的抑制作用随镉浓度增加而增强,在C40处理时下降幅度高达92.73% (P< 0.05),这与王树凤等[14]研究发现的镉胁迫下杞柳根系体积下降的结果相一致;另一方面,杞柳根系分形维数、连接数、节点数、根尖数和分叉数受到镉胁迫的诱导上升,这与李小艳等[38]对杞柳在盐胁迫下根系的响应相一致,在受到盐胁迫后根尖数存在“低促高抑”的变化趋势。因此,杞柳根系在受到镉胁迫后根系体积与表面积等降低,但根系根尖数与节点数等上升,从而在根系生长受阻的情况下维持养分吸收的能力[39]。综上所述,杞柳在镉胁迫下根系生长形态改变以及叶片与根系生理生化反应的调节能力,体现了杞柳对镉胁迫的抗逆响应及其应用于镉污染土壤的修复潜力。
4 结论
杞柳幼苗对镉胁迫具有较强的耐受性,其镉胁迫的半抑制浓度为25 mg·kg−1。同时,杞柳幼苗具有较高的镉富集转运特性(TF > 1;BCF > 10),吸收的镉主要富集于叶片,有利于通过收割地上部移除污染土壤中的镉。在镉胁迫下,杞柳幼苗叶片和根系的产生超氧阴离子活力单位上升,且CAT 酶活性上升以清除过氧化物质,同时叶片和根系GR 酶活性与GSH 含量下降。此外,虽然镉胁迫抑制了杞柳幼苗的生长,但提高了根系分形维数、连接数、节点数、根尖数和分叉数,促进其根系构型形成,增强根系养分吸收能力保障植物生长。综上所述,杞柳具较强的耐镉性并在镉污染土壤修复中具有较好的应用潜力。

