基于SWE及CEUS的甲状腺乳头状癌诊断模型的建立
李 宁,阚艳敏,李晓松,王艺桦,马 琳,李 劼
华北理工大学附属医院超声科,河北 唐山 063000
随着人们生活水平的提高、保健意识的增强以及医疗水平的提升,甲状腺结节的检出率呈升高趋势,直至近年来才逐渐趋于稳定[1-2]。研究[3]报道7%~15%的甲状腺结节患者为恶性,其中甲状腺乳头状癌(papillary carcinoma of the thyroid,PTC)为最常见的病理学类型,所占比例高达90%,其恶性程度较低,如果得到及时治疗,预后较好。目前剪切波弹性成像(shear wave elastography,SWE)及超声造影(contrastenhanced ultrasound,CEUS)技术广泛应用于甲状腺结节的检查,通过观察结节的弹性成像定量参数及微循环灌注等从定性及定量方面为甲状腺结节的鉴别诊断提供客观依据。本研究旨在建立基于SWE及CEUS的PTC诊断模型,为临床对PTC的早期诊断及精准治疗提供影像学依据,提高患者远期生存率。
1 资料和方法
1.1 研究对象
选取2018年9月—2020年3月于华北理工大学附属医院住院拟行甲状腺结节切除术的患者79例,其中男性27例,女性52例,年龄25~70岁,共85个结节随机分为建模组(72个结节)与验证组(13个结节)。其中建模组结节依据术后病理学检查结果分为PTC组(35个)和非PTC组(37个);验证组结节中PTC 6个,非PTC 7个。
纳入标准:常规超声检查提示美国放射学会(American College of Rediology,ACR)甲状腺影像报告和数据系统(Thyroid Imaging Reporting and Data System,TI-RADS)分类3类及以上拟行甲状腺结节手术切除的患者;患者能配合完成SWE及CEUS检查。排除标准:结节位置较深、患者颈部肌层较厚等,干扰SWE者;有手术禁忌证,无法获得术后病理学检查结果者;对鸡蛋、牛奶等过敏,无法完成CEUS检查者。
本研究通过医院伦理委员会审批,且在检查前向受检者告知检查方法及目的,受检者均已签署知情同意书。
1.2 仪器及方法
1.2.1 检查仪器
SWE检查采用法国SuperSonic Imagine公司Aixplorer超声诊断仪,使用线阵探头L15-4,探头频率为4~15 MHz;CEUS检查采用德国Siemens公司的Acuson S2000超声诊断仪,使用线阵探头L9-4,探头频率为4~9 MHz,造影剂选用意大利Bracco公司生产的SonoVue(声诺维)。
1.2.2 检查方法
SWE检查:常规超声检查确认目标结节后,切换至SWE模式,上方图像为基于常规超声的弹性成像模式图,可观察结节及周边组织的硬度,并测得感兴趣区的杨氏模量值,下方图像则为常规超声图像,可双幅对比观察。在检查过程中,选取大小合适的取样框,嘱患者屏气以使图像趋于稳定,后静置3 s,定帧存图。采用Q-Box测量软件测量相关的SWE参数:结节的弹性最大值(maximum elasticity,Emax)、最小值(minimum elasticity,Emin)、均值(mean value,Emean)、标准差(standard deviation,Esd)、与周围正常组织的比值(ratio to normal surrounding tissue,Eratio),测量时取样框选用2 mm,于结节最硬处、同水平甲状腺正常组织处各采集3次弹性图像,取其平均值。
CEUS检查:通过常规超声选定目标结节,选择结节最佳血供的切面切换到CEUS条件,保持探头稳定。用5 mL生理盐水将造影剂SonoVue配成六氟化硫微泡混悬液,连续振荡一定时间后,抽取2.5 mL经肘正中静脉团注,然后快速注入5 mL生理盐水进行冲管,动态观察CEUS情况并记录3 min,并将动态图像记录存盘。动态观察并记录甲状腺结节的增强程度(无增强,低增强,等增强,高增强)、增强特点(无规律,向心性增强,环状增强)、造影剂分布(均匀,不均匀)、与周边甲状腺实质进入及消退时间比较(早于,同步,晚于)等征象;分析造影时间-强度曲线,记录甲状腺结节的达峰浓度(peak concentration,Peak)、达峰时间(peak time,TP)、时间-强度曲线下面积(area under the time-intensity curve,AUCt)、平均渡越时间(mean transit time,MTT)。
1.3 统计学处理
采用SPSS 22.0统计软件对数据进行统计学分析。计量资料符合正态分布的采用±s表示,不符合正态分布的以M(P25,P75)表示,计数资料以频数或率表示;两组间计量资料的比较采用独立样本t检验或秩和检验,率的比较采用χ2检验;以超声特征为自变量,以是否为PTC为因变量,采用Fisher逐步判别分析法,建立基于SWE及CEUS的PTC综合诊断模型,并采用自身检验法、留一交叉检验法、样品二分法(验证组结节)进行检验,最后构建受试者工作特征(receiver operating characteristic,ROC)曲线对诊断模型效能进行评价。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 PTC组与非PTC组超声特征比较
2.1.1 超声参数比较
研究结果显示两组间Emax、Emin、Emean、Esd、Eratio差异均有统计学意义(P<0.05,表1)。
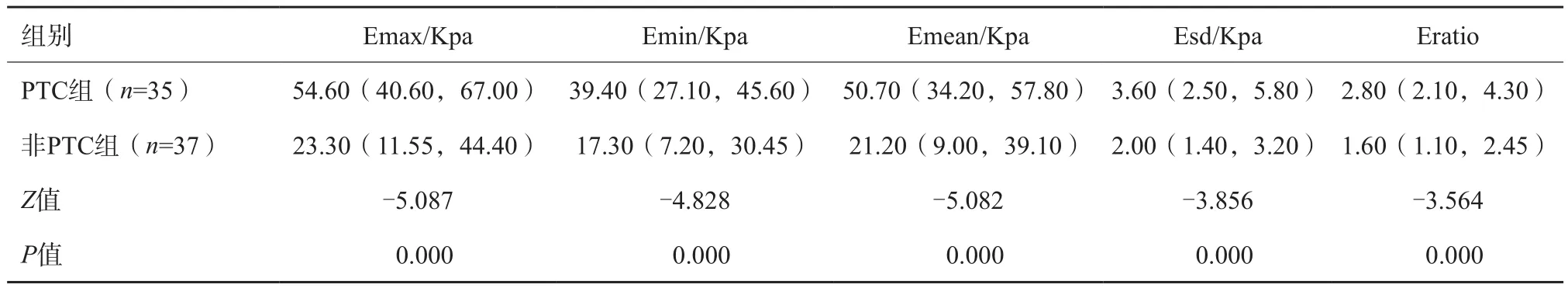
表1 PTC组、非PTC组SWE参数比较
2.1.2 CEUS特征及参数比较
结果显示两组间增强程度、增强特点、造影剂分布、与周边甲状腺组织进入时间比较差异、Peak、AUCt差异均有统计学意义(P<0.05),两组间与周边甲状腺组织消退时间比较、TP、MTT差异无统计学意义(P>0.05),详见表2、3。
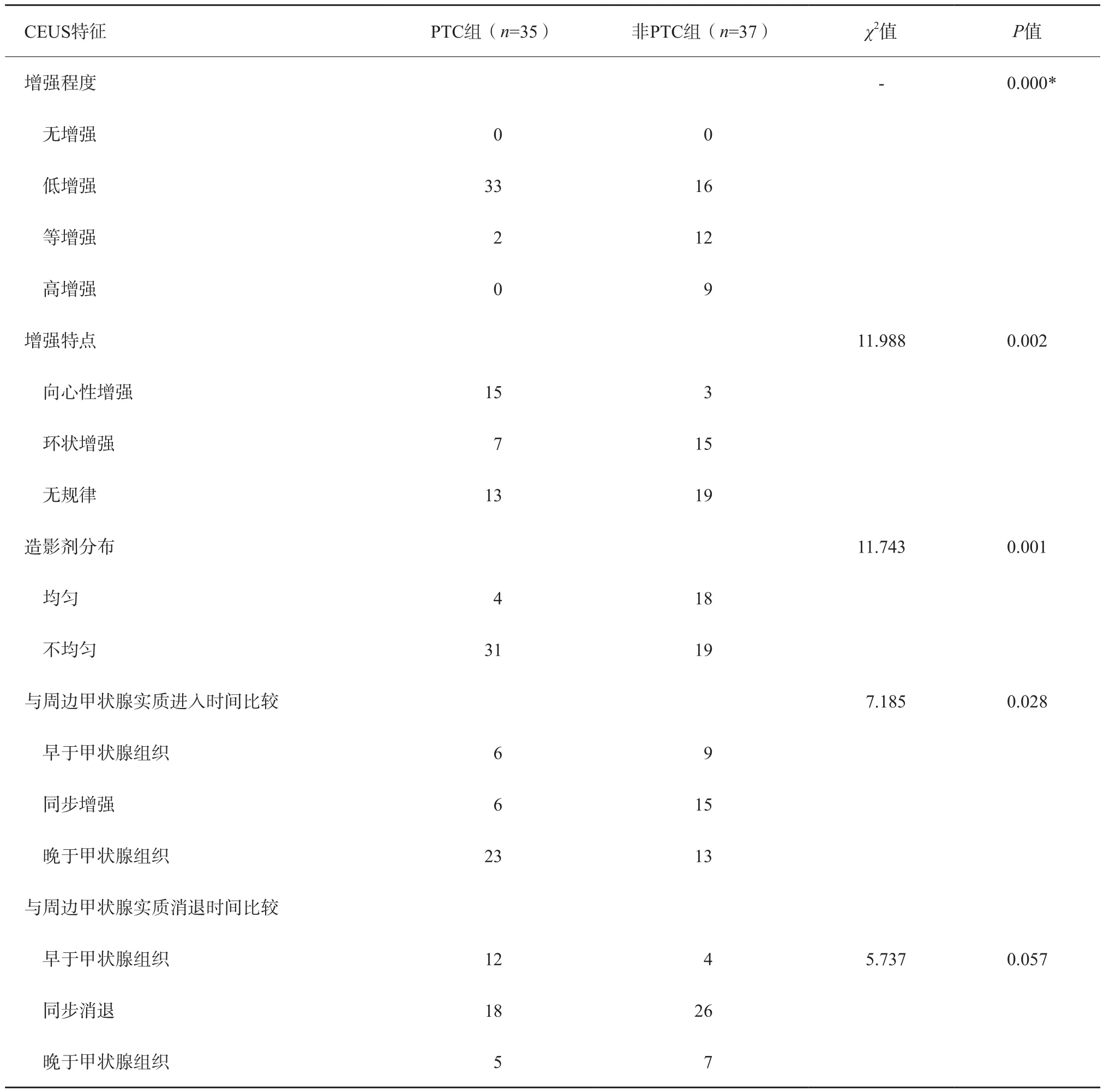
表2 PTC组、非PTC组CEUS特征比较
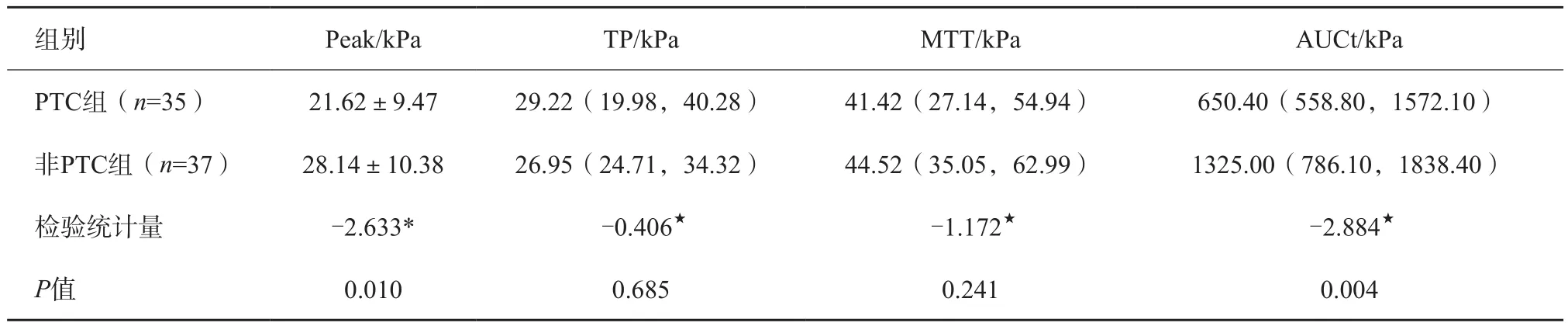
表3 PTC组、非PTC组CEUS参数比较
2.2 应用Fisher逐步判别分析法建立、验证及效能评价PTC诊断模型
2.2.1 诊断模型的建立
以是否为PTC为因变量,以超声特征为自变量,分别进行赋值(表4);采用线性回归方法,对两组差异有统计学意义的指标进行多重共线性诊断,其中Eratio、造影剂分布、增强程度、增强特点、与周边甲状腺实质进入时间比较、Peak、AUCt的膨胀因子(variance inflation factor,VIF)值均<5,认为上述变量间不存在多重共线性,可采用Fisher判别分析进行研究;进而采用Fisher逐步判别分析法进行分析,最终Eratio、增强程度、AUCt进入诊断方程:PTC=-4.182+1.126X1+2.556X3+0.001X7,非PTC=-6.596+0.416X1+4.576X3+0.002X7(X1、X3、X7分别代表Eratio、增强程度、AUCt),详见表5。

表4 各变量名及赋值情况表
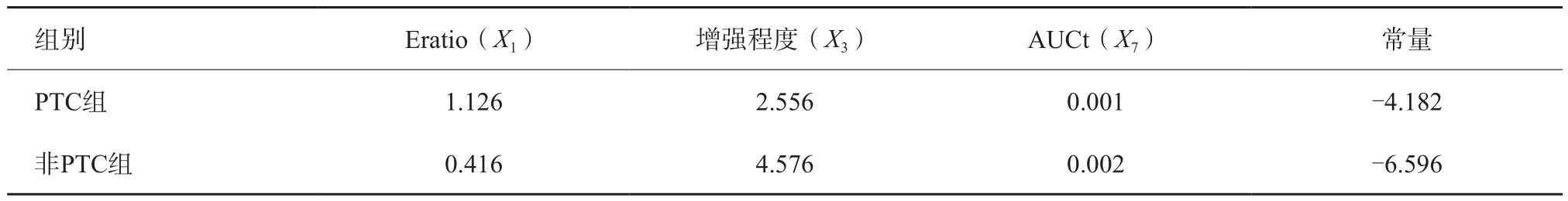
表5 分类函数系数
2.2.2 诊断模型的验证
分别采用自身验证法、留一摘要交叉验证法及样品二分法(验证组结节)对诊断模型进行验证,结果显示其正确率及误判率分别为81.9%及18.1%、79.2%及19.8%、84.6%及15.4%(表6~8)。
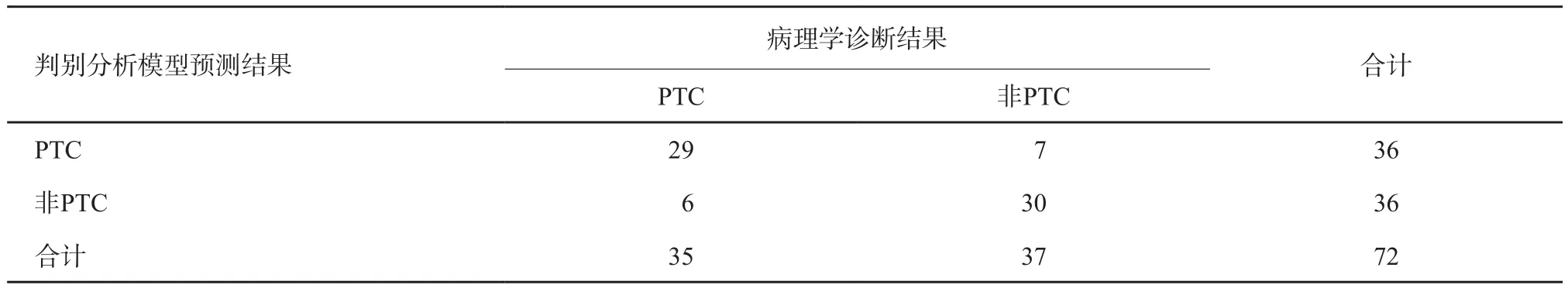
表6 判别分析模型自身验证结果
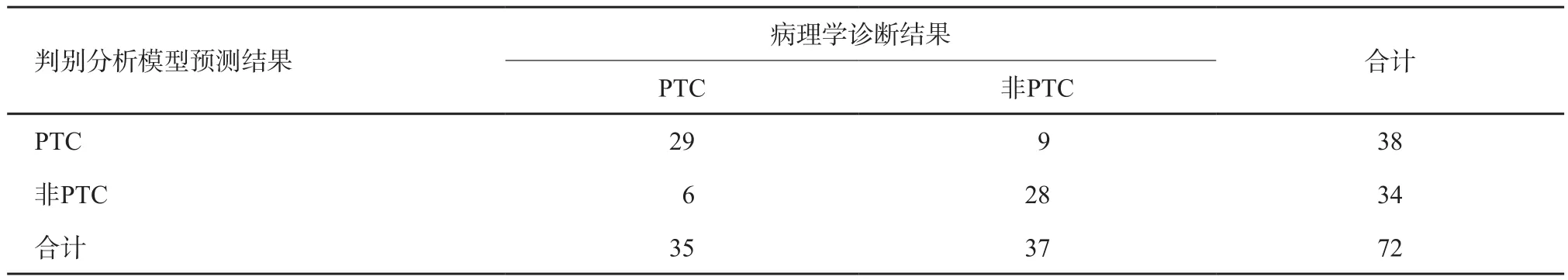
表7 判别分析模型交叉验证结果
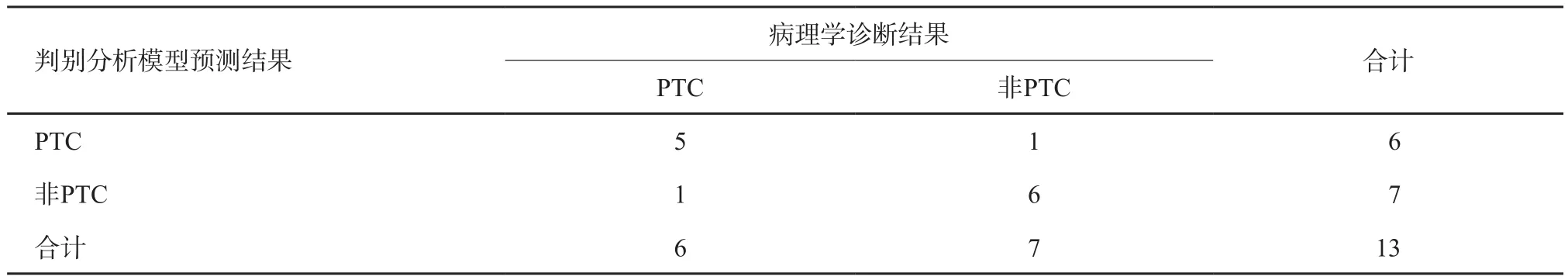
表8 样品二分法验证结果(验证组结节)
2.2.3 诊断模型的效能评价
构建ROC曲线对诊断模型的诊断效能进行评价,结果显示曲线下面积为0.820,95% CI为0.716~0.923,灵敏度及特异度分别为82.9%、79.1%(图1)。
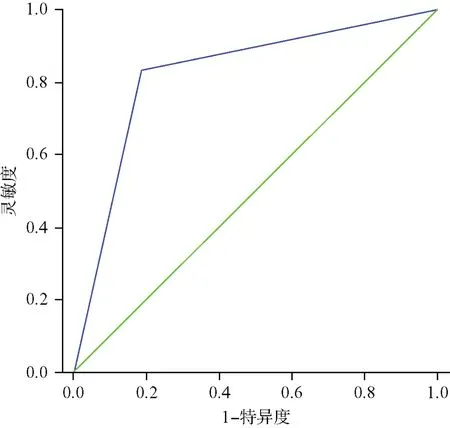
图1 PTC诊断模型效能评价
3 讨 论
甲状腺癌作为临床常见的恶性肿瘤,发病率呈现逐渐上升的趋势,防治形势较为严峻,因此对甲状腺结节良恶性的准确评估及正确诊断是目前非常重要的问题[5-6],不同病理学类型的甲状腺癌,诊疗方式、预后、远期生存率不完全相同,因此为临床医师提供准确的术前诊断依据,指导其对不同病理学类型甲状腺癌患者实施精准化个体治疗十分重要。超声检查作为甲状腺结节检查及诊断的首选方法,安全、廉价、可重复性高,在临床诊疗决策中有重要价值,可以快速分析及鉴别PTC[7-8]。
SWE通过测量组织弹性参数即杨氏模量值反映组织硬度,杨氏模量值越大代表组织硬度越大,本研究中PTC组Emax、Emin、Emean、Esd、Eratio均较非PTC组明显增加,主要是由于大部分PTC结节组织内含有较多的纤维组织、钙化小体等,组织硬度较高,而良性病变如结节性甲状腺肿等主要由滤泡细胞组成,组织硬度较小[9]。研究[10]表明,甲状腺癌细胞刺激内皮细胞合成并释放大量血管内皮生长因子,以此诱导新生血管的形成,从而为肿瘤细胞的增殖提供能量与养分,故新生血管形成被认为是甲状腺癌的重要生物学行为之一,因此结节内新生血管的充分显示可以为良恶性的鉴别诊断提供重要依据。CEUS通过静脉注入超声造影剂,在甲状腺结节内产生大量液-气界面,病灶的后散射强度得到增强,血管多普勒信号增加,微血管血流灌注得到显示,从而实现实时、动态观察病灶血管分布情况的目的。本研究中PTC组结节呈现不均匀低增强,Peak与AUCt均较非PTC组减小,与国内部分研究[11-12]结果一致,主要原因为虽然癌组织中有大量新生血管形成,但在生长过程中造成的血管破坏使其绝对数量变少,且分布不均,因此同一结节内可同时出现局部血供丰富和局部血供缺乏两种情况。
Fisher判别分析是在分类确定的条件下,根据某一研究对象的各种特征值判别其类型归属问题的一种多变量统计分析方法。一般而言,建立判别函数前要将样本随机分成两个部分,分别占总样本量的85%和15%,前者用于建立判别函数,后者用于考核判别函数的判别效果,用验证样本计算的误判概率作为前瞻性误判概率的估计则比较客观,本研究采用了这种样本分类,分别建立了建模组和验证组。同时为了避免影响判别效果,采用逐步判别分析法,剔除部分变量,将判别效果好的变量引入分类函数,最终结节Eratio、增强程度、AUCt进入诊断方程,表明上述3个参数在PTC的诊断及鉴别诊断中有重要价值,与相关研究[13-14]结果一致,以此建立的诊断方程:PTC=-4.182+1.126X1+2.556X3+0.001X7,非PTC=-6.596+0.416X1+4.576X3+0.002X7(X1、X3、X7分别代表Eratio、增强程度、AUCt)。应用自身验证、交叉验证及验证组结节对诊断模型进行检验,正确率分别为81.9%、79.2%、84.6%,表明诊断模型具有较高的应用价值。以诊断模型的诊断结果为检验值,将病理学检查结果作为“金标准”,对诊断模型的诊断效能进行分析,结果显示曲线下面积为0.820,灵敏度及特异度分别为82.9%、79.1%,进一步表明此模型有一定的诊断价值,可以应用于临床。
在自身验证、交叉验证及验证组结节验证中分别有13例、15例、2例误判患者,表明诊断模型仍然存在难以鉴别部分PTC与非PTC患者超声特征的情况,其可能的原因:① 本研究样本量有限,对诊断模型参数的纳入产生影响,从而影响诊断结果;② PTC结节内由于纤维组织成分多,硬度较高,而少量非PTC结节也可能存在纤维化成分,滤泡细胞被破坏或萎缩,胶质浓缩等,导致结节硬度增加[9];③ 多数PTC结节呈现不均匀低增强,部分非PTC结节伴有大量纤维化、囊性变时也会呈现不均匀增强、低增强现象[15]。因此在实际工作中需将判别结果与超声特征结合起来,对患者进行综合分析,减少误判。
本研究的不足之处与改进方向:本研究样本量较小,所建立诊断模型的诊断效能有限,在今后的工作中将加大样本量,进一步筛选出可以充分反映PTC结节特征的超声参数,并建立更高效能的诊断模型,以提高临床医师的诊疗效率。
综上所述,本研究以甲状腺SWE和CEUS技术为基础,应用Fisher逐步判别分析法建立PTC的诊断模型,可以综合反映PTC结节SWE及CEUS定量及定性特征的表现,为临床诊断及鉴别诊断提供依据。

