抑瘤素M在炎症性疾病中的研究进展
罗怡婧,刘安文,曾治民
(1.南昌大学a.第一临床医学院2017级;b.第二附属医院肿瘤科;2.江西省肿瘤临床转化重点实验室,南昌 330006)
抑瘤素M(OSM)属于IL-6细胞因子家族。OSM最早被发现是一种抑制黑素瘤细胞生长的细胞因子,故被称为抑瘤素[1]。OSM参与了体内多种生物调节过程,对不同类型细胞具有不同的作用。OSM能够在不同的微环境中促进和抑制炎症,调节免疫应答反应[2],这些特性提示OSM可作为感染的早期预测指标、疾病的辅助诊断指标、器官的损伤预后指标,更可靠地标志和评估了体内炎症发生阶段,可为患者提供正确治疗方案。本文就OSM在炎症中的作用机制及研究进展作一综述。
1 OSM信号
OSM主要由单核/巨噬细胞,活化的T细胞、嗜中性粒细胞、活化的肥大细胞、嗜酸性粒细胞、妊娠期的蜕膜细胞、小胶质细胞和树突状细胞产生[3]。OSM先与受体分子gp130结合,随后招募不同的第二受体分子,故OSM存在Ⅰ型受体(gp130/LIFRβ)和Ⅱ型受体(gp130/OSMRβ)两种受体[3]。IL-6家族细胞因子可激活JAK-STAT3信号通路、MAPK信号通路和PI3K-Akt信号通路等,而OSM相较其更为复杂,主要有JAK/STAT信号通路、MAPK激酶信号通路(其中包括ERK、p38和JNK)、PI3K/Akt信号通路和PKCδ信号通路[3]。各信号通路均由OSM的两种受体介导,其中Ⅰ型受体是LIF等IL-6家族细胞因子的受体;而Ⅱ型特异性受体的信号通路则更为多样。gp130本身无激酶活性,它介导的信号传递依赖于细胞内酪氨酸(Tyr)蛋白激酶JAK、LIFRβ和OSMRβ亦可结合JAK介导信号传递。JAKs家族中有4个成员,分别为JAK1、JAK2、JAK3、TYK2,Ⅰ型受体结合的优势成员是JAK1,Ⅱ型受体则对JAK1和JAK2的结合能力相等[3]。STATs是JAK下游具有SH2结构的主要信号分子,JAK可以将其磷酸化激活,随后STATs移入细胞核作为转录因子调节基因表达,这称为JAK/STAT通路[3]。其中Ⅰ型受体可以激活STAT1、STAT3,Ⅱ型受体则可激活STAT1、STAT3和STAT5,而OSM激活STAT6的分子机制尚未明确[3]。还有一条重要的路径是Ras-Raf-MAPK通路,其中包括激活ERK、p38和JNK。但是Ⅰ型受体和Ⅱ型受体的激活路径不相同,Ⅰ型受体通过SHP2-Grb2-SOS路径激活MAPKs,Ⅱ型受体通过Shc-Grb2-SOS路径激活MAPKs,简单地来说,也就是Grb2的适配器不同。除此之外,OSM可独特地激活PI3K/Akt信号通和PKCδ信号通路,但其分子机制有待研究。OSM的信号通路同样也需要负性调控机制,主要通过SOCS3来介导,可通过MEK-ERK1途径调节SOCS3转录的稳定性,gp130可直接结合SOCS3,但OSMRβ则需要JAK来结合SOCS3[3]。
OSM信号既有促炎作用,又有促纤维化作用,并且在不同疾病中表现出不同机制(图1)。OSM主要通过JAK/STAT通路发挥强大的促炎作用;已知JAK抑制剂可以评估类风湿性关节炎、炎症性肠炎和牛皮癣等疾病的疗效,但是其治疗效果略有差异。在不同炎症性疾病和不同细胞类型中,OSM所激活的STAT转录因子可能有所不同,例如类风湿性关节炎患者滑膜成纤维细胞中OSM与TNF-α可协同诱导STAT3磷酸化,进而增强TNF-α对IL-6、MCP-1和RANTES的作用,抑制TNF-α对IL-8和GROα的作用,从而达到了促炎效果[4]。OSM对纤维化过程的影响主要体现在参与调控胶原蛋白的产生、增殖和迁移以及调节结缔组织细胞中金属蛋白酶(MMPs)及其抑制剂的平衡上。不同的器官中OSM在其中发挥的特性不同,有的需要依赖于TGFβ通路,有的则是OSM的特性。
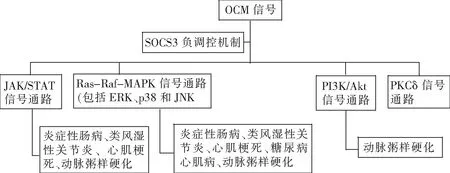
图1 OSM信号通路致常见炎症性疾病的机制
2 OSM与炎症相关疾病
炎症发生可以归结于促炎物质和抗炎物质之间平衡过程的打破。OSM不是直接在炎症过程中起作用,而是在炎症周期通过调节一条平衡炎症纽带上的物质来影响炎症。OSM是通过诱导或抑制炎症周期中促炎因子以及趋化因子来发挥促炎或抑炎作用的,如可以通过诱导炎性细胞因子和黏附因子来引发炎症,包括p-选择素、e-选择素、ICAM1、VCAM1、IL-6、CCL2和中性粒细胞趋化因子[5];通过抑制TNF-α的产生和GM-CSF、IL-8、CXC趋化因子的基因表达,诱导基质金属蛋白酶(TIMP-1)、急性期蛋白血清淀粉样蛋白A(SAA),α1-蛋白酶抑制剂(α1-Pi)和抗胰凝乳蛋白酶的产生来抑制炎症[6-7]。OSM和OSMR在肠炎(IBD型)、类风湿性关节炎、肺部炎症、皮炎、败血症、肾炎、心脏疾病等炎症性疾病的组织中高表达(表1)。

表1 OSM在炎症性疾病中的影响
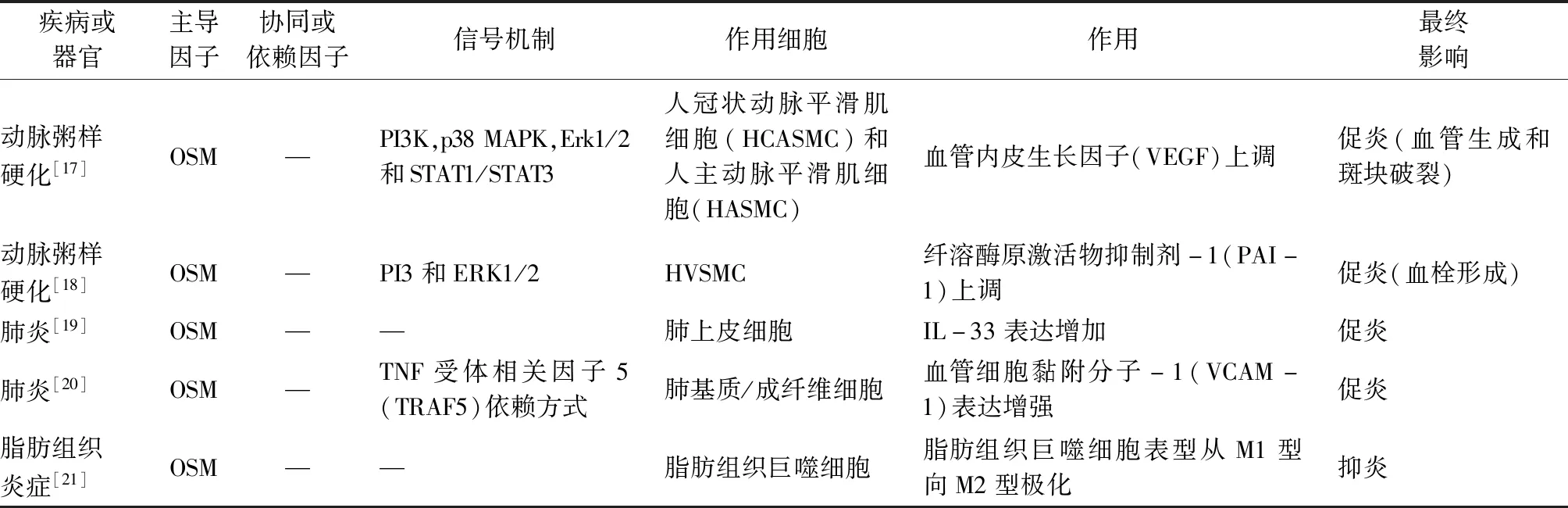
表1(续)
2.1 OSM与炎症性肠病
IBD是一种复杂的肠道慢性炎症。OSM在IBD肠组织中表达增加,IBD患者结肠OSM的上调与OSMR受体的过度表达有关。目前,TNF-α抗体是IBD的主要治疗方法,然而高达40%的患者对抗肿瘤坏死因子药物无反应[22]。OSM在抗肿瘤坏死因子α(TNF-α)耐药IBD模型中表现出促炎特性,可刺激CCD18Co细胞(原代人肠间质成纤维细胞)引起STAT3、STAT1、Akt和ERK1/2 MAP激酶磷酸化,诱导IL6、CCL2、CXCL1和CXCL10表达,进而达到白细胞招募作用来促炎[8];WEST等[8]发现OSM和OSMR与IBD患者抗TNF-α抗体治疗耐受有关,并提出OSM是IBD型肠炎的潜在治疗靶点。TAN等[23]研究发现一种小肠结肠菌可以通过减少OSM分泌和增强肠屏障功能来减轻IBD患者的炎症。近年来,有学者[24]针对OSM-OSMR轴采用分子模拟设计了3个小分子调节剂用于治疗IBD。这些成果让抗TNF治疗IBD患者的眼中燃起希望之光,相信在未来不久人类定能攻克这一难题。
2.2 OSM与类风湿性关节炎
类风湿性关节炎是一种以关节滑膜炎为特征的慢性全身性自身免疫性疾病,其中滑膜成纤维细胞产生细胞因子、趋化因子和促分解代谢酶是导致关节内软骨和骨被破坏的主要原因。在类风湿性关节炎患者的滑膜液中发现OSM浓度较高。OSM有显著关节破坏引发炎性关节炎的潜力。在关节间质细胞(包括滑膜成纤维细胞和成骨细胞)中,OSM通过JAK/STAT和MAPK通路增强了炎症介质和细胞因子受体的表达,包括IL-6、CCL2、CCL13、CXCL1、IL-1R1、ICAM1、OSMR、gp130和RANKL,但其具体信号机制尚待研究[5,9]。除此之外,类风湿性关节炎滑膜成纤维细胞中OSM与IL-1β协同诱导JAK/STAT通路激活致IL-6、RANKL等炎症因子表达上调[9]。OSM与TNF-α协同可诱导类风湿性关节炎滑膜成纤维细胞中STAT3的磷酸化,增强IL-6、MCP-1和RANTES的表达,抑制IL-8和GROα的表达[4]。所以,人们希望OSM能成为类风湿性关节炎的治疗靶标,但目前针对类风湿性关节炎使用人源化抗OSM单克隆抗体(GSK315234)并未取得药效,该研究存在自限性,即GSK315234的中等亲和力和快速脱模率[25]。gsk233811,是一种最近被开发出来的亲和力比GSK315234高的人源化免疫球蛋白G1 kappa(IgG1k)单克隆抗体,也可以抑制OSM与gp130受体的结合[26]。
2.3 OSM与心脏疾病
急性心肌梗死的本质是心肌坏死,在斑块破裂及血栓形成阶段产生强烈的炎症反应。在心肌梗死早期,OSM在心肌细胞中表达增加,可通过抑制心肌细胞凋亡、心肌细胞去分化和促进Reg3β分泌三方面来保护心血管。OSM可抑制心肌细胞凋亡。OSM可以在H9C2心肌细胞中通过激活STAT3信号通路诱导siNotch3基因来降低心肌梗死产生的活性氧和心脏组织氧化应激水平,从而减少心肌梗死面积[10-11]。OSM亦在心肌细胞去分化功能中扮演重要作用。在急性心肌梗死的小鼠模型中,OSM治疗可诱发心肌梗死后心肌细胞的去分化和干细胞标志物的上调,说明OSM参与心肌细胞去分化和心脏重塑,心肌细胞去分化保护心肌梗死后的心脏[12]。在DCM和心肌梗死中,OSM通Ras/Raf/MEK/Erk通路介导心肌重构,激活胎儿基因(c-kit、Runx1、Dab2等)导致心肌细胞去分化[12]。另外,有研究[15]表明OSM在糖尿病心肌病中心肌去分化依赖于B-Raf/MEK/Erk信号通路,并诱导了祖细胞标志物的上调(c-kit、scal-1、Runx1、ANP、α-SM肌动蛋白)。此外,心肌细胞去分化和增殖的特征是肌节变性,有研究[27]表明OSM治疗可增加心肌细胞基质金属蛋白酶2(MMP-2)的表达和活性,从而导致肌节变性,但信号通路尚待研究。OSM可促进Reg3β分泌。在心肌梗死过程中,OSM刺激可通过JAK1/STAT3信号诱导分化的心肌细胞产生Reg3β,从而聚集巨噬细胞促进中性粒细胞清除来抑制炎症[13-14]。然而,心脏疾病晚期,OSM在血清中水平持续升高,则会导致心肌细胞持续去分化,从而心脏收缩能力下降,导致扩张型心肌病的发生,最终发展为心力衰竭[10]。在心力衰竭(HF)中,针对OSMRβ胞外域的抗体施用或OSMRβ基因的单个等位基因的遗传失活可以改善心脏功能[28]。这提示可以通过OSMR抗体、减少OSMR表达和抑制OSM心肌去分化信号通路来抑制DCM的病程发展。
动脉粥样硬化是一种慢性炎症性疾病。已有研究报道OSM可以在人主动脉外膜成纤维细胞或平滑肌细胞中诱导炎症反应[29],并且OSM和OSMR-β在小鼠的动脉粥样硬化血管壁中表达增加[16]。OSM参与了动脉粥样硬化的发展过程,如血管硬化、血管生成、斑块破裂和血栓形成。OSM参与了动脉粥样硬化血管硬化的过程。动脉粥样硬化和心脏瓣膜病中血管钙化离不开ALP的作用,ALP可以诱导HVSMC分化成成骨细胞。以往认为只有在OSM和TNF-α的共同作用下才能诱导HVSMC表达ALP,近期KAKUTANI等[16]发现OSM可通过JAK3/STAT3途径促进HVSMC分化成成骨细胞从而导致动脉粥样硬化血管钙化。OSM促进动脉粥样硬化血管生成和斑块破裂。血管内皮生长因子(VEGF)是新生血管生成的重要因子,OSM可以上调HCASMC)和HASMC中的VEGF,VEGF的表达涉及PI3K、p38 MAPK、Erk1/2和STAT1/STAT3依赖的途径[17]。此外,OSM参与了动脉粥样硬化斑块破裂的血栓形成。MIRSHAHI等[30]观察到OSM以浓度依赖性的方式增加了HVSMC裂解物中的促凝血活性(PCA),且OSM通过PI3-激酶和ERK1/2依赖性途径体外诱导HVSMC中的纤溶酶原激活物抑制剂-1(PAI-1)[18]。ZHANG等[31]发现巨噬细胞OSMRβ缺乏可减弱JAK2/STAT3信号,从而缓解动脉粥样硬化的发展。
2.4 OSM与其他疾病
OSM还参与了其他炎症,如肺炎、脂肪组织炎症、皮炎、脓毒症等,在这些疾病中均可检测到OSM及受体表达的升高。肺内OSM的主要来源是肺泡中性粒细胞,被证明可以诱导小鼠嗜酸性粒细胞浸润的炎症发生,也可以诱导肺上皮细胞分泌IL-33进而炎症发生[19]。它也可以TNF受体相关因子5(TRAF5)依赖方式体外激活肺基质/成纤维细胞,诱导血管细胞黏附分子-1(VCAM-1)的表达,进而促进嗜酸性粒细胞的外渗和积累,最终导致过敏性肺炎[20]。有研究[32]发现,敲除脂肪组织的OSMR,促进了脂肪组织炎症,反向证明OSM在脂肪组织的抑炎作用。OSM在体外可将脂肪组织巨噬细胞表型从M1型向M2型极化,M2型是抗炎型,从而抑制脂肪组织炎症[21]。目前有研究[33]通过检测重症监护病房(ICU)感染患者出入院的OSM血清水平表明OSM可能是脓毒症的一个潜在的预后标志物和治疗靶点,但探讨OSM在败血症中的作用机制研究尚不足。总之,需要更多的研究来了解OSM在肺部介导炎症、在脂肪组织抑制炎症以及在脓毒症中的作用机制,以期为消除或减缓这些炎症带来新的治疗药物靶点。
3 小结与展望
OSM在不同微环境中起着抗炎作用或促炎作用。OSM的异常表达及其促炎和抑炎机制可能成为疾病治疗的靶点。虽然已有研究表明OSM抗体无法治疗类风湿性关节炎,但这并不能说明OSM抗体这一治疗途径的失败,未来需要找寻具有更高亲和力和降低脱模率的OSM抗体,并可以将此法运用于与OSM有关的其他疾病。除此之外,还可以通过融合OSMR上的两个亚基来达到封闭受体的作用,或者对OSM的下游分子进一步研究来确定具体靶点。然而,目前对OSM关于炎症中的分子机制仍不够确切和完整。因此,未来在研究OSM参与炎症的作用机制时,应更注意结合临床,要着眼服务于临床,让基础研究发挥出更大的价值。

