低氧预适应血管内皮细胞增加神经细胞低氧耐受*
张 璞,刘晓蕾,邵 国
(1.内蒙古科技大学包头医学院,内蒙古包头 014040;2.内蒙古自治区低氧转化医学重点实验室;3.首都医科大学宣武医院低氧适应转化医学北京市重点实验室)
脑卒中具有高发病率、高复发率、高致死率和高致残率的特点,严重威胁着人类的健康和生存质量。缺血性脑卒中占脑卒中发病的85 %左右[1]。血管再通和神经保护是治疗缺血性卒中的两组主要策略[2]。吕国蔚教授最早提出低氧预适应(Hypoxic preconditioning,HPC)可以增加神经细胞对低氧缺血耐受。远隔缺血预适应(Remote Ischemic Preconditioning,RIPC)是指通过非侵入方式对非重要器官(如肢体)的反复缺血刺激使重要器官(如脑)产生对缺血/低氧的耐受[3]。RIPC以其安全无创和简单易行的特点成为治疗缺血性卒中的具有良好临床转化前景的方法。课题组前期研究发现RIPC血清外泌体中miR-126增加[4],而miR-126为内皮细胞特异的microRNA,据此推测RIPC过程中内皮细胞分泌的物质可以对神经细胞产生保护作用。本研究利用体外培养的人微血管内皮细胞(HMEC-1),对其进行HPC后分离培养基(含内皮细胞的分泌物质),观察HPC条件下内皮细胞的分泌物质对神经细胞的保护作用,探讨RIPC作用的可能细胞机制。
1 对象与方法
1.1实验细胞 人神经母细胞瘤细胞系(SH-SY5Y)购于中国科学院上海生科院细胞资源中心,人微血管内皮细胞(HMEC-1)购于上海信裕生物科技有限责任公司。SH-SY5Y细胞培养于含有10 % FBS和0.6 %青链霉素的1640完全培养基中,HMEC-1细胞培养于HMEC-1完全培养基(购于上海信裕生物科技有限责任公司),培养条件为37 ℃、21 % O2+5 % CO2+74 % N2。
1.2细胞模型构建及分组
1.2.1构建HMEC-1细胞低氧预适应模型 HMEC-1在37 ℃、1 % O2、5 % CO2的条件下低氧30 min,然后在37 ℃、20 % O2、5 % CO2的条件复氧30 min,1次低氧和1次复氧算作一个循环,重复4次。收集HPC条件下的培养基(含HMEC-1细胞HPC条件下分泌物),加入到SH-SY5Y细胞中作为HPC组;收集正常培养HMEC-1细胞的培养基,加入到SH-SY5Y细胞中作为培养基对照组(Medium-C组),同时以正常SH-SY5Y细胞培养基加入到SH-SY5Y细胞中作为空白对照组(SY5Y-C组)。三个组均在37 ℃、1 % O2、5 % CO2的条件下进行低氧培养13 h,之后复氧6 h。
1.2.2MTS检测细胞活力 以3 000个/孔的密度将SH-SY5Y细胞种入96孔板中,待细胞贴壁后,更换培养基,按照上述分组构建模型,造模完成后每孔加入20 μL MTS溶液(Promega公司),充分混匀后37 ℃孵育4 h,期间每30 min用酶标仪检测每孔在490 nm波长下的吸光值,并计算细胞活力。细胞活性计算公式为:细胞活性=[(处理组OD值-调零孔OD值)/(对照孔OD值-调零孔OD值)]×100 %。
1.2.3Western Blot检测caspase-3蛋白表达水平 收集低氧13 h复氧6 h后的SY5Y-C组、Medium-C组以及HPC组细胞,RIPA裂解液中加入蛋白酶抑制剂匀浆处理,12 000 rpm,4 ℃离心提取细胞总蛋白,BCA法检测蛋白浓度。每组取15 μg蛋白上样液加入到8 % SDS-PAGE凝胶点样孔中,电泳分离蛋白;然后将蛋白过夜转印到PVDF膜上,5 %脱脂牛奶室温封闭1.5 h,TBST洗膜3次,每次10 min;将洗好的膜在4 ℃条件下使用caspase-3一抗 (1∶1 000稀释,CST)、β-actin一抗(1∶1 000稀释,Santa)孵育过夜;室温下用山羊抗兔和山羊抗小鼠抗体(金普莱)孵育1.5 h,TBST洗膜3次,每次10 min;ECL超敏发光液浸泡PVDF膜,化学发光仪(天能公司)扫描图像并分析蛋白表达。
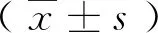
2 结果
2.1HPC血管内皮细胞培养基增加SH-SY5Y细胞低氧耐受 利用MTS检测细胞活力。以正常SH-SY5Y细胞培养基培养(未进行HPC处理)的SH-SY5Y细胞活力设为1,则SY5Y-C组、Medium-C组和HPC 组细胞的活力分别是(0.9967±0.0033)、(1.0751±0.0447)和(1.4737±0.0325)。结果显示,正常培养基与培养HMEC-1细胞的培养基在低氧条件下对SH-SY5Y细胞活力的影响无明显差异,而低氧预适应处理后的HMEC-1培养基培养的SH-SY5Y细胞活力显著增加(P<0.05),见图1。

图1 MTS检测细胞活力
2.2HPC血管内皮细胞培养基降低SH-SY5Y细胞caspase-3水平 caspase-3水平代表了细胞凋亡。利用Western Blot检测SY5Y-C组、Medium-C组和HPC 组细胞caspase-3水平。结果显示,SY5Y-C组和Medium-C组细胞的caspase-3相对水平分别为(0.9950±0.0050)、(0.9893±0.0787),HPC组细胞caspase-3蛋白水平为(0.8180±0.0361),HPC组的caspase-3蛋白显著降低(P<0.05)。见图2。
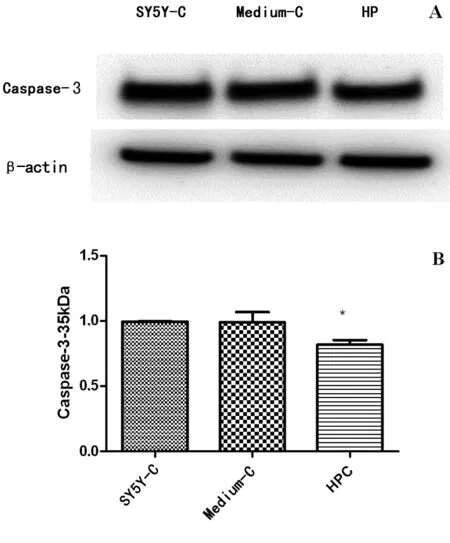
图2 HPC血管内皮细胞培养基增加SH-SY5Y细胞对低氧的耐受
3 讨论
大脑对低氧/缺血十分敏感[5],低氧/缺血可造成大脑神经损伤,引发神经功能紊乱和机能丧失等[6]。低氧预适应是一种内源性的细胞保护机制,即组织或细胞预先经过亚致死性的低氧刺激可以增加其对随后的严重低氧刺激的耐受[7]。有研究表明,HPC可以通过减少神经元死亡、激活微胶质细胞并增强神经生成来保护大脑免受低氧/缺血损伤[8]。但由于大部分HPC都是在整体或器官局部进行,很难进行临床转化应用。
RIPC通过对肢体进行短暂的缺血训练,可以对远离缺血部位的中枢神经细胞产生保护作用。2016年,Nature Review Neurology发表综述认为:“RIPC是一种有潜力的改善缺血性脑卒中预后的非药物治疗方法,其主要通过神经、体液和免疫调节等途径调动机体的内源性保护机制,具有良好临床转化前景”[9]。但是RIPC神经保护物质的产生部位和传递方式到目前尚不明确。我们前期研究显示RIPC血清外泌体可以对神经细胞产生保护作用,而内皮细胞来源的外泌体所携带的miR-126是增加低氧耐受的一种可能的分子机制[4]。本研究通过对体外培养的HMEC-1细胞进行HPC并分离其培养基,发现培养基可以增加低氧条件下神经细胞SH-SY5Y的细胞活力并降低细胞凋亡分子caspase-3的水平。结果提示内皮经过HPC可以释放神经保护物质,这可能是RIPC神经保护的一种机制。
血管内皮细胞位于血浆与血管组织之间,可以通过分泌一些生物活性物质以达到对血管张力的调节,保证血管的收缩和舒张,与此同时内皮细胞在维持血管完整性以及血管再生方面也发挥了重要作用[10]。有证据表明,神经元和血管细胞在发育、结构和功能上密切相关[11]。内皮祖细胞培养基通过旁分泌因子促进培养的纹状体细胞的增殖和再生,并增加神经保护作用[12]。1.5 %的低氧处理内皮祖细胞可诱导衍生因子释放到培养基中,该培养基可以提高神经元对糖氧剥夺的耐受[13]。本实验中,HPC条件下血管内皮细胞很可能是通过释放神经保护因子或信号来增加神经细胞对低氧的耐受。
总之,本研究发现HPC血管内皮细胞的培养基可以增加神经细胞SH-SY5Y对低氧的耐受。本研究结果提示血管内皮细胞释放神经保护因子可能是RIPC神经保护的机制之一。
- 包头医学院学报的其它文章
- CT及MR在胃肠道间质瘤患者中诊断价值研究

