基于网络药理学研究苦瓜活性成分治疗肺癌的潜在靶点及作用机制
安欢,钟英英,王蕾,张新羽,叶云
摘 要:肺癌的发病率和死亡率较高,是严重威胁人类生命健康的恶性肿瘤之一.苦瓜作为药食两用的植物,其活性提取物虽已经被用于肺癌的治疗,但是其对于肺癌的作用机制并不明确.通过文献检索和PubChem构建苦瓜活性成分数据库,并预测活性成分可能的作用靶点,同时检索疾病数据库获取肺癌相关靶点,将苦瓜中活性成分的作用靶点与肺癌疾病靶点相映射得到苦瓜治疗肺癌的潜在靶点;通过网络构建和拓扑异构分析,筛选苦瓜中治疗肺癌的关键化合物和核心靶点,并对潜在靶点基因进行GO功能注释和KEGG通路分析.网络药理学分析结果显示:苦瓜可能主要通过Charantoside V、Caffeic acid、Goyaglycoside a等活性成分作用于AKT1、ALB、EGFR、SRC等靶点,这些活性成分参与了信号转导、凋亡过程的负调控、细胞增殖等生物学过程;关键基因主要富集在PI3K-AKT信号通路、HIF-1信号通路、癌症途径等多条信号通路.研究结果表明,苦瓜通过多化合物、多靶点和多通路的共同作用对肺肿瘤细胞增殖进行抑制,为肺癌新药开发提供理论依据.
关键词:苦瓜;肺癌;网络药理学;靶点;信号通路;作用机制
中图分类号:R282.710;R965 DOI:10.16375/j.cnki.cn45-1395/t.2021.04.018
0 引言
由于发病率及死亡率较高,肺癌已严重威胁到人类的生命健康.世界卫生组织国际癌症研究机构(IARC)发布的全球最新癌癥数据显示,2020年全球癌症死亡病例996万例,其中肺癌死亡180万例,位居癌症死亡人数第一.据统计,男性肺癌死亡率远高于女性,其中男性119万例,女性61万例,这主要归因于多数男性吸烟这一行为[1].目前,肺癌的治疗手段主要包括手术切除、化疗和放疗等,但是治疗的预后效果差.由于肺癌的发病机制复杂,涉及多个基因靶点和多种信号通路,因此,寻找肺癌治疗的新靶点、新通路对于肺癌治疗和提高预后具有重要意义.
苦瓜(Momordica charantia)为葫芦科苦瓜属攀援性草本植物,其果实呈椭圆形,类似于黄瓜,因其果实具有特殊苦味,民间称其苦瓜.苦瓜是一种药食两用的天然植物,具有免疫调节活性[2]和抗氧化、抗炎、抗癌、抗糖尿病、抗细菌、抗肥胖的作用.目前已有较多关于苦瓜抗肿瘤作用及其分子机制的研究.苦瓜提取物通过诱导凋亡、细胞周期停滞、自噬和抑制癌症干细胞来抑制癌细胞的生长[3].苦瓜的主要化学成分为葫芦型三萜(包括葫芦型三萜糖苷),苦瓜中三萜糖苷Charantagenins A?E、Charantagenin D和E对肺腺癌A549、Hep3B和U87细胞系的增殖具有抑制作用[4].苦瓜总提物(BME)处理的前列腺癌细胞在细胞周期的S期积累并调节有关细胞周期基因的表达,增强Bax表达并诱导PARP裂解[5].苦瓜甲醇提取物能够通过上调wnt-2基因的表达,抑制MMP-2和MMP9酶活性来影响肺癌CL1细胞的侵袭和转移[6].尽管苦瓜提取物具有诱导人肺癌细胞凋亡的作用,但其具体的作用机制尚不明确.
本文通过网络药理学的方法构建“化合物-靶点”网络,从整体上研究肺癌、苦瓜活性成分与其靶点的关系,筛选苦瓜中治疗肺癌的关键化合物和核心靶点以及作用通路,初步探讨其抗肺癌的多成分、多靶点和多通路作用机制,以期对苦瓜在临床上治疗肺癌提供新的理论依据.
1 材料与方法
1.1 苦瓜活性成分收集
通过文献检索,查找苦瓜中具有药理学功效的活性成分,并从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取相关成分的2D和3D结构,保存为sdf格式.针对PubChem未收载部分采用ChemDraw Ultra 7.0画出结构式,并将所有sdf格式文件通过Open Babel-2.4.1软件转换成Mol2格式,利用Mol2格式对苦瓜有效活性成分进行靶点预测.
1.2 苦瓜有效成分靶点预测
Pharm Mapper服务器是具有统计方法更新功能并集成药效团匹配的平台,可用于潜在目标识别,旨在使用药效团作图方法为给定的探针小分子识别潜在的候选靶标.将Mol2格式的结构式上传至Pharm Mapper服务器(http://www.lilab-ecust.cn/pharmmapper/),对苦瓜有效成分的靶点进行预测和分析.设置参数分别为:Generate Conformers: Yes;Maximum Generated Conformations: 300;Select Targets Set: Human Protein Targets Only (v2010, 2241);Number of Reserved Matched Targets : 300.
1.3 收集肺癌疾病基因
DisGeNET通过整合已有的数据库(如Clinvar)囊括了与人类疾病相关的基因/突变体信息,是目前该方向可以公开获取的最大的数据库之一.以“LUNG CANCER”作为关键词检索肺癌所有相关疾病基因,将收集到的数据进行整合取并集,删除重复基因,从而获得肺癌相关疾病基因.将上述收集到的化合物靶点与疾病基因进行映射,得到苦瓜治疗肺癌的潜在靶点基因.
1.4 网络构建及关键靶点筛选
为了分析苦瓜治疗肺癌潜在靶点基因与蛋白之间相互作用关系,通过STRING数据库构建PPI(protein-protein interaction)网络,生物物种选择“Homo sapiens”,最小要求连接得分设置为高置信度(high confidence:0.7),提交潜在靶点基因得到 PPI 网络图,下载为tsv格式,利用Cytoscape3.6.1软件进行可视化和网络拓扑异构分析并筛选关键靶点.此外,通过该软件对活性成分和潜在靶点进行可视化和网络拓扑异构分析,构建“化合物-靶点”网络,根据节点网络度值筛选苦瓜治疗肺癌的关键化合物.
1.5 潜在靶点功能富集与通路分析
对苦瓜治疗肺癌的潜在靶点进行GO功能富集和Pathway通路分析.利用DAVID(https://david.ncifcrf.gov/)对所有的潜在靶点进行GO功能注释,包括分子学功能(molecular functions,MF)、细胞组分(cellular components,CC)、生物学过程(biological processes,BP),同时进行Pathway通路分析,从中筛选出与苦瓜抗肺癌相关的靶向通路,并对其结果进行可视化分析.以P < 0.05作为筛选标准,绘制GO功能富集柱状图.
2 结果
2.1 苦瓜活性成分的收集
苦瓜中含有多种化学成分,其中具有药理学功效的活性物质主要存在于三萜类化合物中.研究表明苦瓜中含有的三萜类化合物具有抗肿瘤、降血糖和抗病毒的作用[8].通过文献检索,共收集到苦瓜中36个活性成分,其中多酚类4个、葫芦型三萜类(包括葫芦型三萜糖苷)29个和其他化合物3个.
2.2 苦瓜有效成分靶点预测
通过Pharm Mapper服务器对所收集到的苦瓜有效成分进行靶点预测,所有预测结果的靶标以Fit score>3作为备选靶点.考虑到数据处理的方便与标准,使用Uniport数据库将靶点的蛋白名转换为基因名,删除无效重复靶点,共收集到苦瓜活性成分靶点733个.
2.3 肺癌基因收集与共同靶点获取
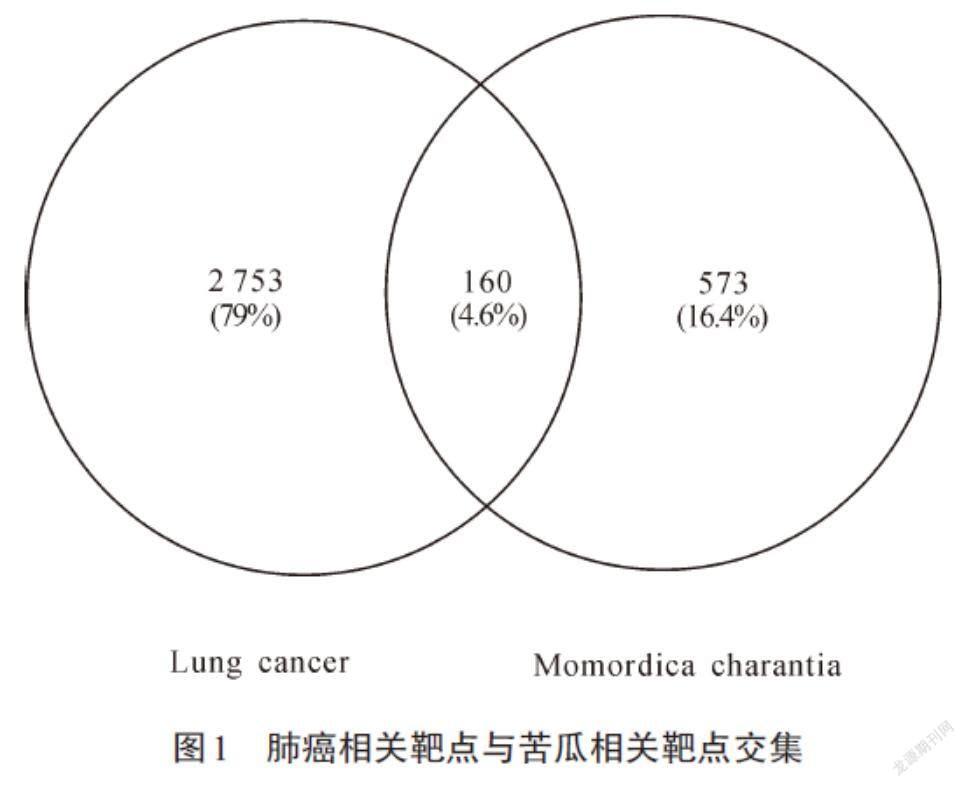
使用DisGeNET数据库检索到2 913个肺癌相关靶点,将收集到的733个苦瓜活性成分有效靶点映射至其中,共得到160个共同靶点,此为苦瓜治疗肺癌的潜在靶点,结果见图1.
2.4 网络构建与靶点筛选
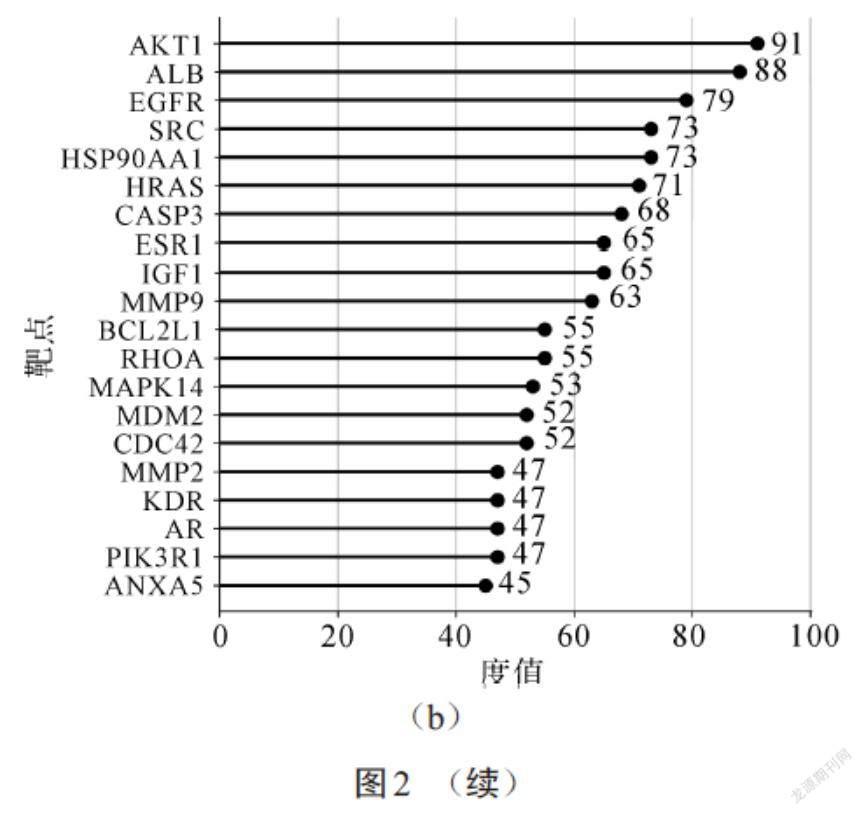
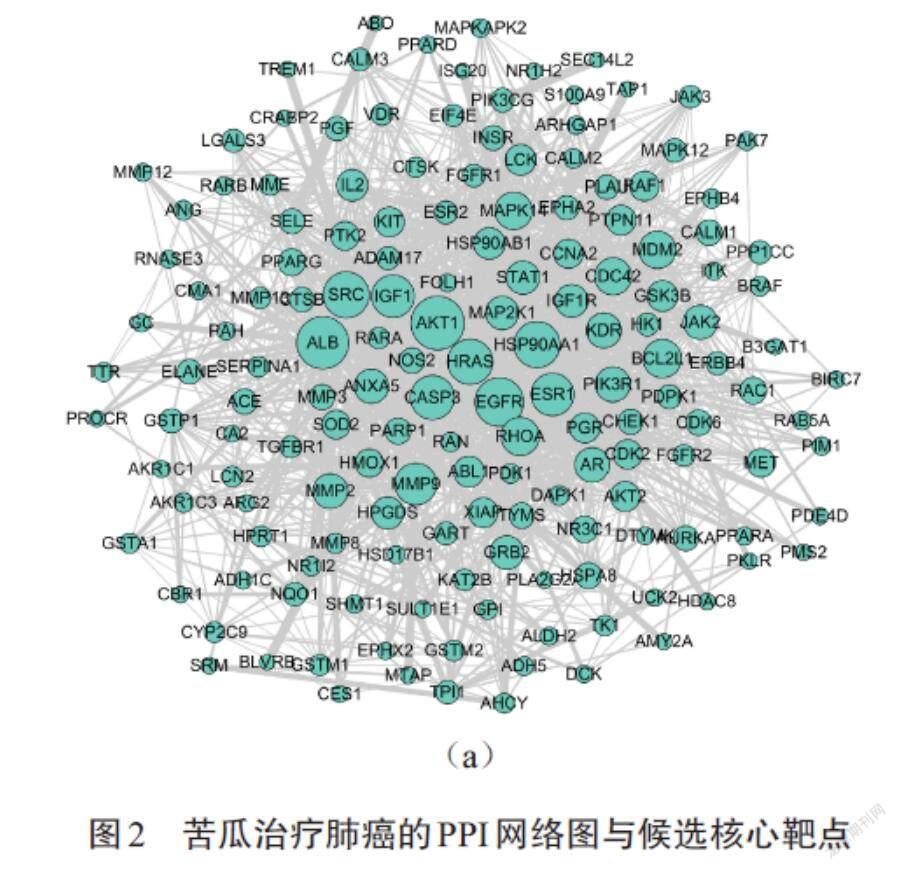
根据设定条件构建苦瓜治疗肺癌潜在靶点的PPI网络图,如图2(a)所示.PPI网络由160个节点(nodes)和1 774条边(edges)组成,节点之间的连接线条越粗表示靶点之间的关联性越高.形状更大的节点具有更高的度值分数,表明与其他节点的相互作用关系更强,在整个网络中处于核心位置.对排名前20位的靶点绘制水平棒棒糖图,结果如图2(b)所示,其中横坐标代表度值,纵坐标代表靶点基因.排名前10的基因为核心基因,分别是AKT1、ALB、EGFR、SRC、HSP90AA1、HRAS、CASP3、ESR1、IGF1、MMP9.
使用Cytoscape3.6.1构建“化合物-靶点”网络,分析苦瓜活性成分与靶点之间的关系,并筛选具有抗肺癌作用的关键化合物,结果如图3所示.该网络由206个节点和2 089条线组成,其中菱形代表苦瓜中的活性成分,矩形代表苦瓜抗肺癌的潜在靶点.在36个活性成分和170个苦瓜治疗肺癌的潜在靶点中,有133个靶点至少与2个化合物相连接,表明至少有83%的蛋白质与其他蛋白质享有共同的配体.观察网络中苦瓜活性成分度值可以发现,在所有的36个活性成分中,每个活性成分至少与2个靶点蛋白相连接,这表明36个活性成分可能贯穿作用于整个网络.“活性成分-靶点”之间关系的复杂性,体现了苦瓜多成分与多靶点治疗肺癌的作用机制.
对“化合物-靶点”网络进行拓扑异构分析表明,化合物在网络中的度值越高表明其在网络中能连接到更多的靶点,在整个网络中处于核心位置.通过网络分析发现,Charantoside V和Caffeic acid均具有最高度值76,其次为Goyaglycoside a和Goyaglycoside b,度值均为72,再次为Charantoside II和Charantagenin E.这6个活性成分为苦瓜治疗肺癌的关键靶点,有可能在整个网络中发挥着重要作用.
2.5 潜在靶点的功能富集与通路分析
将获取的潜在靶点通过DAVID数据库进行GO功能注释和Pathway通路分析,结果如图4所示.生物学过程(BP)显示,潜在靶点与细胞增殖的正调控、信号转导、凋亡过程负调控以及蛋白质磷酸化的负调控等功能相关;细胞组分(CC)主要富集在细胞外区域、细胞外泌体、细胞质、胞质溶胶等;分子学功能(MF)主要参与ATP结合、药物结合、酶结合、蛋白质酪氨酸激酶活性等相关过程.
潜在靶点的KEGG富集分析结果表明(表1),苦瓜治疗肺癌主要涉及到癌症途径、PI3K-Akt、Ras、Rap1、FoxO、HIF-1、VEGF等信号通路,这些通路与肺癌的发生发展密切相关.
3 讨论
本文通过网络药理学方法构建“化合物-靶点”网络,发现Charantoside V、Caffeic acid、Goyaglycoside a、Goyaglycoside b、Charantoside II和Charantagenin E 等6个化合物在网络中处于较为核心的位置,为苦瓜治疗肺癌的关键化合物,这些化合物已有治疗癌症的相关报道.在肿瘤治疗过程中,诱导细胞凋亡是重要的治疗策略[9]. Caffeic acid通过抑制Bcl-2活性诱导HeLa细胞凋亡,导致细胞色素c的释放和随后的caspase-3激活,表明咖啡酸通过线粒体凋亡途径诱导宫颈癌细胞凋亡[10]. Charantagenin E对A549、U87、Hep3B等3种癌细胞系均表现出一定的抗增殖活性,有可能成為潜在的抗癌药物[11-12].另有研究表明,Goyaglycoside b、Goyaglycoside d、Momordicoside F2、Momordicoside I对包括MCF-7、Doya、HEp-2、WiDr在内的4种人类肿瘤细胞系均表现出抗增殖活性[13].Charantoside V、Charantoside II关于肺癌的报道较少.随着研究的不断深入,发现苦瓜治疗肺癌过程中发挥主要作用的化合物为三萜类化合物,因此,苦瓜中的总三萜类化合物值得更深入的研究.
AKT1作为PI3K-Akt信号通路的关键基因在大多数组织中表达,AKT1蛋白可以促进细胞的迁移.研究发现AKT1基因敲低显著增加了肺癌细胞的侵袭和迁移[14],并检测到AKT1不同表达水平对于细胞周期调控、细胞代谢和凋亡等过程表现出相应的调控作用[15].SRC与HSP90AA1基因也与PI3K-Akt信号通路密切相关,SRC基因通过激活PI3K-Akt通路促进肺癌的发生[16],HSP90AA1主要富集在PI3K-Akt通路.苦瓜治疗肺癌可能通过上调AKT1基因并抑制SRC基因表达,刺激PI3K-Akt通路而达到抑制肺癌细胞增殖的作用[17],但是对于这一过程的具体调控机制还缺少明确的实验验证.ALB的表达水平与肺癌的预后有关,研究发现,ALB通过结合和转运各种毒性物质和生理物质来改善微循环,进而调节全身及各组织的炎症反应[18].与正常组织相比,ALB在非小细胞肺癌患者体内表达水平较低,最终导致非小细胞肺癌患者的预后表现不良[19].而经过苦瓜处理的肺腺癌A549细胞,ALB基因的相对表达量显著上升[20],表明苦瓜能够逆转ALB基因的表达,起到治疗肺癌的作用.据报道,EGFR在多种癌症中过度表达,其对非小细胞肺癌的发生和发展起着至关重要的作用,信号转导途径可能影响血管生成,起到激活和调控细胞增殖的作用[21].HRAS属于RAS基因家族中一员,与肿瘤突变密切相关,HRAS突变多发于肝癌、甲状腺癌和膀胱癌[22],目前HRAS基因突变对肺癌调控机制的研究较少,还需更具体的基因表达实验来检测HRAS基因在肺癌中的分子变化.由此可以推断,AKT1、ALB、SRC和EGFR在苦瓜治疗肺癌的过程中起着尤为重要的作用,值得更进一步的研究.
GO功能注释分析发现,苦瓜作用靶点参与了信号转导、积极调控细胞增殖、ATP连接、激酶活性和药物的反应等多方面.无限增殖是癌细胞的基本特征,凋亡是细胞程序性死亡过程,苦瓜中活性成分通过抑制癌细胞异常增殖并诱导细胞的程序性凋亡来抑制肺癌细胞的发生和发展.细胞外泌体具有多种生物活性,与肿瘤的发生和发展密切相关,尤其在肿瘤环境中,可促进细胞癌变、细胞恶性增殖和血管生成等过程[23].表明主要的生物过程和分子功能均与肿瘤细胞的存活和恶性增殖密切相关.
KEGG分析主要涉及到癌症途径、PI3K-Akt、Ras、Rap1、FoxO、HIF-1、VEGF等信号通路.癌细胞经常获得遗传和表观遗传学改变,从而激活致癌信号通路,并促进肿瘤细胞的生长、迁移和侵袭[24].而PI3K-Akt通路已被证明参与了多种癌症通路,包括细胞增殖和凋亡的调控,并且在恶性肿瘤的发生和发展中起着关键作用,也是人类癌症中最常见的突变之一,PI3K-Akt信号通路激活能够刺激细胞增殖和抑制细胞凋亡从而提高细胞存活率[25].丁华杰等[26]发现白藜芦醇通过调控PI3K信号通路相关基因发挥治疗乳腺癌的作用.Rap1作为信号通路的关键因子,影响多种恶性肿瘤的运动、黏附、侵袭等生物学特性[27];Tang等[28]发现,通过抑制Ras信号通路,肿瘤细胞出现增殖抑制、凋亡增加、分化异常等现象.因此可以推测,苦瓜主要通过调控多种信号通路治疗癌症,其中PI3K-Akt为主要通路,通过调节其通路中的多个靶点基因,与其他多种通路共同发挥抗肺癌的作用.
4 结论
通過网络药理学方法,系统地分析了苦瓜治疗肺癌的作用机制,发现苦瓜通过多化合物、多靶点和多通路的相互作用,以复杂的网络调节肺肿瘤的信号转导途径.PI3K-Akt信号转导途径可以调节肿瘤细胞的增殖并抑制细胞凋亡,是研究肿瘤过程中的重要信号转导途径,后续研究将对筛选出的关键靶点和通路进行实验验证,通过分子生物学方法明确苦瓜治疗肺癌的调控机制,为苦瓜治疗肺癌的临床应用提供理论依据.
参考文献
[1] The International Agency for Research on Cancer (IARC). Estimatednumber ofdeaths in 2020,worldwide , bothsexes,all ages[EB/OL].(2020-12-10)[2021-02-01]. http://gco.ianc. fr#cancer-causes.
[2] LU K H,TSENG H C,LIU C T,et al.Wild bitter gourd protects against alcoholic fatty liver in mice by attenuating oxidative stress and inflammatory responses[J].Food & Function,2014,5(5): 1027-1037.
[3] BAO B,CHEN Y G,ZHANG L,et al.Momordica charantia(bitter melon)reduces obesity-associated macrophage and mast cell infiltration as well as inflammatory cytokine expression in adipose tissues[J].Plos One,2013,8(12):e84075.DOI:10.1371/journal.pone.0084075.
[4] ZHU Y,BAI J,ZHOU Y R,et al. Water-soluble and alkali-soluble polysaccharides from bitter melon inhibited lipid accumulation in HepG2 cells and Caenorhabditis elegans[J].International Journal of Biological Macromolecules,2021,166:155-165.
[5] RU P,STEELE R,NERURKAR P V,et al. Bitter melon extract impairs prostate cancer cell-cycle progression and delays prostatic intraepithelial neoplasia in TRAMP model[J].Cancer Prevention Research,2011,4(12):2122-2130.
[6] HSU H Y,LIN J H,LI C J,et al. Antimigratory effects of the methanol extract from momordica charantia on human lung adenocarcinoma CL1 cells[J].Evidence-Based Complementray and Alternative Medicine,2012,2012:1-12.
[7] PI?ERO J,BRAVO ?,QUERALTT-ROSINACH N,et al.DisGeNET:a comprehensive platform integrating information on human disease-associated genes and variants[J].Nucleic Acids Research,2017,45(D1):D833-D839.
[8] YUE J Y,SUN Y Y,XU J,et al. Cucurbitane triterpenoids from the fruit of Momordica charantia L. and their anti-hepatic fibrosis and anti-hepatoma activities[J].Phytochemistry,2019,157:21-27.
[9] 王雪純,曹旭梅,陆莹,等.落地生根冻干粉对人癌细胞增殖和细胞凋亡的影响[J].广西科技大学学报,2021,32(1):12-18.
[10] CHANG W C,HSIEH C H,HSIAO M W,et al. Caffeic acid induces apoptosis in human cervical cancer cells through the mitochondrial pathway[J].Taiwanese Journal of Obstetrics & Gynecology, 2010,49(4):419-424.
[11] KIMURA Y,AKIHISA T,YUASA N,et al. Cucurbitane-type triterpenoids from the fruit of Momordica charantia[J]. Journal of Natural Products,2005,70(8):1233-1239.
[12] WANG X J,SUN W,CAO J Q,et al. Structures of new triterpenoids and cytotoxicity activities of the isolated major compounds from the fruit of Momordica charantia L.[J].Journal of Agricultural and Food Chemistry,2012,60(15):3927-3933.
[13] HSIAO P C,LIAW C C,HWANG S Y,et al. Antiproliferative and hypoglycemic cucurbitane-type glycosides from the fruits of Momordica charantia[J].Journal of Agricultural and Food Chemistry,2013,61(12):2979-2986.
[14] RAO G H,PIEROBON M,KIM I K,et al. Inhibition of AKT1 signaling promotes invasion and metastasis of non-small cell lung cancer cells with K-RAS or EGFR mutations[J].Scientific Reports,2017,7(1):7066.
[15] FABI F,ASSELIN E. Expression,activation,and role of AKT isoforms in the uterus[J]. Reproduction,2014,148(5):85-95.
[16] WU D M,ZHANG T,LIU Y B,et al. The PAX6-ZEB2 axis promotes metastasis and cisplatin resistance in non-small cell lung cancer through PI3K/AKT signaling[J].Cell Death & Disease,2019,10(5):1-15.
[17] HASAN A N,AHMAD M W,MADAR I H,et al. An in silico analytical study of lung cancer and smokers datasets from gene expression omnibus (GEO) for prediction of differentially expressed genes[J].Bioinformation,2015,11(5):229-235.
[18] KOYAMA N,WATANABE Y,IWAI Y,et al. Effectiveness of nanoparticle albumin-bound paclitaxel plus carboplatin in non-small lung cancer patients with malignant pleural effusion[J]. Neoplasma,2018,65(1):132-139.
[19] 孫楠,李源,孙守国,等.血液中炎症和脂质相关检测指标对非小细胞肺癌诊断价值的研究[J].中国肿瘤,2018,27(6):465-469.
[20] OFFOR U,NAIDU E C,OGEDENGBE O O,et al.Nephrotoxicity and highly active antiretroviral therapy:mitigating action of Momordica charantia[J].Toxicology Reports,2018,5:1153-1160.
[21] KUIPER J L,HASHEMI S M S,THUNNISSEN E,et al.Non-classic EGFR mutations in a cohort of dutch EGFR-mutated NSCLC patients and outcomes following EGFR-TKI treatment[J].British Journal of Cancer,2016,115(12):1504-1512.
[22] KRANENBURG O. The KRAS oncogene:past,present,and future[J].Biochimica et Biophysica Acta-Reviews on Cancer,2005,1756(2):81-82.
[23] ISOLA A L,CHEN S.Exosomes:the messengers of health and disease[J].Current Neuropharmacology,2017,15(1):157-165.DOI:10.2174/1570159X14666160825160421.
[24] PAO W,GIRARD N.New driver mutations in non-small-cell lung cancer[J].The Lancet Oncology,2011,12(2):175-180.
[25] JIANG A G,LU H Y,ZHANG D G,et al. Short hairpin RNA targeting AKT1 and PI3K/p85 suppresses the proliferation and self-renewal of lung cancer stem cells[J].Molecular Medicine Reports,2015,12(1):363-370.
[26] 丁华杰,叶云,高强,等.白藜芦醇处理乳腺癌细胞基因表达通路分析[J].广西科技大学学报, 2019,30(2):79-85,92.
[27] KIM W J,GERSEY Z,DAAKA Y. Rap1GAP regulates renal cell carcinoma invasion[J].Cancer Letters,2012,320(1):65-71.
[28] TANG J,LIAO Y,HE S Y,et al. Autocrine parathyroid hormone-like hormone promotes intrahepatic cholangiocarcinoma cell proliferation via increased ERK/JNK-ATF2-cyclinD1 signaling[J].Journal of Translational Medicine,2017,15(1):1-13.
Study on the potential targets and mechanism of the active ingredients of Momordica charantia in the treatment of lung cancer based on network pharmacology
AN Huan, ZHONG Yingying, WANG Lei, ZHANG Xinyu, YE Yun*
(School of Biological and Chemical Engineering, Guangxi University of Science and Technology,
Liuzhou 545006, China)
Abstract: Lung cancer is one of the malignant tumors that seriously threatens the lives and health of human beings due to its high morbidity and mortality. Momordica charantia is a plant used as food and medicine. Although its active extract has been used in the treatment of lung cancer, the mechanism of action is not clear. Via the literature search and PubChem, a database of active ingredients in Momordica charantia was constructed and the possible targets of these active ingredients were predicted. Meanwhile, the related targets in lung cancer were searched via the disease database, which were then mapped with the targets of active ingredients to obtain the possible targets that can treat lung cancer. By constructing relevant networks and performing topoisomeric analysis, the key compounds and core targets were screened, and GO function annotation and KEGG pathway analysis of these potential target genes were performed. The results of network pharmacology analysis showed that Momordica charantia mainly acted on the targets (e.g., AKT1、ALB、EGFR、SRC) via the active ingredients, such as Charantoside V、Caffeic acid、 Goyaglycoside a, and these active ingredients were involved in signal transduction, negative regulation of apoptosis process, cell proliferation and other biological processes. Furthermore, the core genes should be enriched in multiple signaling pathways, such as PI3K-AKT signaling pathway, HIF-1 signaling pathway, and cancer pathway. The results in this study showed that Momordica charantia could inhibit the proliferation of lung tumor cells through the combined actions of multiple compounds, multiple targets and multiple pathways, providing a theoretical basis for the development of new lung cancer drugs.
Key words: Momordica charantia; lung cancer; network pharmacology; target; signaling pathway; mechanism of action
(責任编辑:黎 娅)

