PTBP1在胶质瘤进展中的作用研究
王克朕,兰春根,谷峰,马勇杰
(天津医科大学肿瘤医院1.肿瘤细胞生物学实验室;2.乳腺病理科,国家肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室,天津市恶性肿瘤临床医学研究中心,天津300060)
胶质瘤是成年人中最常见,同时致死率最高的脑部肿瘤[1-2]。尽管现阶段对胶质瘤的认识日渐加深,包括手术切除、放疗和化疗在内的治疗手段已取得长足进步,但由于胶质瘤的高侵袭性,治疗效果仍不令人满意[3-6]。进一步探索胶质瘤恶性进展过程中的关键分子对于实现胶质瘤患者的精准治疗具有重要价值。多聚嘧啶区结合蛋白1(PTBP1)是核不均一性核糖核蛋白(hnRNP)家族的成员,参与调控多种分子的转录后修饰[7-8]。研究表明,PTBP1在正常神经发育过程中表达受到抑制,而在多种脑肿瘤中高表达[9-10],但是其在胶质瘤恶性进展中发挥的功能尚不明确。本研究利用多个数据库分析PTBP1在胶质瘤和癌旁组织中的表达水平及其与胶质瘤的组织学级别和患者预后的关系;并通过慢病毒感染筛选出稳定敲低PTBP1的LN229细胞株,进而探究PTBP1蛋白对胶质瘤细胞增殖、迁移、侵袭能力的影响。
1 材料与方法
1.1 细胞系和主要试剂 人胶质瘤细胞系LN229和人胚胎肾细胞系HEK-293T(American Type Culture Collection),胎牛血清(GIBCO公司),DMEM细胞培养基(GIBCO公司),Transwell小室(Corning公司),Matrigel基质胶(Corning公司),聚凝胺(polybrene,Sigma公司),遗传霉素(G418,Solarbio公司),EdU细胞增殖试剂盒(碧云天生物技术有限公司),PCR引物(生工生物工程股份有限公司),胶回收试剂盒(TaKaRa公司),限制性内切酶BamH1-HF和EcoR1-HF(NEB公司),质粒小提试剂盒(天根生物科技有限公司),Trizol(Invitrogen公司),MMLV逆转录酶和SYBR Green(TaKaRa公司),PTBP1抗体(Santa Cruz公司),β-actin抗体(Santa Cruz公司)。
1.2 研究对象 下载并整理GTEx(Genotype-Tissue Expression)数据库中的正常脑组织样本信息,选取资料完善的1 152例正常脑组织样本的转录组数据和临床信息进行分析。下载并整理TCGA(The Cancer Genome Atlas)数据库中的胶质瘤样本信息,选取资料完善的603例胶质瘤样本(GradeⅡ:n=213,GradeⅢ:n=238,GradeⅣ:n=152)的转录组数据和临床信息进行分析。下载并整理CGGA(Chinese Glioma Genome Atlas)数据库中的胶质瘤样本信息(数据集ID:mRNAseq_325),选取资料完善的309例胶质瘤样本(GradeⅡ:n=98,GradeⅢ:n=74,GradeⅣ:n=137)的转录组数据和临床信息进行分析。
1.3 方法
1.3.1 细胞培养 LN229和HEK-293T细胞系用含10%胎牛血清的DMEM培养,放置在含有5%CO2的37℃恒温培养箱中。
1.3.2 稳定敲低PTBP1重组质粒的构建 将引物(上游引物:5′-GATCCGCGTGAAGATCCTGTTCAATACTCGAGTATTGAACAGGATCTTCACGCTTTTTG-3′;下游引物:5′-AATTCAAAAAGCAAAGTGCAACGTATTGTTACTCGAGTATTGAACAGGATCTTCACGCG-3′)退火,用限制性内切酶BamH1-HF和EcoR1-HF对质粒空载体pLVX-scramble进行双酶切,直接与退火产物连接,转化DH5α感受态宿主细菌,最终提取质粒,然后进行双酶切和测序验证,得到pLVX-shPTBP1重组质粒。
1.3.3 慢病毒载体的包装 在10 cm培养皿中提前铺好HEK-293T细胞,待细胞贴壁并长到80%~90%时,将目的质粒、包装质粒1和包装质粒2共转染进HEK-293T细胞,6~8 h换液,48 h收集上清于离心管中,3 000 r/min离心5 min,取上清在-80℃保存。
1.3.4 细胞的感染 在3.5 cm培养皿中铺入约30%~40%的LN229细胞,次日待细胞贴壁后移除培养液,重新加入1 mL新培养液和1 mL制备好的病毒液,以及2μL polybrene(10 mg/mL),5 h后更换培养液。慢病毒感染48 h后加入G418(2 g/L)进行药筛,药筛1周后即可进行后续验证。
1.3.5 Western印迹检测 移除细胞培养液,加入PBS冲洗3次,将PBS移除干净,加入裂解液于冰上裂解细胞蛋白,测定浓度并定量后进行SDS-PAGE变性电泳(胶浓度:10%),然后转到硝酸纤维素膜上,用5%的脱脂奶粉封闭1 h,加入一抗(β-actin:蛋白上样量:40μg,一抗稀释比例:1∶5 000;PTBP1:蛋白上样量:40μg,一抗稀释比例:1∶1 000)4℃过夜孵育。孵育完成后用TBST洗膜3次,每次10 min,然后避光加入二抗(稀释比例:1∶8 000),室温孵育50 min。孵育完成后用TBST洗膜4次,每次10 min。使用双色红外激光成像系统进行曝光。
1.3.6 RNA提取和RT-qPCR 使用Trizol试剂从LN229细胞中提取总RNA,并通过M-MLV逆转录酶逆转得到cDNA。以cDNA为模板,使用SYBR Green进行RT-qPCR对PTBP1的mRNA表达进行定量。以GAPDH的表达量作为对照。使用△△Ct法计算差异倍数。
1.3.7 EdU实验 将细胞接种于12孔板,使其汇合度小于10%。移除细胞培养液,加入PBS冲洗3次,移除PBS,加入含有10%胎牛血清的新培养液,然后加入10μmol/L EdU,在含有5%CO2的37℃恒温培养箱中孵育2 h。孵育完成后移除培养液并用PBS冲洗3次,将PBS移除干净后加入4%的多聚甲醛(PFA),室温固定30 min。固定完成后移除4%的PFA并用PBS冲洗3次,然后加入DAPI(PBS稀释,稀释比例1:1 500)染色10 min。移除DAPI,用PBS冲洗3次后在倒置显微镜下观察细胞染色情况并拍照计数。
1.3.8 细胞迁移实验 在Transwell小室上室中加入200μL无血清的DMEM培养基重悬的5×104个细胞,下室加入500μL含有2%胎牛血清的DMEM培养基,置于含有5%CO2的37%恒温培养箱中培养12 h后取出,用棉签小心擦拭掉上室细胞,然后将Transwell小室用4%的PFA溶液固定30 min,用吉姆萨染液染色45 min,用DDW清洗3次后封片并在显微镜下拍照计数。
1.3.9 细胞侵袭实验 在Transwell小室上室中铺入用无血清的DMEM培养基7:1稀释的Matrigel基质胶35μL,置于37℃凝胶1 h以上后取出,上室加入200μL无血清的DMEM培养基重悬的1×105个细胞,下室加入500μL含有2%胎牛血清的DMEM培养基,置于含有5%CO2的37%恒温培养箱中培养24 h后取出,用棉签小心擦拭掉上室细胞,然后将Transwell小室用4%的PFA溶液固定30 min,用吉姆萨染液染色45 min,用DDW清洗3次后封片并在显微镜下拍照计数。
1.4 统计学处理 使用SPSS 22.0统计软件进行统计学分析,正态分布的计量数据用±s表示,正态、方差齐资料组间比较采用Wilcoxon符号秩检验和t检验,Kaplan-Meier分析患者的预后情况,P<0.05表示差异具有统计学意义。
2 结果
2.1 PTBP1在胶质瘤中的表达 数据显示,与正常脑组织相比,胶质瘤组织中PTBP1的mRNA水平升高(图1)。PTBP1 mRNA在胶质瘤中的表达随着组织学级别的升高而升高(GradeⅣ>GradeⅢ>GradeⅡ),即与组织学级别呈正相关(图2)。
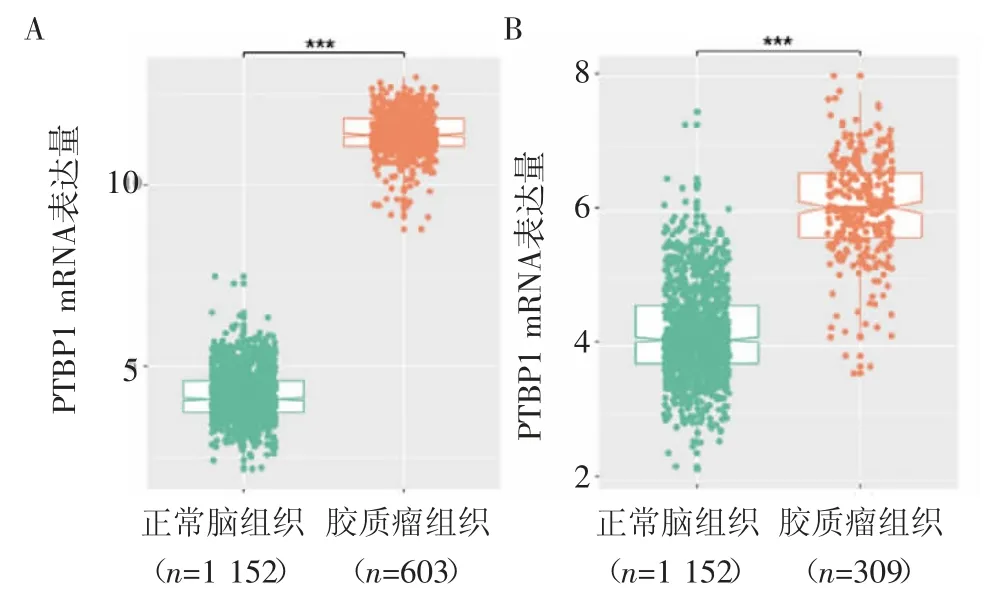
图1 PTBP1在胶质瘤和正常脑组织中的表达Fig 1 Theexpression of PTBP1 in glioma and normal brain tissues

图2 PTBP1在不同WHO分级的胶质瘤中的表达Fig 2 Theexpression of PTBP1 in different WHO gradesof glioma
2.2 PTBP1的表达与胶质瘤患者预后的关系 如图3所示,Kaplan-Meier生存分析结果表明PTBP1高表达患者拥有更短的总生存期(OS),预后更差,即PTBP1的高表达与胶质瘤患者的不良预后呈正相关。
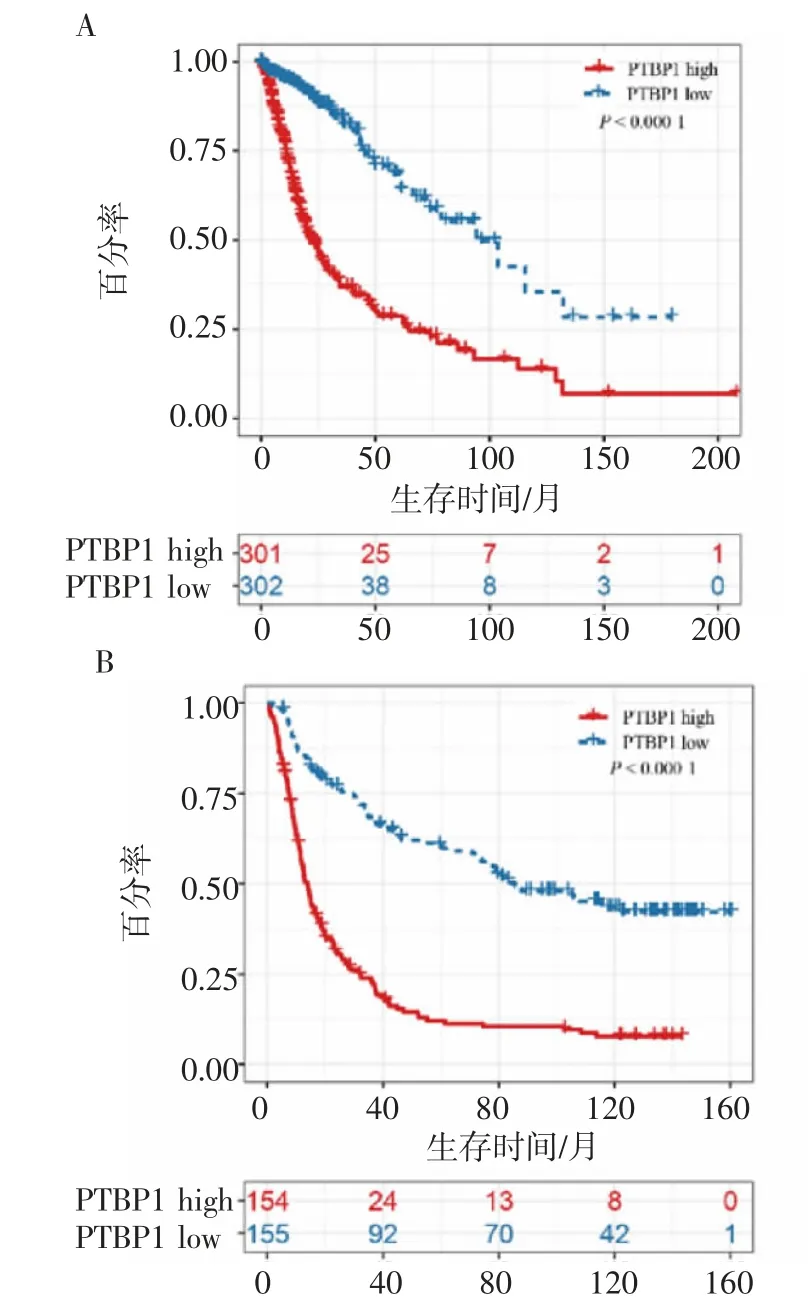
图3 PTBP1的表达与胶质瘤患者预后的关系Fig 3 Relationship between the expression of PTBP1 and the prognosisof glioma patients
2.3 稳定敲低PTBP1的胶质瘤细胞系的构建及验证 人胶质瘤细胞系LN229用慢病毒感染后,获得稳定敲低目的蛋白的细胞株shPTBP1/LN229及对照scr/LN229。Western印迹和RT-qPCR结果显示PTBP1蛋白和mRNA在LN229细胞中稳定敲低(图4),mRNA水平的差异有统计学意义(P<0.001)。

图4 LN229细胞系中PTBP1的表达情况Fig 4 Theexpression of PTBP1 in LN229 cell line
2.4 敲低PTBP1对胶质瘤细胞增殖能力的影响 结果表明,shPTBP1/LN229的增殖能力弱于对照组细胞系(图5),差异有统计学意义(P<0.05)。
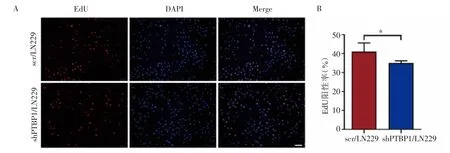
图5 Ed U实验检测敲低PTBP1对LN229细胞增殖能力的影响Fig 5 Effect of PTBP1 knockdown on thecell proliferation ability of LN229 by EdUassay
2.5 敲低PTBP1对胶质瘤细胞迁移、侵袭能力的影响 结果表明,shPTBP1/LN229迁移的细胞数目少于对照组细胞系(图6),差异有统计学意义(P<0.001)。另外,shPTBP1/LN229侵袭的细胞数目也少于对照组细胞系(图7),差异有统计学意义(P<0.05)。
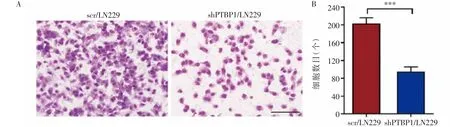
图6 细胞迁移实验检测敲低PTBP1对LN229细胞迁移能力的影响Fig 6 Effect of PTBP1 knockdown on thecell migration ability of LN229 by migration assay
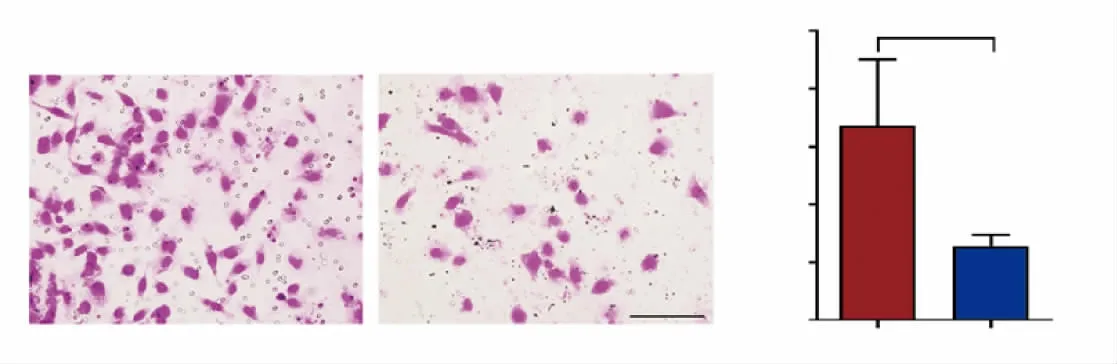
图7 细胞侵袭实验检测敲低PTBP1对LN229细胞侵袭能力的影响Fig 7 Effect of PTBP1 knockdown on thecell invasion ability of LN229 by invasion assay
3 讨论
胶质瘤是源自神经上皮的肿瘤,占颅脑肿瘤的40%~50%,是最常见的原发性颅内肿瘤。年发病率为3人/10万人~8人/10万人。胶质瘤一般呈侵袭性生长,总体疗效不佳,尤其是具有高度间变的生长特性的高分级胶质瘤,术后复发快且预后差,是神经外科治疗中最棘手的难治性肿瘤之一。现阶段,随着分子生物学、免疫学及基因组学的发展,人们对其发病机制有了更深的认识,靶向治疗、免疫治疗等内科综合治疗有望成为胶质瘤极具潜力的治疗方式。所以,深入探索胶质瘤恶性进展过程中的关键分子对于提高胶质瘤治疗效果,实现胶质瘤患者的精准治疗具有重要意义。
hnRNP家族包括一大类RNA结合蛋白,它们在核酸代谢的多个方面发挥作用,包括选择性剪接、维持mRNA稳定性以及转录和翻译调节。尽管在结构域组成和功能上不尽相同,但是多种hnRNP都具有相似的特征[11]。近年来越来越多的研究发现,hnRNP蛋白在许多肿瘤中高表达。已有报道发现,在非小细胞癌中可以监测到hnRNP A2/B1单克隆抗体,大部分肺癌细胞系中高表达hnRNP A2/B1,且在肺癌早期表达高于晚期,因此有学者推测它可以用作监测肺癌早期发生的血清肿瘤标志物[12]。此外,还有报道发现,hnRNP K、E1及E2可以促进原癌基因c-myc mRNA的翻译;hnRNPK也在肿瘤细胞扩散过程中起限速作用[13]。以上研究结果表明,hn-RNP家族作为肿瘤标志物可能拥有良好的前景。
PTBP1作为hnRNP家族的一员,是一种已知的转录后基因表达调节因子,可以调控mRNA的剪接、翻译、稳定性和定位,具有多种与RNA代谢相关的分子功能[14-15]。在肿瘤细胞中,糖酵解是PTBP1参与的重要过程之一[16]。PTBP1促进丙酮酸激酶(PK)M2亚型的表达,同时降低PKM1的表达,导致肿瘤细胞从氧化磷酸化到糖酵解的代谢转变,最终影响肿瘤发生[17-18]。另外,PTBP1通过与自噬相关蛋白10(ATG10)的直接相互作用负反馈调节其表达水平,在结肠癌细胞的迁移和侵袭中发挥关键作用[19]。敲降PTBP1能够促进细胞分化周期蛋白(CDC42)的抑癌亚型CDC42-v2的表达,进而影响卵巢癌的恶性进展[20]。此外,PTBP1通过调控可变剪接以及与多种分子相互作用,在胶质瘤的恶性进展中发挥作用。已有研究证实,PTBP1能够通过其内部核糖体进入位点(IRES)样元件调节RNA特异性腺苷脱氨酶1(ADAR1)p110的翻译模式,进而影响胶质瘤细胞的增殖[21]。胶质瘤组织和细胞中长链非编码RNA(lncRNA)PVT1和PTBP1表达增强,miR-128-1-5p表达降低。PVT1的下调或miR-128-1-5p的上调通过抑制PTBP1的表达,促进胶质瘤细胞的凋亡[22]。PTBP1的升高介导人膜联蛋白A7(ANXA7)外显子的可变剪接,削弱其肿瘤抑制功能并促进胶质瘤的转移[23]。另外,丝氨酸和精氨酸富含剪接因子3(SRSF3)通过与PTBP1及其同源蛋白多聚嘧啶区结合蛋白2(PTBP2)相互作用,促进胶质瘤细胞的迁移、侵袭[24]。
本研究利用多个数据库以及生物信息学分析探究了PTBP1在胶质瘤中的表达情况,发现其在胶质瘤中高表达并与胶质瘤的组织学级别和胶质瘤患者的不良预后呈正相关。此外,本研究通过感染慢病毒的方法在胶质瘤细胞系中敲低PTBP1,利用功能学实验证实了PTBP1蛋白可以促进胶质瘤细胞的增殖、迁移和侵袭能力。
综上所述,PTBP1在胶质瘤中的高表达及其在胶质瘤细胞系中发挥的促癌功能,提示PTBP1具有在胶质瘤中作为生物标志物和重要治疗靶点的潜力,其在胶质瘤中发挥功能的具体分子机制具有重要研究价值。

