PTCD序贯经皮肾镜在介入术后难治性肝脓肿治疗中的应用
段昌虎 刘晓晨 丁建龙 段建峰
肝动脉介入栓塞术在中晚期肝癌、肝癌术后复发、肝转移瘤等恶性肿瘤中有着举足轻重的作用,可抑制肿瘤生长、延长患者生存期[1,2]。此外,在外伤性肝破裂、腹腔出血等良性疾病中也有重要的作用,如外科术后腹腔出血可急诊行腹腔动脉造影及介入栓塞止血,但是肝动脉介入也会出现一些相应的并发症,其中介入术后肝脓肿是比较少见、但极其难治的并发症,病死率为13.3%~50%[3]。本文回顾性分析5例肝动脉介入术后难治性肝脓肿患者的临床表现、治疗、转归等。
资料与方法
一、 一般资料
2018年1月至2021年3月西安交通大学附属三二〇一医院收治的行肝动脉介入栓塞术后发生难治性肝脓肿5例。病例1为胰腺癌胰十二指肠切除术后1年3月余,复查提示肝右叶转移瘤,行肝动脉介入栓塞化疗后出现肝脏巨大脓肿,反复行超声引导下穿刺置管引流及CT下更换引流冲洗,病程持续3月余,引流效果欠佳,患者仍出现间断寒战、高热,后经超声置管处行窦道扩张及经皮肾镜肝脓肿坏死组织清除引流。病例2为原发性巨块型肝癌伴2型糖尿病,行3次肝动脉介入化疗栓塞术后出现肝右叶巨大脓肿,经消炎、反复穿刺引流效果欠佳,入院后行超声置管处窦道扩张及经皮肾镜肝脓肿坏死组织清除引流。病例3、4为闭合性腹部损伤、3级及4级创伤性肝破裂、腹腔大量积血,行肝动脉介入栓塞后出现肝脏巨大脓腔,经消炎、穿刺引流后仍有寒战、高热,行超声置管处窦道扩张及经皮肾镜肝脓肿坏死组织清除引流。病例5为结肠癌术后4年肝右叶转移瘤,行肝动脉介入栓塞术后,肿瘤灭活,但同时出现难治性肝脓肿,穿刺引流效果欠佳,后行经皮肾镜肝脓肿坏死组织清除(见表1)。

表1 5例难治性肝脓肿患者一般资料
二、治疗方法
在治疗3例肝脏肿瘤患者原发病的同时(胰腺癌肝转移瘤行正规白蛋白紫杉醇联合吉西他滨化疗;原发性肝癌患者予以抗病毒、保肝治疗;结肠癌肝转移行全身经脉化疗),针对肝脏肿瘤或肝转移瘤行介入栓塞治疗,术中均将微导管头端超选至肿瘤供血动脉近端,栓塞面积均≥80%,化疗药物为5-氟尿嘧啶、表柔比星,常规碘化油栓塞;栓塞后患者出现寒战、发热不适,体温最高达39.5~40 ℃,伴有乏力、纳差,经验性使用美罗培南抗感染治疗,后根据药物敏感试验调整抗生素;复查腹部超声等提示肝脓肿伴脓腔内气化、坏死,予以介入超声引导下行经皮肝穿刺胆道穿刺置管(PTCD)后冲洗引流疗效欠佳,反复调整、冲洗引流管后患者症状改善不明显,后行经皮肾镜肝脓肿坏死组织清除引流,症状明显改善。
另两例患者系外伤后导致的创伤性肝破裂,病例3为三级肝破裂(血肿占肝脏表面积的50%以上,撕裂深度超过3 cm),病例4为四级肝破裂(肝实质破裂,累及30%的肝脏),入院后生命体征尚平稳,血压偏低,考虑腹腔大量出血,急诊行腹腔动脉造影及肝动脉介入栓塞术,术后介入超声留置腹腔穿刺引流管,引出腹腔积血及胆汁后,患者出现寒战、高热,行超声复查提示肝右叶脓肿,行PTCD穿刺置管冲洗引流联合抗生素抗感染治疗效果欠佳,后续反复调整、冲洗引流管后患者症状改善不明显,行经皮肾镜肝脓肿坏死组织清除引流,症状明显改善。
结 果
5例患者介入术后1~6 d出现寒战、高热不适,体温最高达39.5~40 ℃,伴有乏力、纳差等全身症状,血常规提示白细胞和(或)中性粒细胞比值明显升高,根据经验用药给予广谱抗感染药物,并进行保肝及营养支持治疗,得到药物敏感试验结果后,及时更换敏感的抗生素。在影像检查确定脓肿形成并有脓腔液化后,及时行PTCD,经引流管冲洗引流,疗效欠佳,反复调整、冲洗引流管后患者症状改善不明显,后行经皮肾镜肝脓肿坏死组织清除引流,症状明显改善。
5例患者均为先行肝脓肿经皮穿刺置管引流,引流不畅或脓腔进行性增大、患者症状改善不明显后,病例1经2次经皮肾镜肝脓肿坏死组织清除引流;病例3、4经过1次肾镜清理;病例2、5行3次经皮肾镜肝脓肿坏死组织清除引流,患者术中无明显出血,病例1术后出现胆瘘,经通畅引流1周后,均达到治愈的效果。
病例1行静脉化疗的同时,针对肝转移瘤行TACE,术后第4天开始出现寒战、高热,复查腹部CT提示肝脓肿,大小为7 cm×4 cm(图1),行超声引导下肝脓肿穿置管引流,抽出咖啡色浑浊液体约50 mL后症状稍改善,予以抗感染、冲洗引流管,带引流管好转出院。出院后患者间断寒战、发热,引流管未见液体引出,复查腹部CT提示脓腔进行性增大,脓腔为10 cm×10 cm(图2),遂行CT引导下留置冲洗管及引流管,引流3 d后未见脓液引出,反复行脓腔超声引导下更换引流管冲洗引流,患者仍有寒战、高热,复查腹部CT提示脓腔14 cm×8.7 cm(图3),但引流管位置良好,考虑脓腔内大量坏死粘稠物质堵塞引流管,遂行全麻下经皮肾镜肝脓肿坏死组织清除引流术,术中经原肝脓肿穿刺引流管窦道处依次置入16#、18#及20#剥皮鞘扩张窦道,至肝脓肿腔,经肾镜直视下冲洗脓腔,见大量带有恶臭的灰黄色浑浊脓液流出,脓腔盐水冲洗干净后用肾镜下活检钳直视下夹出大量坏死组织及黄色脓性絮状物(图4),边夹除边冲洗直至坏死物及脓腔清理干净,于脓腔内留置18#引流管一根,术后引流通畅,患者未再出现寒战、发热,1周后复查脓腔明显缩小为8.8 cm×5.8 cm,再次同法清理脓腔,1周后复查提示脓腔基本消失(图5),治愈出院,复查CA199降至正常水平。
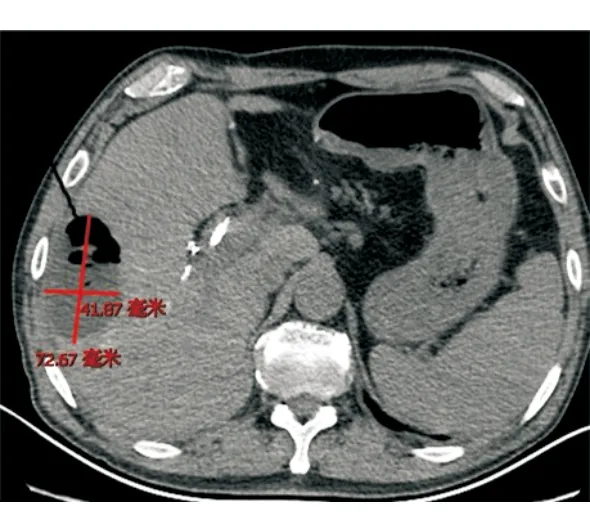
图1 胰腺癌肝转移瘤患者介入术后肝脓肿

图2 超声引导置管引流术后脓腔增大

图3 更换CT置管引流脓腔进行性增大

图4 经皮肾镜清理脓腔内脓性絮状物

图5 肾镜清理2次后脓腔基本消失
讨 论
文献报道,在原发性肝癌中,TACE/TAE后肝脓肿的发生率为0.2%~4.5%[4-6]。介入术后形成肝脓肿的原因:与接受双重血液供应的肝实质相反,胆管系统和胆管周围毛细血管丛的主要供血来源于肝动脉的伴随分支,因此,与肝细胞相比,胆道系统更容易发生缺血性损伤,TACE不仅可以阻断肿瘤供血动脉,还可以减少胆管周围毛细血管丛内皮细胞的数量,对胆道系统造成继发性化学性和缺氧缺血性损伤,并最终形成局部脓肿[7]。文献报道,女性患者介入治疗后发生肝脓肿的可能性更大[6]。通过改善患者贫血和低蛋白血症、控制血糖、增加抵抗力与免疫力、降低胆道受损、改善肝功能、保证介入治疗中肿瘤充足供血有利于避免介入治疗后肝脓肿.
超声或CT穿刺置管引流联合抗生素的使用对大部分肝脓肿治疗是有效的,但是针对穿刺置管引流联合抗生素治疗效果欠佳,需要外科手术进一步干预治疗的肝脓肿称为难治性肝脓肿[8,9]。难治性肝脓肿有以下特点:①应用抗生素及穿刺引流后仍存在反复寒战、高热;②影像资料提示肝脓肿壁厚、脓腔内呈蜂窝状、多发间隔;③脓腔内坏死组织粘稠、引流不通畅;④反复调整引流管后仍难以达到通畅引流的目的。
本研究通过PTCD序贯经皮肾镜肝脓肿坏死组织清除引流治疗难治性肝脓肿,取得了满意的效果。有如下经验供大家分享:1.常规的肝脓肿首选介入超声引导下穿刺冲洗置管引流联合抗感染可达到满意效果,但是因为介入术后形成的难治性肝脓肿腔内大量坏死粘稠组织引流不畅、穿刺引流效果差、既往有腹部手术史无法行腹腔镜手术治疗、预计需要多次清理的患者,PTCD序贯经皮肾镜肝脓肿坏死组织清除引流为一种可供选择的方法;2.选择经皮肾镜的优点有以下5点,①直观:在肾镜下操作,用活检钳彻底清除脓腔内的脓絮状坏死组织,联合冲洗泵可边冲洗脓腔、边清理脓腔内的坏死组织,正是这些坏死的脓絮状组织堵塞引流管导致引流不畅,但是需要注意的是冲洗泵的压力不可过高,避免压力过高导致脓腔完整性破坏,脓液播散入腹腔,引起感染性休克;②避免了盲目操作引起的出血风险;③视野更加开阔:可以通过转动肾镜的角度,对分隔的病灶进行打通,彻底通畅引流;④微创:传统开腹手术的创伤大、花费高、恢复时间长、风险高,本方法微创、痛苦小、花费少;⑤可重复性强:本文报道的5例患者,2例行1次清理,1例患者行2次清理,2例行3次清理,简单易行。3.术中需要注意保护肝脓肿脓腔壁的完整性,以避免胆瘘、出血及感染播散的发生;5例患者中,1例术后出现了胆瘘,考虑系脓腔壁与胆管相通,因既往胰十二指肠手术史,无法再行ERCP胆道支架等减压操作,后续经通畅引流后,胆瘘自行愈合;1例有少量出血,通过留置的引流管压迫即可自行止血。
综上所述,PTCD序贯经皮肾镜在介入术后难治性肝脓肿治疗中具有微创、直观、可重复性强等优点,值得推广。

