固体氧化物电池Sr2-xFe1.5Mo0.5O6-δ氧电极材料的电化学性能
于 旺,孙 超,齐 冀,卞刘振,彭继华,彭 军,安胜利
(内蒙古科技大学材料与冶金学院,内蒙古先进陶瓷材料与器件重点实验室,内蒙古包头 014010)
化石燃料的燃烧对环境造成严重的污染,因此开发具有高转化效率的新能源体系受到越来越多的关注。固体氧化物电池(solid oxide cells,SOCs)以其效率高、燃料灵活、全固态结构等优点成为备受关注的能源转化技术[1-2]。SOCs不仅可以在燃料电池模式下工作将燃料的化学能转化成电能,还可以在电解池模式下工作,将可再生能源产生的电能转变为氢能等清洁能源,具有广泛的应用前景[3]。随着SOCs 制备技术发展,SOCs 电解质的厚度可以降低到10 μm 以下[4],电池的工作温度可以从高温(>850 ℃)降低到700~850 ℃,极大地降低了电池的制造成本,改善了电池的长期运行稳定性[5-6]。但是随着工作温度的降低,氧电极缓慢的氧还原反应/析氧反应限制了SOCs的高性能输出。因此需要开发具有高催化活性的氧电极材料[7-8]。
Co 基钙钛矿材料具有良好的氧还原反应活性而受到广泛的关注,如La0.6Sr0.4Co0.2Fe0.8O3(LSCF)、Ba0.5Sr0.5Co0.8Fe0.2O3(BSCF)、PrBaCo2O5等[9-11]。然而Co 基钙钛矿材料的热膨胀系数比常用电解质的热膨胀系数要高2倍左右,电池在工作过程中的热应力会严重损害电池的性能输出[7]。无Co 的Fe 基钙钛矿具有一定的催化活性同时与常用电解质的热膨胀系数更为接近,因此受到更多的关注。其中Sr2Fe1.5Mo0.5O6双钙钛矿材料由于具有出色的氧还原反应活性而得到广泛的研究[12]。在钙钛矿材料中,A 位、B 位和O 位的掺杂可以进一步提高材料的氧还原反应活性[13]。Sun课题组研究了Ni掺杂对Sr2Fe1.5Mo0.5O6电极的氧还原反应的影响,结果表明Ni的引入改善了材料的电导率和氧还原反应活性。当Ni的掺杂量为0.1时材料的极化电阻降低了50%[14]。同样B位Co的掺杂也提高了材料的氧还原反应活性,800 ℃时材料的极化电阻只有0.093 Ω·cm2。以Sr2Fe1.4Co0.1Mo0.5O6为氧电极,阳极支撑的单电池的峰值功率密度高达1.16 W/cm2[15]。同时A位的缺位可以调控ABO3钙钛矿材料的晶体结构和电导率,进而改善材料的氧还原反应活性[16]。尽管Sun课题组研究了Sr缺位对Sr2Fel.5Mo0.5O6-δ氧电极材料电导率和电化学性能的影响[17],但是没有研究Sr缺位的Sr2-xFel.5Mo0.5O6-δ氧电极材料的氧还原反应机理及其对电解池水电解性能的影响。
本文采用液相法合成了不同Sr 缺位的Sr2-xFe1.5Mo0.5O6-δ氧电极材料,详细研究了Sr 缺位对材料晶体结构、电导率和氧还原反应机理的影响规律。Sr 缺位的引入促进了材料中晶格氧的活化,提高了材料的电导率和氧还原反应。借助电化学交流阻抗谱研究了Sr1.95Fe1.5Mo0.5O6-δ材料的氧还原反应机理,并研究了其水电解制氢的电化学性能和稳定性的影响,为该类材料的设计奠定了实验和理论基础。
1 实验方法
1.1 粉体合成
采用柠檬酸-甘氨酸燃烧法合成不同Sr缺位的Sr2-xFe1.5Mo0.5O6-δ(x=0、0.05、0.1、0.15)钙钛矿粉体,合成原料为硝酸锶[Sr(NO3)2,纯度≥99.5%]、硝酸铁[Fe(NO3)3·9H2O,≥99.9%]、钼酸铵[(NH4)6Mo7O24·4H2O, ≥99.9%]、 柠檬酸(C6H8O7·H2O, ≥99.5%)和甘氨酸(C2H5NO2,≥99.9%),所有的原料均购买于阿拉丁生化科技股份有限公司。首先称取适量的柠檬酸和甘氨酸溶解到200 mL 的去离子水中,待溶解后依次加入化学计量比的钼酸铵、硝酸锶和硝酸铁。将上述溶液采用磁力搅拌器搅拌1 h,保证金属阳离子与柠檬酸和甘氨酸充分络合。随后将溶液在搅拌的条件下加热蒸发,直到溶液变得黏稠、鼓泡燃烧。最后将燃烧后的粉体在1100 ℃下焙烧5 h,得到不同Sr 空位的Sr2-xFe1.5Mo0.5O6-δ钙钛矿粉体。
1.2 样品制备
称取一定量的Sr2-xFe1.5Mo0.5O6-δ粉体与适量5%(质量分数,下同)的PVA黏结剂混磨均匀,将其在300 MPa 下压制成直径25 mm 的圆片,随后将其在1400 ℃下烧结5 h 获得致密的Sr2-xFe1.5Mo0.5O6-δ样品。采用金刚线切割机将圆片切成1 mm×1 mm×16 mm 的矩形条。通过电化学交流阻抗谱测试对称电池的极化电阻,研究材料的氧还原反应。首先称取0.5 g的Sm0.2Ce0.8O2-δ(SDC)粉体与适量5%的PVA 黏结剂磨匀,使用不锈钢模具在300 MPa下其将压制成直径15 mm 的圆片。随后将其在1400 ℃的下烧结5 h 获得致密的SDC 电解质片。称取适量的Sr2-xFe1.5Mo0.5O6-δ粉体和松油醇黏结剂(含6%乙基纤维素),将其在玛瑙研钵中研磨2 h后获得均匀的电极浆料。采用刷涂法将电极浆料刷涂到SDC电解质两侧,将对称电池在1050 ℃空气下烧结2 h。采用流延喷涂法制备燃料电极支撑的NiO-YSZ(SL)/NiO-YSZ(FL)/YSZ/SDC 半电池,将氧电极浆料刷涂到SDC 表面并在1050 ℃下烧结2 h得到全电池,电极的活性面积为0.5 cm2。
1.3 表征和测试方法
通过XRD 衍射仪(Rigaku SmartLab)分析Sr2-xFe1.5Mo0.5O6-δ粉体的相结构变化,辐射源为Cu-Kα,测试角度为20~80°,步长为0.02°/s,扫描速度为4°/min。通过O2-TPD 测试材料中晶格氧的活性。将Sr2-xFe1.5Mo0.5O6-δ粉体在He 气氛下加热到300 ℃并保温1 h 去除材料表面的吸附杂质。随后将粉体在10%O2-He 气氛下处理1 h 后降至室温并在He 气氛下吹扫1 h。将材料以10 ℃/min 的升温速率升温到800 ℃,采用TCD 检测器检测氧气的信号。采用直流四端子方法测试Sr2-xFe1.5Mo0.5O6-δ样品的电导率。在电极条的两侧用DAD-87导电银浆引出四根引线,将Sr2-xFe1.5Mo0.5O6-δ电极条置于竖式炉中加热到850 ℃,使用Keithley DMM6500数字万用表记录样品在850~400 ℃下的电阻值,每个温度下保温2 h。根据电阻和样品的尺寸获得材料在不同温度下的电导率。为研究Sr2-xFe1.5Mo0.5O6-δ电极的氧还原反应活性和机理,采用输力强1287+1260 电化学工作站测试对称电池在不同温度和氧分压下的电化学交流阻抗谱,阻抗谱的频率范围为106~0.1 Hz,借助Zview 软件对阻抗谱数据拟合。燃料电池模式下的电化学性能以加湿的H2为燃料,电解池模式下的电化学性能以20%H2O-H2为燃料。
2 结果与讨论
2.1 Sr2-xFe1.5Mo0.5O6-δ的相结构
图1 是Sr2-xFe1.5Mo0.5O6-δ粉体在室温下的X 射线衍射图谱。XRD 衍射线的主峰与PDF#34-0641卡片基本吻合,说明1100 ℃烧结后得到纯相Sr2-xFe1.5Mo0.5O6-δ钙钛矿材料,Sr2-xFe1.5Mo0.5O6-δ为立方钙钛矿结构[7],空间群为Fm-3m。与其他几个组分对比发现Sr1.85Fe1.5Mo0.5O6-δ钙钛矿材料在29.64°、45.1°和55.98°出现杂峰(图中星号所示),与PDF#81-0640卡片对比发现是SrMoO4,说明过量的Sr 缺位会导致Sr2-xFe1.5Mo0.5O6-δ中出现杂相。为了进一步研究Sr 缺位对材料晶体结构的影响,将XRD 中31°~34°区域的衍射峰放大如图1(b)所示。随着Sr 缺位的增加,可以看到峰位逐步向低衍射角度偏移,根据布拉格方程说明材料的晶胞发生膨胀。这可能是由于Sr 缺位的增加,形成过多的氧空位[18]。氧空位的形成会增加材料氧离子的电导率,有助于改善材料氧还原反应活性[19]。

图1 不同Sr缺位的Sr2-xFe1.5Mo0.5O6-δ粉体在室温下的XRD图谱Fig.1 XRD patterns of Sr2-xFe1.5Mo0.5O6-δ powders with different Sr deficiency
2.2 Sr2-xFe1.5Mo0.5O6-δ材料的O2-TPD曲线
材料中的晶格氧会随着温度的升高而溢出,较低的溢出温度说明晶格氧具有较高的活性[20]。图2 是Sr2-xFe1.5Mo0.5O6-δ粉体在He 气氛下的O2-TPD曲线。低于300 ℃的氧信号是吸附在材料表面的氧物质,而高温区域内的氧信号主要来源于材料体相中晶格氧的溢出[21]。随着温度的升高氧信号逐渐增强,说明高温促进了晶格氧的活化,导致更多的晶格氧溢出。随着Sr 缺位量的增加,氧脱附的初始温度逐渐降低,说明Sr 缺位增强了Sr2-xFe1.5Mo0.5O6-δ材料中晶格氧的活性。结合XRD结果可知Sr 缺位的增加导致了材料晶胞膨胀,削弱了Fe-O 的强度,导致材料中的晶格氧更容易迁移和溢出[20]。

图2 不同Sr缺位的Sr2-xFe1.5Mo0.5O6-δ粉体的O2-TPD曲线Fig.2 O2-TPD curves of Sr2-xFe1.5Mo0.5O6-δ powders
2.3 Sr2-xFe1.5Mo0.5O6-δ材料的电导率
氧电极材料主要催化氧气与电子结合生成氧离子或者将氧离子变成O2,也即是氧电极材料表面的氧还原和氧析出反应是一个涉及电子、离子的电化学反应,因此氧电极要具有一定的电导率。图3是空气下不同Sr 缺位的电极条在400~850 ℃下的电导率。Sr2-xFe1.5Mo0.5O6-δ材料的电导率随着温度的升高而增加,当达到最大值时电导率又随着温度的增加而降低。在低温区电导率的增加符合小极化子到导电机理,说明材料为P 型半导体[14]。高温段电导率随温度的增加而降低,主要是由于高温下晶格氧溢出,导致B 位离子价态降低,降低了材料载流子浓度。此外由于氧空位的形成,阻碍了载流子的迁移路径,也会导致电导率的降低[22]。当Sr 含量为1.95 时,材料具有最大的电导率为38.4 S/cm。根据电中性原理,Sr 缺位的增加可能会通过B 位Fe 的价态增加来实现电荷补偿,提高材料导电的电子空穴浓度,从而提高材料的电导率。过量的Sr 缺位可能会产生更多的氧空位,氧空位的生成会消耗电子空穴[式(1)],同时阻碍载流子的迁移路径,因而降低材料的电导率[23]。因此当Sr 含量为1.95 时材料具有最大的电导率。

图3 不同Sr缺位的Sr2-xFe1.5Mo0.5O6-δ在空气下电导率Fig.3 Conductivity of Sr2-xFe1.5Mo0.5O6-δ electrode bar in air

2.4 对称电池空气下阻抗测试
氧电极是氧还原或者氧析出发生的场所,因此氧电极材料应该具有良好的反应活性。对称电池的极化电阻是表征材料氧还原反应活性的重要指标[24]。图4 是不同Sr2-xFe1.5Mo0.5O6-δ材料的对称电池在空气下的电化学交流阻抗谱。为了便于比较,将阻抗谱的高频截距做了归零处理。阻抗谱中圆弧的截距代表材料氧还原反应的极化电阻(Rp)。从图中可以看出所有对称电池的极化电阻随着温度的升高而降低,说明高温促进了电极表面的氧还原反应。此外随着Sr 缺位的增加,材料的极化电阻先降低后增加。比如在800 ℃时,Sr2Fe1.5Mo0.5O6-δ、 Sr1.95Fe1.5Mo0.5O6-δ、 Sr1.9Fe1.5Mo0.5O6-δ对称电池在0.21 atm (1 atm=105Pa)下的极化电阻分别为0.102、0.070 和0.096 Ω·cm2。因此当Sr缺位为1.95 时,电极材料对氧还原反应具有最好的催化活性。这可能与Sr1.95Fe1.5Mo0.5O6-δ具有最高的电导率有关。电导率的增加会改善氧还原反应的电荷转移过程,进而导致材料的极化电阻降低[15]。Sr1.95Fe1.5Mo0.5O6-δ的极化电阻与典型的La0.6Sr0.4Co0.2Fe0.8O3-δ阴极相当(约0.1 Ω·cm2@750 ℃)[25]。此外Sr1.95Fe1.5Mo0.5O6-δ材料的极化电阻仅仅是R-P 型的La1.5Sr0.5Ni0.5Fe1.5O4+δ材料的1/5,如800 ℃时La1.5Sr0.5Ni0.5Fe1.5O4+δ材料的极化电阻为0.373 Ω·cm2[26]。对称电池结果说明Sr1.95Fe1.5Mo0.5O6-δ材料具有优异的氧还原反应活性。

图4 空气下对称电池在不同温度下的阻抗谱。(a)Sr2Fe1.5Mo0.5O6-δ;(b)Sr1.95Fe1.5Mo0.5O6-δ;(c)Sr1.9Fe1.5Mo0.5O6-δ;(d)不同温度下的极化电阻Fig.4 Impedance spectra of symmetrical cells at different temperatures in air.(a)Sr2Fe1.5Mo0.5O6-δ;(b)Sr1.95Fe1.5Mo0.5O6-δ;(c)Sr1.9Fe1.5Mo0.5O6-δ;(d)Polarization resistance at different temperatures
2.5 对称电池在不同氧分压下阻抗测试
氧还原反应的解析可以找出反应的限制步骤,进而为新材料的设计提供调控方向。由于Sr1.95Fe1.5Mo0.5O6-δ具有最好氧还原反应活性,因此进一步研究Sr1.95Fe1.5Mo0.5O6-δ材料的氧还原反应机理。图5 是Sr1.95Fe1.5Mo0.5O6-δ对称电池在不同氧分压和温度下的电化学阻抗谱。为了获得不同反应过程的贡献,采用Zview 软件对阻抗拟合。采用的等效电路为Rs(R1-CPE1)(R2-CPE2),其中Rs为对称电池的欧姆电阻,主要是由电解质的欧姆电阻组成。R1和R2分别代表高频和低频部分的电阻,CPE1和CPE2分别为对应的常相位元件,实线为对应的拟合曲线。为了方便比较同样将电解质的欧姆电阻Rs作了归零处理。从图中可以看出电池的极化电阻随着分压的降低而逐渐增加,其中低频部分受氧分压变化更加明显,而与温度的变化关系不大[图4(e)、(f)],因此低频部分主要是氧还原反应的化学吸脱附过程[27]。高频部分的极化电阻受温度的影响更加明显,同时也受到氧分压的影响,因此该部分主要对应氧还原反应的电荷转移过程[28]。
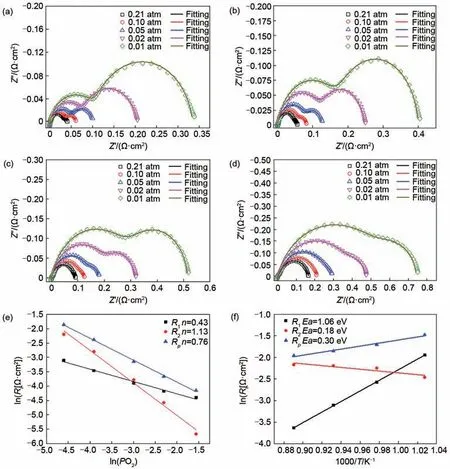
图5 对称电池在不同氧分压下阻抗。(a)850 ℃;(b)800 ℃;(c)750 ℃;(d)700 ℃;(e)800 ℃时R1和R2与氧分压的关系;(f)0.01 atm条件下R1和R2与温度的关系Fig.5 Impedance of symmetric cell at different oxygen partial pressures(a)850 ℃;(b)800 ℃;(c)750 ℃;(d)700 ℃;(e)The relationship between R1/R2and the partial pressure of oxygen at 800 ℃;(f)The relationship between R1/R2and temperature at 0.01 atm
为了进一步明确高频和低频过程对应的具体的氧还原反应过程,研究各部分电阻值随氧分压的变化关系。一般来说氧气在阴极材料表面的氧还原反应由各个子反应组成,各子反应对应的极化电阻(Rp)与氧分压之间存在如式(2)关系

K为比例常数,不同的n值对应不同的氧还原反应过程,如表1所示。图5(e)是800 ℃下R1和R2与氧分压之间的关系。根据表1可知R1对应的n值在0.375~0.5之间,说明高频过程受第一个电荷转移过程和表面吸附氧的解离过程共同控制。而R2对应的n值约为1,说明低频过程对应氧分子在电极表面的扩散和吸附过程。

表1 n值对应的基元反应和氧还原反应过程[28-33]Table 1 n values of various elementary reaction for ORR[28-33]
2.6 单电池的电化学性能
为进一步研究Sr 缺位对单电池性能的影响,制备了燃料极支撑的NiO-YSZ(SL)/NiO-YSZ(FL)/YSZ/SDC/Sr2-xFe1.5Mo0.5O6-δ单电池,测试单电池以H2为燃料时的功率输出和电化学交流阻抗谱,同时研究了单电池在电解池模式下的I-V和EIS 曲线。图6(a)是不同Sr 缺位的Sr2-xFe1.5Mo0.5O6-δ氧电极的单电池在850 ℃下的I-V-P曲线。单电池的开路电压在1.01 V 以上,说明单电池的密封完好。850 ℃时单电池峰值功率密度分别为1340、1459、1090 mW/cm2,同时单电池的极化电阻分别为 0.286、 0.273 和 0.331 Ω ·cm2, 说明Sr1.95Fe1.5Mo0.5O6-δ具有最好的电化学性能,这与对称电池的结果一致。图6(b)和(d)分别是以Sr1.95Fe1.5Mo0.5O6-δ为氧电极的单电池在不同温度下的功率密度和开路电压下的交流阻抗谱。850、800、750 和700 ℃下的峰值功率密度分别为1459、953、682 和420 mW/cm2。而单电池的极化电阻分别为0.273、0.454、0.682 和1.174 Ω·cm2。图6(e)和(f)是燃料气氛为20% H2O-H2时单电池的电化学性能,800 ℃下单电池在燃料电池模式下的峰值功率密度为741 mW/cm2。在燃料电池模式下,800 ℃和1.5 V 的外加电压下单电池的电流密度达到-1300 mA/cm2,对应的理论产氢速率为543.24 mL/(cm2·h)。同时单电池在-500 mA/cm2运行条件下的衰减速率约为0.001 V/h[图6(f)],表现出一定的运行稳定性。单电池在电解模式下衰减的原因可能是由于高温下Sr1.95Fe1.5Mo0.5O6-δ纳米颗粒的团聚和长大引起的。

图6 不同Sr缺位的Sr2-xFe1.5Mo0.5O6-δ氧电极的单电池电化学性能Fig.6 Electrochemical performance of Sr2-xFe1.5Mo0.5O6-δ electrode with different Sr deficiency
3 结论
用甘氨酸-柠檬酸络合法合成了不同Sr 缺位的Sr2-xFe1.5Mo0.5O6-δ钙钛矿电极粉体,研究了Sr缺位对材料晶体结构、电导率以及氧还原反应活性的影响规律。Sr 缺位导致材料的晶体结构发生膨胀,当Sr 含量为1.95 时材料具有最大的电导率和最低的界面极化电阻。在850、800、750、700 和650 ℃下以Sr1.95Fe1.5Mo0.5O6-δ为电极的对称电池的极化电阻分别为0.051、0.070、0.112、0.203 和0.397 Ω·cm2。氧还原反应机理表明高频过程受第一个电荷转移过程和表面吸附氧的解离过程共同控制。而低频过程对应氧分子在电极表面的扩散和吸附过程。当采用Sr1.95Fe1.5Mo0.5O6-δ为氧电极时,燃料极支撑的单电池在850、800、750 和700 ℃下的峰值功率密度分别为1459、953、 682 和420 mW/cm2。 当燃料气氛为20%H2O-H2时,在800 ℃和1.5 V 的外加电压下电池的电流密度达到-1300 mA/cm2,产氢速率达到543.24 mL/(cm2·h)并表现出一定的运行稳定性。说明Sr1.95Fe1.5Mo0.5O6-δ电极是一种很有潜力的中温SOCs 氧电极材料。

