急性与慢性炎性脱髓鞘性多发性神经根神经病临床与神经电生理特征分析
张鸿雁 张海峰 王严方 张 坤
1)驻马店市第一人民医院,河南 驻马店 463000 2)郑州大学第一附属医院,河南 郑州 450052
急性炎性脱髓鞘性多发性神经根神经病(acuteinflammatorydemyelinatingpolyneuropathies,AIDP)是最常见的,也是经典的吉兰-巴雷综合征(Guillain- Barré syndrome,GBS)类型,与慢性炎性脱髓鞘性多发性神经根神经病(chronic inflammatory demyelinating polyneuropathy,CIDP)均由免疫介导,是引起急慢性迟缓性麻痹的常见病因。多数患者发病前存在先兆疾病,最常见的是呼吸道感染,已经发现一些微生物,如空肠弯曲菌、寨卡病毒、HIV、虫媒病毒、流感株病毒、人类乳头瘤病毒、冠状病毒19 号(COVID-19)等,部分自身免疫性疾病和肿瘤,如自身免疫性甲状腺炎、神经淋巴瘤、甲状腺肿瘤等多种因素均可引起或伴行[1-5],有证据支持外周神经结构成分与微生物的分子触发的自身抗体介导的免疫过程或其他免疫性疾病、肿瘤导致的二次免疫介导的机制有关,而不是直接的微生物或肿瘤损害。
AIDP与CIDP的确诊是结合临床特征、脑脊液总蛋白测定[6]及神经电生理检测的综合评估。神经电生理改变以运动神经脱髓鞘改变为主[7],二者病程及治疗方法不同,临床表现与神经电生理检测有较多相似及重叠。现有诊断标准存在一定局限性,会导致某些综合征的部分变异型被漏诊。研究表明AIDP 与CIDP 存在地域差异[8-9],包括低收入国家诊断及免疫治疗机会不足等[10]。有必要为患者提供更好的诊断和治疗机会,并研发能够限制神经损伤程度的有效调节方法,尽可能避免或减少神经损伤程度,减少死亡发生,减轻家庭和社会负担,因此前瞻性、回顾性及序贯性的持续研究非常必要[11-13]。
本文旨在收集临床拟诊的AIDP 与CIDP患者,重点从神经电生理角度进行回顾性分析,对比研究其临床及神经电生理特征,结合指南和标准,针对神经电生理采用更为细致的方法,对神经传导、神经根及针肌电图进行对比分析,了解二者相同及不同之处,尽早明确诊断,以便为临床诊断提供更有价值的早期证据,把握临床治疗时机,有助于患者更好、更早康复。
1 资料与方法
1.1 一般资料收集2017-06—2020-06 就诊于驻马店市第一人民医院神经内科、儿科的临床拟诊为AIDP 与CIDP 患者。参照2019 年中华医学会神经病学分会颁布指南及欧洲儿科神经病学学会(European Paediatric Neurology Society,EPNS)2020 年标准[14]。其中AIDP 患者16 例,男9 例,女7 例;儿童2 例,其中2岁4个月1例,8岁1例;发病年龄2~76(51±22)岁。CIDP 患者7 例,男4 例,女3 例;儿童(7 岁)1 例;发病年龄7~68 岁(52±13)岁。2 组一般资料对比差异无统计学意义(P>0.05)。
1.2 观察指标(1)收集整理相关资料,包括患者性别、发病年龄、首诊病程、临床症状、体征分布及脑脊液、神经电生理特点。(2)神经电生理检测参数:双侧正中、尺、腓总、胫后神经的相关指标:运动传导速度(motor conduction velocity,MCV);远端和近端复合肌肉动作电位(distal compound muscle action sensory,dCMAP;proximal compound muscle action potential,pCMAP),CMAP 均采用负峰值;末端运动潜伏期(distal motor latency,DML);正中、尺、胫后神经F 波潜伏期、出波率,H 反射。正中、尺、腓肠、腓浅神经感觉电位相关指标:感觉神经动作电位(sensory nerve active potential,SNAP)采集均采用逆向法、负峰值;感觉传导速度(sensory conduction velocity,SCV)测定;合并面瘫患者加做瞬目反射及面神经运动传导;所有CIDP 患者及部分AIDP患者(根据病程长短)加做针极肌电图判断有无合并轴索损害。
1.3 标准制定(1)在运动神经传导速度、传导阻滞(conduction block,CB)、远端潜伏期、波形离散(temporal dispersion,TD)、F 波潜伏期延长方面AIDP 和CIDP 指南均采用不同判断标准判定运动神经是否存在脱髓鞘病变,在至少两条运动神经符合诊断标准情况下,本研究将所有运动神经及感觉神经异常指标进行分析,除临界值以外的异常值均列入研究指标。(2)无论AIDP和CIDP,指南指出判断传导阻滞可靠性降低在CMAP 负相波波幅达不到正常值下限20%时,或负相波波幅低于1 mV时判断传导阻滞应慎重[15],本研究中符合此两项者未列入传导阻滞。研究认为,正常人胫神经腘窝刺激CMAP振幅往往低于内踝,正常对照可能下降到50%[16],本组中无论AIDP 还是CIDP,胫神经均以50%以上作为传导阻滞统计标准。(3)AIDP 和CIDP 中CMAP 降低均不属于指南制定标准,本研究将其异常列入研究,判断脱髓鞘基础上伴随的CMAP降低与轴索型GBS 的不同。(4)感觉传导异常在指南中未给出明确异常标准,本研究将所有明显低于正常值低限的数据(SCV、SNAP)均列入统计分析资料,临界值未统计。(5)本组资料将H反射列入研究,F 波出波率异常采用较严格的50%以下纳入标准。(6)EMG 检查主要用于判断运动神经轴索损害,这种改变只是脱髓鞘疾病的伴随现象,而且多数2 周内就诊的AIDP患者无法显示急性轴索损害的证据,本研究中此项检测未列入统计分析。
1.4 统计学处理采用SPSS 20.0 统计软件进行数据分析,计数资料采用率(%)描述,计量资料采用均数±标准差(±s)表示;两样本率的比较行χ2检验,两样本均数比较行t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 临床特点(1)首诊病程:AIDP 为3~25 d,CIDP 为2 个月~8 a。(2)症状和体征:AIDP组四肢无力4例,双下肢无力12例,合并面瘫4例,其中双侧面瘫3例,单侧多脑神经麻痹1 例(面、舌下、舌咽、迷走、动眼神经),2 例以双侧面瘫起病;感觉障碍10 例,肢体刺痛6例。CIDP 组四肢无力3 例,双下肢无力4 例,合并双侧面瘫1例;主观感觉障碍5例,肢体刺痛2例。(3)脑脊液腰椎穿刺检查:所有患者均获随访,其中1例AIDP正常,余均显示蛋白细胞分离,其中1例DADS患者7个月时第2次就诊时蛋白细胞分离,3个月首诊时未见分离。
2.2 临床资料AIDP患者16例;CIDP患者7例,包括经典型3 例,远端获得性脱髓鞘性对称性神经病(DADS)2 例,多灶性运动感觉脱髓鞘神经病(LSS)[18]2 例,无纯运动或纯感觉型患者。2组临床资料比较见表1。

表1 AIDP与CIDP患者临床资料比较Table 1 Comparison of clinical data between AIDP and CIDP patients
2.3 神经传导检测异常值及异常率比较2组患者运动及感觉传导检测异常值比较见表2,单神经检测异常率比较见表3,神经电生理异常综合指标比较见表4。
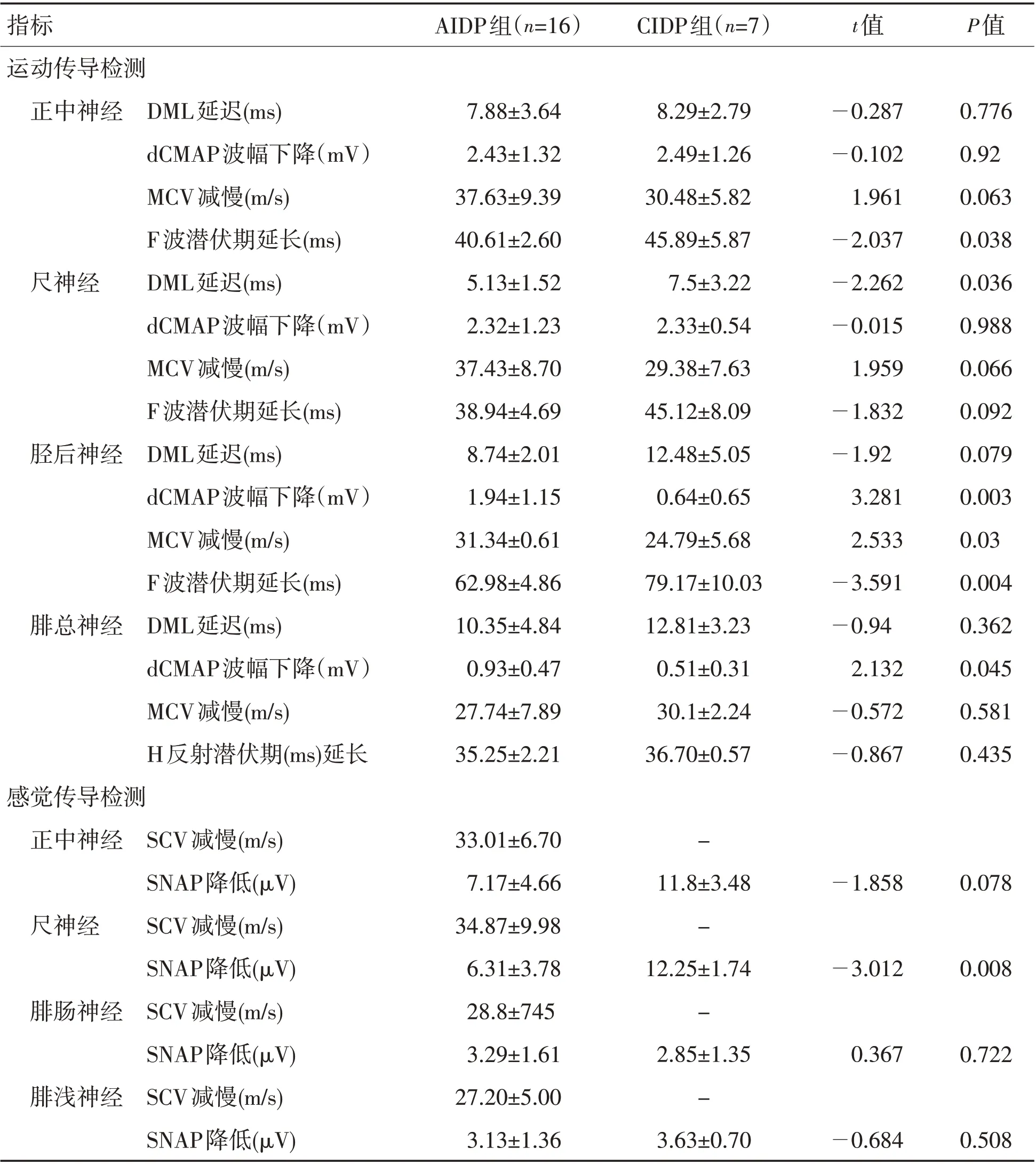
表2 AIDP与CIDP患者神经传导检测异常值比较Table 2 Comparison of abnormal values of nerve conduction between AIDP and CIDP patients
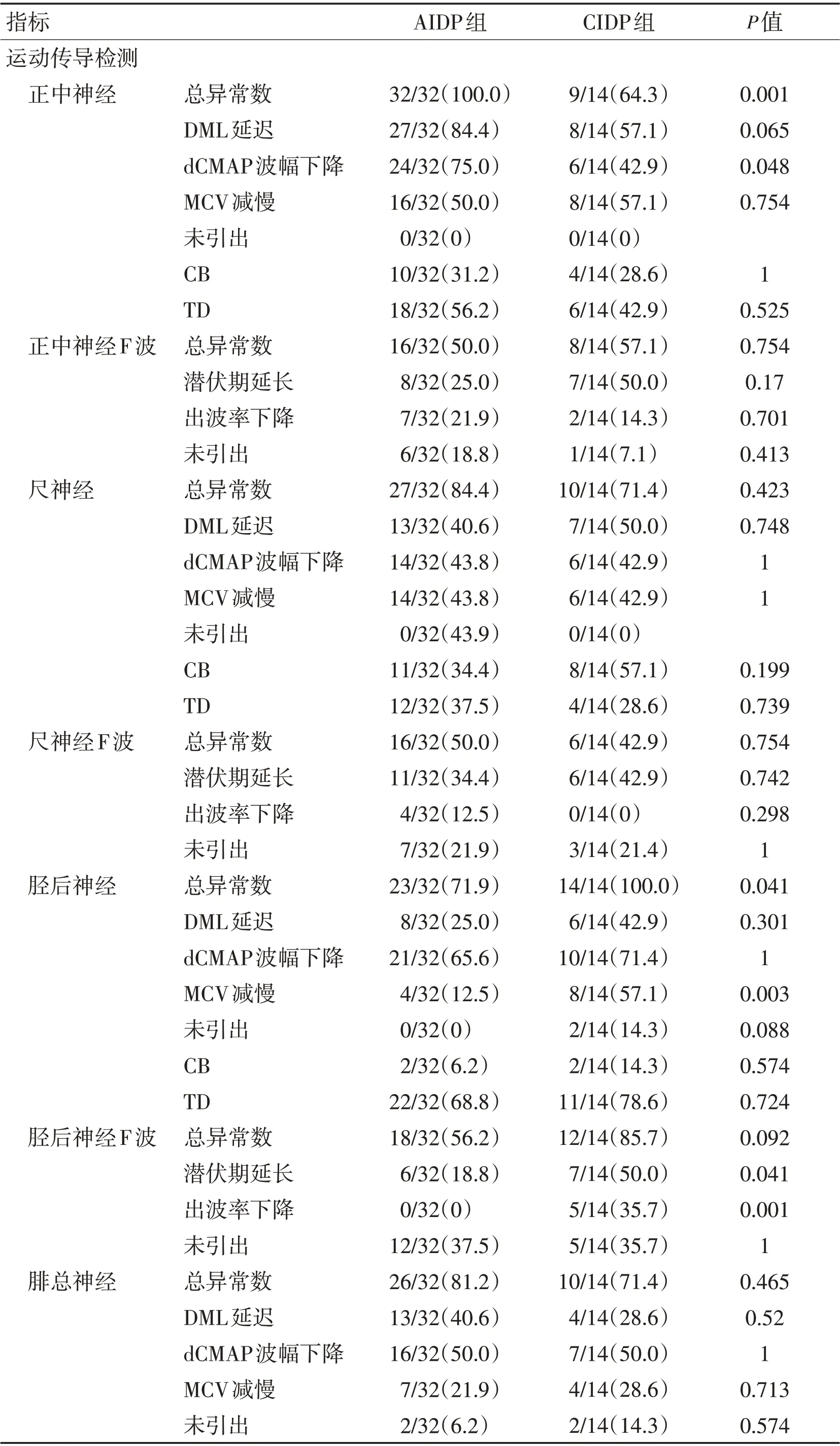
表3 AIDP与CIDP患者神经传导检测异常率比较Table 3 Comparison of abnormal rate of nerve conduction detection between AIDP and CIDP patients
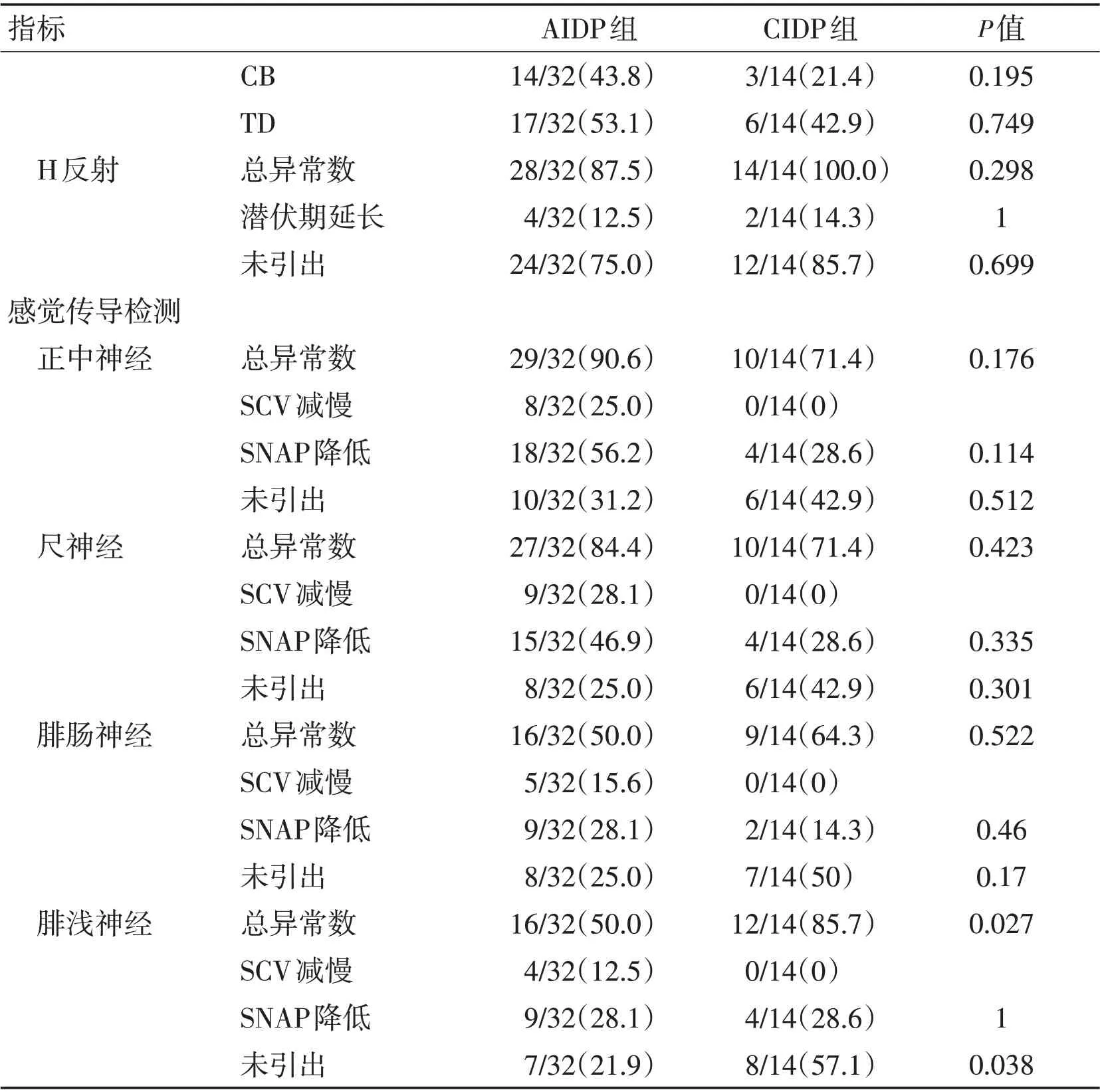
(续表)
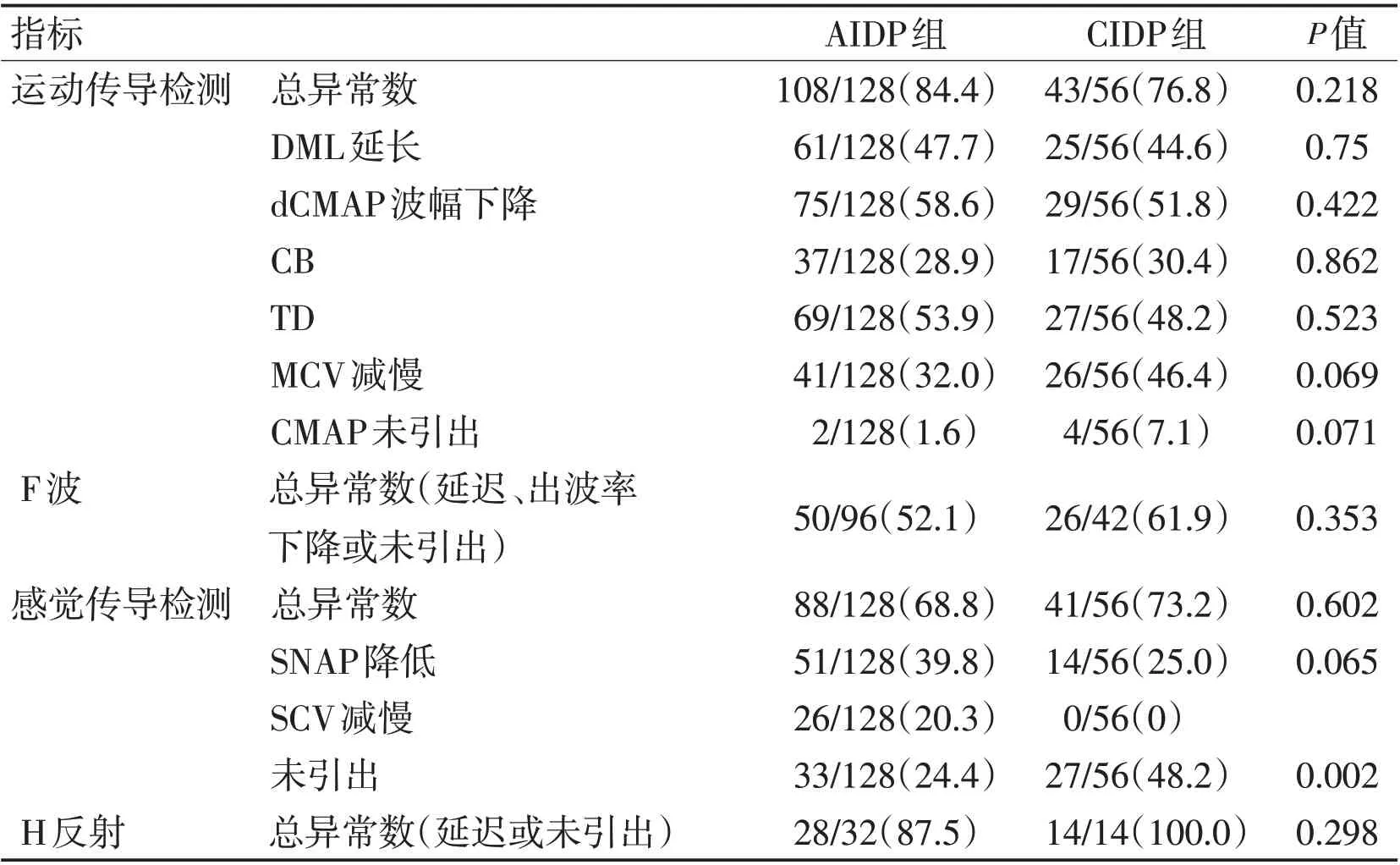
表4 AIDP与CIDP患者神经电生理异常综合指标比较Table 4 Comparison of comprehensive indexes of neuroelectrophysiological abnormalities between AIDP and CIDP patients
3 讨论
本组患者首诊病程和脑脊液蛋白升高方面均显示出明确差异,与指南完全相符;年龄、性别、脑神经受累等方面均未表现出明显差异,与相关研究[19-20]中AIDP 患者面神经受累比例较高不一致,究其原因可能是所涉及样本量偏小,与国内外报道可能存在偏差。
本组患者神经电生理资料显示,运动神经中AIDP患者组正中神经、CIDP患者组胫后神经的异常率均为100%,组间比较差异有统计学意义(P<0.05),提示在AIDP 组正中神经、CIDP 组胫后神经最易受累且受累较完全。AIDP组正中神经dCMAP下降,CIDP组胫后神经MCV减慢、F波潜伏期延长及出波率下降均高于AIDP组(P<0.05)。CIDP组尺神经DML延长,腓总神经dCMAP 下降,胫后神经dCMAP 下降、MCV 减慢、F 波潜伏期延长方面与AIDP 组对比,差异均有统计学意义(P<0.05),提示急性免疫性炎性损害最早更易选择性攻击正中神经,导致传导减慢及波幅降低,慢性炎性损害则更趋向于选择具有长度依赖性的下肢腓总、胫后神经及上肢尺神经远端。无论AIDP还是CIDP患者,H反射异常率均显著,CIDP 组高达100%,考虑与H 反射涉及通路相关,Ⅰa 类感觉纤维传入后,经过突触,传出通路为胫后神经运动支,所有涉及该通路的感觉及运动纤维受累均可引起H 反射传导异常,提示H反射早期异常在此两类疾病中具有较高预警作用。CIDP 组CB 在尺神经中发生率最高,与相关研究[21-22]结论一致,提示在伴感觉神经异常的电生理诊断中出现尺神经传导阻滞要结合临床考虑CIDP的更大可能性。F 波异常在胫后神经CIDP患者中发生率最高,同时发现2组患者胫后神经与其他神经相比,均呈现出较高比例的波形离散,提示无论急慢性炎性损害胫后神经更容易出现长度依赖性的斑片状不均匀脱髓鞘,尽管免疫攻击在近端神经节段(根和丛)最为严重,但远端的临床缺陷通常是最严重的,这可能是因供应远端肌肉的神经最长,因此最有可能受到炎性脱髓鞘作用的损害[23]。本研究采取不同于其他学者的研究方法[24-27],2 组感觉传导异常率接近;CIDP 组未发生真正SCV 减慢,AIDP 组出现少量SCV 减慢;在SNAP 未引出病例中,CIDP组发生率更高,与AIDP组比较差异有统计学意义(P<0.05),其中腓浅神经SNAP未引出率及总异常率均显著高于AIDP 组,提示此两类以运动神经脱髓鞘为主的炎性损害中,伴随的感觉神经损害以轴索损害为主,其中腓浅神经在CIDP 患者中更易受累且较重;另外,AIDP 组患者尺神经SNAP 降低更明显(P<0.05)。
2组患者神经电生理综合指标中,除CIDP组SNAP未引出外,绝大多数指标的异常比例无显著性差异(P>0.05)。由于腓浅神经SNAP 显著增高的未引出率,其他感觉神经组间对比无明显差异,考虑CIDP 组SNAP 未引出比例明显增高主要因素为腓浅神经SNAP未引出。
临床神经电生理工作中对于高度怀疑CIDP,常规节段检测无异常患者,建议多节段(正中神经腕肘腋锁、尺神经腕肘下肘上腋锁)CMAP检测[28],避免LSS患者中段及近端CB的漏诊。CIDP发病率较低,本组患者数据较少,在现有资料基础上未能固定随访每位患者,无法动态观察患者神经电生理指标变化。由于这些局限性,可能会导致与国内外其他同行的研究存在某些偏差,但本研究主要将AIDP 与CIDP 两大类型电生理特性进行比较,结果显示其在神经传导研究方面仍存在不同的特性。
神经电生理测定在AIDP 和CIDP 诊断中均具有不可替代的重要价值,可为临床治疗提供指导,并预警即将发生的临床复发[29-30],建议在有条件的医院对患者及时检测、定期监测,以便为临床提供更多的支持和帮助[31-32]。希望能在各电生理中心设定相对统一的检测指标,以便在今后的工作中能够进行多中心大规模的循证医学研究,尽量减少偏差,为临床提供更好的帮助。

