黄绿叶突变体冀麦5265yg的光合生理特性分析
郑伟,师筝,龙美,廖允成
黄绿叶突变体冀麦5265yg的光合生理特性分析
郑伟,师筝,龙美,廖允成
西北农林科技大学农学院,陕西杨凌 712100
【】叶色突变体是研究叶绿素合成、叶绿体发育和光合作用的理想材料,探索小麦黄绿叶突变体的光合生理特性,旨在阐明其光合作用调控机理,为小麦黄绿叶突变体的进一步利用奠定基础。以野生型冀麦5265和突变体冀麦5265yg为试验材料,对叶色表型进行观察,采用分光光度计和试剂盒法测定色素含量和酶活性,并利用Li-6400便携式光合仪和PAM100叶绿素荧光仪进行光合气体交换参数和叶绿素荧光参数测定。表型观察和色素含量结果表明,突变体苗期叶片表现为黄绿色,抽穗后叶片逐渐转变为淡绿色。遮阴处理可以使叶片颜色部分复绿,但比野生型略浅,属于光诱导转绿型突变体。突变体叶绿素a和叶绿素b含量显著低于野生型,叶绿素a/b的比值升高,为典型的叶绿素缺乏型突变体;光响应曲线和CO2响应曲线显示,突变体的表观量子效率(AQY)、光饱和点(LSP)、最大净光合速率(n-max)、光补偿点(LCP)、暗呼吸速率(Rd)、羧化效率(CE)和饱和CO2浓度(I-sat)显著高于野生型,说明突变体叶片的光合机构稳定,强光下光合速率更高;光合气体交换参数和叶绿素荧光动力学参数表明,突变体的净光合速率(n)、蒸腾速率(r)、气孔导度(s)、光化学量子效率(v/m)、实际光化学效率(ΦPSII)和光化学淬灭系数(qP)显著高于野生型,说明其具有较强的光能转化和CO2固定能力;突变体的超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性均高于野生型,丙二醛(MDA)含量下降,可溶性糖和可溶性蛋白含量升高,说明抗氧化酶系统通过清除氧自由基降低了氧化损伤,突变体叶片细胞膜损害减轻,抗逆性增强;突变体的核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)活性显著低于野生型,磷酸烯醇式丙酮酸羧化酶(PEPC)活性显著高于野生型,推测C4途径光合酶PEPC活性的升高可能是突变体具有较高净光合速率的原因之一。花后遮阴以及外源喷施抗坏血酸AsA和二硫苏糖醇DTT处理表明,突变体对光强变化更敏感、叶片内AsA含量及叶黄素循环效率更高。黄绿叶突变体冀麦5265yg叶片气孔导度明显改善、热耗散降低、C4途径光合酶活性升高,是其光合速率提高的主要原因。该结果为小麦叶色突变体高光合特性的分子调控机制研究奠定基础。
小麦;黄绿叶突变体;光合气体交换参数;叶绿素荧光参数;酶活性
0 引言
【研究意义】叶色突变体是一类具有明显性状的突变体类型,它在高等植物叶绿素生物合成与代谢、叶绿体分化与发育等研究中具有重要意义。【前人研究进展】目前,在水稻[1]、小麦[2-4]、大豆[5-6]、玉米[7]、棉花[8-9]、油菜[10-11]、大麦[12-13]等多种作物中鉴定出叶色突变体。Awan等[14]将叶色突变体分为黄化、黄绿、绿黄、绿白、白化、浅绿、白翠和条纹8种类型,其中黄绿叶突变体因为其非致死性且具有叶色标记应用潜力被深入研究。关于作物中的黄绿叶突变基因也被报道,例如水稻的、、基因[15-17]、玉米的、、基因[18-20]、谷子的基因[21]、油菜的基因[22]、大麦的和基因[23-24]、小麦的和基因[25-26]。对于大多数叶色突变体来说,叶绿素合成代谢受阻、叶绿体结构发育异常,会导致叶绿素含量下降,光合生理特性的改变甚至光合速率的不可逆降低,从而限制其在生产上的应用。茹广欣等[27]对泡桐黄化突变体的研究表明,突变体叶绿素含量显著降低,净光合速率和蒸腾效率降低,丙二醛含量和抗氧化酶活性升高。杨小苗等[28]发现番茄黄化突变体的光合色素含量及叶绿素a/b比值均显著降低,其光合参数指标均显著低于野生型。胡亮亮等[29]发现黄瓜黄绿叶突变体的光合色素和净光合速率显著降低,胞间CO2浓度显著升高,叶绿素荧光参数0、m、0/m、ETR和NPQ均显著降低。曹莉等[30]研究发现,小麦黄绿突变体0、m、v、qP、qN均显著低于亲本,光合效率显著降低。但结果也不尽相同,少数水稻突变体虽然光合色素含量降低,光合速率却显著升高,光能转化效率显著增强。Dai等[31]研究发现,水稻突变体叶绿素b含量降低,虽然减少了光系统截获的光能, 但相对提高了光能利用率,减少了活性氧对突变体的破坏,使其具有较强的耐强光特性。Zhou等[32]对水稻黄叶突变体研究表明,突变体表现较强的光合速率和耐光抑制的能力,PSII有效光化学量子产量、实际利用量子产额、非环式电子传递速率都显著高于野生型。Deng等[33]研究发现,水稻黄绿突变体的光合色素较野生型降低,但其光合效率略有升高。【本研究切入点】目前为止,关于光合性能明显改善的小麦叶色突变体还未见报道,试验前期发现突变体冀麦5265yg的光合色素比野生型降低近50%,但其净光合速率却显著高于野生型,表明该突变体在小麦叶色标记和高光效育种中具有较大的应用价值。【拟解决的关键问题】本研究以野生型冀麦5265和黄绿突变体冀麦5265yg为材料,分析光合色素、光合速率、荧光参数以及光合关键酶活性,阐明突变体高光合速率的生理机制,为小麦高光效育种实践提供理论依据。
1 材料与方法
1.1 试验材料
本研究采用的突变体冀麦5265yg是小麦品种冀麦5265幼胚愈伤组织培养得到的再生系。经过连续多代自交,冀麦5265yg的黄绿叶性状能稳定遗传。本试验所用材料为M7代,因此黄绿突变体冀麦5265yg除了叶色改变之外,其他遗传背景与亲本冀麦5265完全相同。大田试验于2017—2018年小麦生长季种植于西北农林科技大学管村试验站,试验田地力均一、肥力及水浇条件好。野生型和突变体各设置3个重复,随机区组排列,小区面积为 1.5 m×6.0 m,行距25 cm,每行60粒种子。生育期内按常规栽培措施进行管理。
1.2 试验方法
1.2.1 光合色素含量测定 参照Lichtenthaler[34]研究方法,用LAMBDA 25紫外/可见分光光度计(Perkin Elmer)测定叶绿素a、叶绿素b和类胡萝卜素的含量。取4周幼苗的第2片顶叶,将叶片剪碎混匀,称取0.2 g置于研钵中,加入96%的乙醇5 ml充分研磨匀浆,将匀浆液移入离心管中,反复冲洗3次直至匀浆液无色,3 000×离心10 min。以96%乙醇作为对照,在649 nm波长下测定叶绿素a的OD值,665 nm波长下测定叶绿素b的OD值,在470 nm下测定类胡萝卜素的OD值。叶绿素a的浓度Ca(µg·mL-1)= 13.95×A665-6.88×A649;叶绿素b的浓度Cb(µg·mL-1)= 24.96×A649-7.32×A665;类胡萝卜素的浓度Cc(µg·mL-1)=(1000×A470-2.05×Ca-114.8×Cb)。
1.2.2 光响应曲线和CO2响应曲线的测定 开花期,在晴天上午9:00—11:00,利用LI-6400便携式光合作用测定仪(Li-Cor Inc,USA),每个小区随机选取3株小麦旗叶,3个小区即3次生物学重复进行测量。使用红、蓝光源,光强从0—2 000 µmol·m-2·s-1设置14个光照强度(0、25、50、100、200、400、600、800、1 000、1 200、1 400、1 600、1 800、2 000 µmol·m-2·s-1),CO2浓度恒定为 400 µmol·mol-1,湿度为大气中的湿度,进行光合速率对光强的响应。设置13个CO2浓度梯度(25、50、100、150、200、250、300、350、400、600、800、1 000、1 200 µmol·mol-1),光强恒定为1 200 µmol·m-2·s-1,测量光合速率对CO2浓度的响应。用叶子飘[35]的方法模拟计算光补偿点和光饱和点等特征参数。
1.2.3 叶绿素荧光参数的测定 采用PAM-100便携式叶绿素荧光仪(WALZ,Germany)测定旗叶的叶绿素荧光诱导动力学曲线和快速光响应曲线。材料需暗适应30 min后进行测量,重复测定6片旗叶,计算平均值。参照黄小辉等[36]的方法,m/0是PSⅡ的电子传递速率、v/0表示PSⅡ的潜在活性,v/m表示PSⅡ的最大光能转化效率,ΦPSII为实际光化学效率,qP为光化学淬灭系数,NPQ为非光化学粹灭系数。其中,v/m=(m-0)/m;ΦPSII=(m'-s)/m';qP=(m'-s)/ (m'-0');NPQ=(m-m')/m'。测定叶绿素荧光快速响应曲线时,光强设置为0、20、60、100、300、500、600、800、1 000、1 200、2 000、3 000 µmol·m-2·s-1,时间20 s。
1.2.4 主要生理指标与光合关键酶活性测定 于拔节期、开花期和灌浆期,分别对野生型冀麦5265和黄绿突变体冀麦5265yg叶片生理指标(丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、可溶性糖、可溶性蛋白),以及光合作用关键酶(Rubisco、PEPCase、Ca2+-ATPase和Mg2+-ATPase活性)进行测定。每个材料5—10株,取主茎穗上的新展叶称0.2 g,洗净用滤纸擦干剪碎,按照m/v=1﹕9比例加入生理盐水,冰浴研磨后2 500×离心10 min,收集上清液稀释至2%浓度的组织匀浆待测。采用商用ELISA检测试剂盒测定(南京建成生物工程研究所,江苏,中国),参照说明书进行操作,设置3次重复。
1.2.5 可溶性糖的HPLC测定 称取拔节期小麦完全展开叶0.1 g,加入1 mL 50%的乙醇溶液(含0.1 mmol·L-1HCl),用研磨棒匀浆,12 000 r/min 离心15 min。取上清液用0.22 µm 滤膜过滤备用,每个样品设置基因型10个重复。使用LTQ XL线性离子阱质谱分析仪进行分析。液相色谱分离柱为IntertsilOSD- 3C18,流动相A为5%乙腈水溶液含0.1%甲酸;流动相B为100%乙腈含0.1%甲酸。梯度洗脱法,流速0.3 mL·min-1,质谱在阳离子电喷雾模式下运行(电压为4.5 kV)。碎片化和扫描采用Full MS/MS 法,数据采集和处理使用Xcalibur 2.1软件。定量由已知浓度的外部标准糖混合物计算。
1.2.6 遮阴及外源喷施抗坏血酸(AsA)和二硫苏糖醇(DTT)处理的具体方法 处理时期为抽穗期至开花期。遮阴处理:以自然光为对照,搭建透光率为30%的黑色遮阳网处理,确保光照强度小于500 µmol·m-2·s-1。遮阳网距地面1.6 m,通风条件良好,网内外无温差。处理时长10 d,采集叶片光合指标,后恢复光照3 d,再次测定。外源AsA和DTT喷施处理:采用AsA(1.5 mmol·L-1)和DTT(3 mmol·L-1)喷施小麦叶面,以清水为对照,每个处理设置3个重复。喷施时间为下午5:00,连续处理3 d。于第4天早上9:00采集光合指标,每个处理选取5株小麦旗叶叶片,清洗、表面晾干后进行测量。
1.3 数据分析
所有数据采用Excel或 SAS8.0统计分析软件进行;作图采用Excel软件。
2 结果
2.1 黄绿叶色性状的表型及光合色素含量差异
冀麦5265yg是由小麦品种冀麦5265的幼胚愈伤组织培养得到的再生系,该突变体除了叶色改变之外,其他遗传背景与野生型完全相同。突变体叶片从萌发即表现黄色,分蘖期幼苗的叶片为浅黄色(图1-A),随着生长发育叶片由浅黄色转变成黄绿色,一直持续到收获期(图1-B)。

A:野生型冀麦5265(左)和突变体冀麦5265yg(右)苗期表型。B:突变体冀麦5265yg(左)和野生型冀麦5265(右)灌浆期表型。标尺为1.0 cm
为了进一步明确突变表型,试验测定光合色素含量。正常光照条件下,突变体的叶绿素a、叶绿素b和总叶绿素含量为野生型的61.3%、41.9%和57.3%,类胡萝卜素含量差异不显著。由于突变体Chlb含量降低的程度大于叶绿素a,因此Chla/b比值明显高于野生型(表1)。结果表明,冀麦5265yg主要是由于叶绿素含量降低而表现出叶片颜色变浅。
2.2 光响应曲线和CO2响应曲线比较
CO2浓度恒定为400 µmol·m-2·s-1,一定光强范围内,野生型冀麦5265和突变体冀麦5265yg的光合速率随光强增大呈上升趋势。当光强达500 µmol·m-2·s-1前,突变体光合速率低于野生型,而光强在500至2 200 µmol·m-2·s-1范围内,突变体的光合速率高于野生型,光照强度越大两者差异越显著(图2-A)。在温度为25℃、光照强度恒定为1 500 µmol·m-2·s-1下,野生型冀麦5265和突变体冀麦5265yg的光合速率随CO2浓度的增加呈上升的趋势,且在相同CO2浓度下突变体光合速率始终高于野生型(图2-B)。说明突变体的光合机构相当稳定,对强光更敏感,在强光下的光合速率更高。
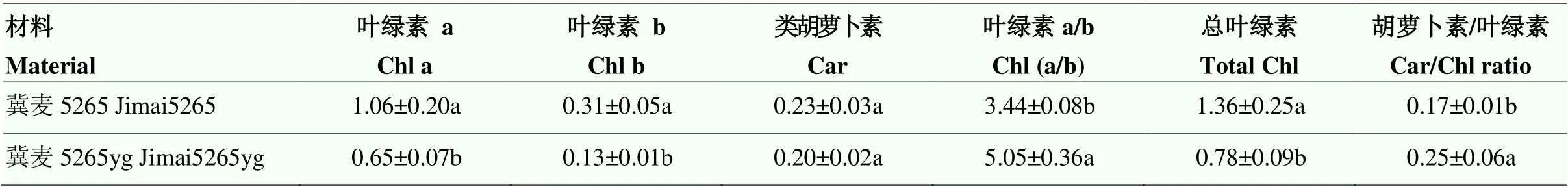
表1 冀麦5265和冀麦5265yg叶片光合色素含量测定(鲜重)
数据为平均值±标准差,3次重复。同列数据后,不同小写字母表示处理间差异显著(<0.05)。下同
Data are means ± SD. In the same columns, different small letters indicate significant difference after pairwise comparisons according to Duncan’s multiple test (<0.05). The same as below
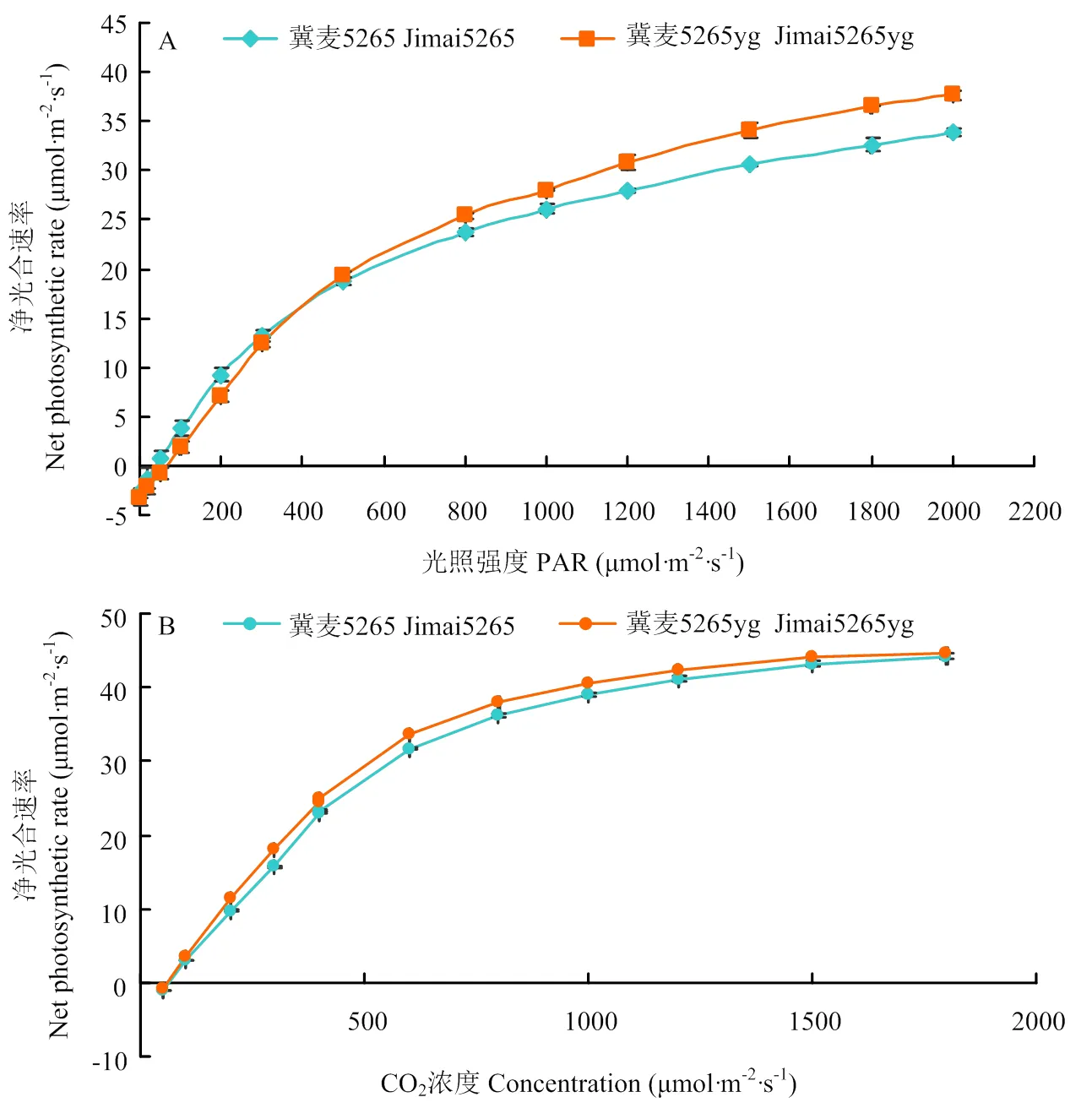
图2 开花期冀麦5265和冀麦5265yg的光响应曲线和CO2响应曲线
通过响应曲线计算特征参数(表2),突变体的表观量子效率(AQY)、最大净光合速率(n-max)、光饱和点(LSP)、光补偿点(LCP)和暗呼吸速率(Rd)等特征参数分别比野生型高7.47%、55.96%、15.69%、50.97%和56.56%。较高的表观量子效率和光饱和点,说明冀麦5265yg在光合作用中具有较强的光能转换能力,对强光的适应性更强。同时,较高的光补偿点和暗呼吸速率说明突变体对弱光的利用能力较差。同时,突变体的羧化效率(CE)、饱和CO2浓度(I-sat)和光呼吸速率(Rp)均高于野生型,说明冀麦5265yg的光合电子传递和磷酸化活性、加氧酶活性较高,对CO2的同化能力和利用效率增强。
2.3 光合气体交换参数分析
突变体在各生育时期的净光合速率、气孔导度、胞间CO2浓度和蒸腾速率均高于野生型(表3)。突变体的净光合速率在拔节期、开花期和灌浆期分别比野生型高29.52%、22.34%和6.54%,且显著差异。气孔导度比野生型高7.69%、73.68%和18.52%,胞间CO2浓度比野生型高1.63%、6.86%和11.35%,蒸腾速率比野生型高9.59%、12.52%和19.93%。随着生育时期的推进,二者的光合特性指标呈先上升后下降的趋势,开花期达到最大值。
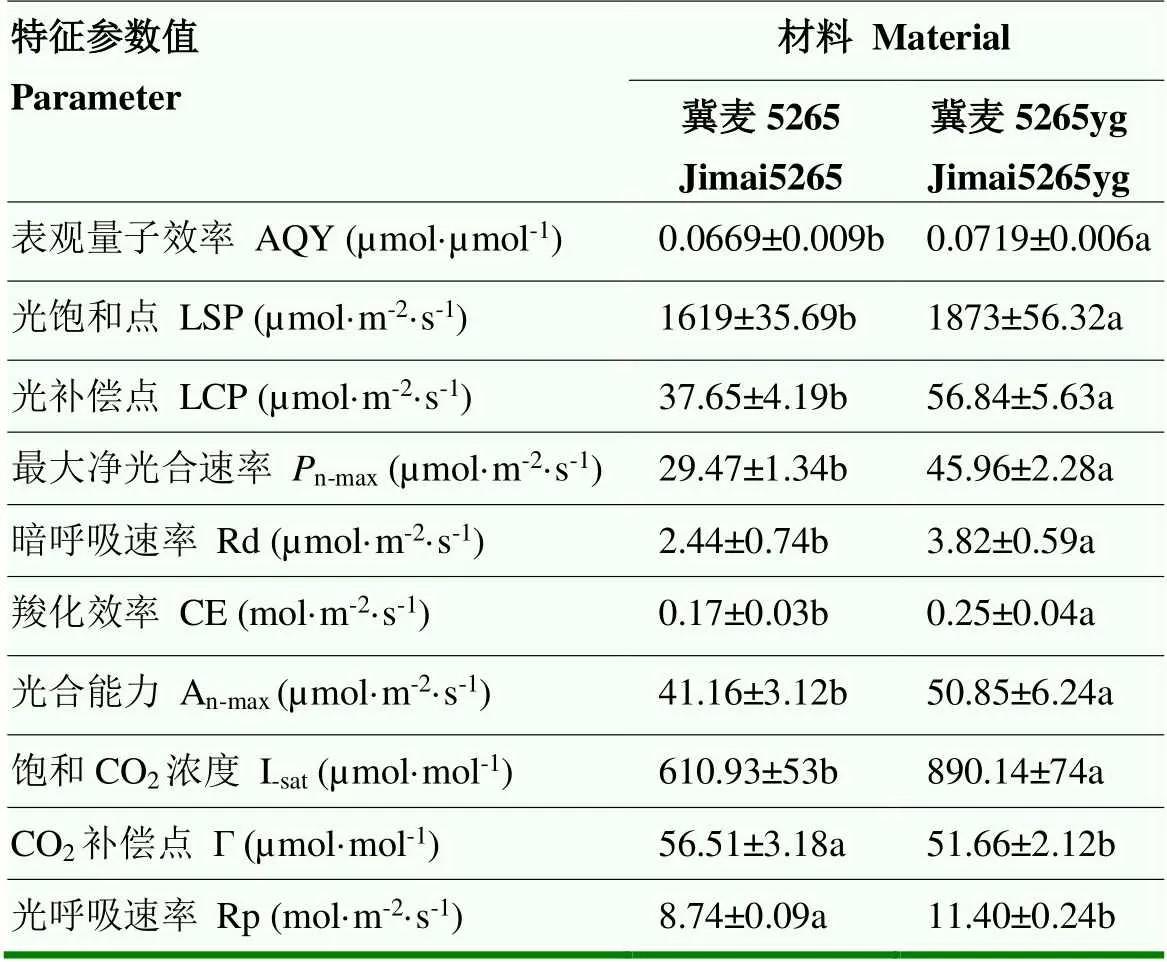
表2 开花期冀麦5265和冀麦5265yg旗叶的特征参数
2.4 叶绿素荧光参数分析
分析拔节期、开花期和灌浆期旗叶的荧光特性,结果显示突变体冀麦5265yg的初始荧光0显著低于野生型。0为光系统Ⅱ反应中心全部开放时的荧光水平,与叶绿素含量密切相关,分析叶绿素含量减少是导致0降低的主要原因。此外,突变体v/m、ΦPSⅡ和qP显著高于野生型,表明PSll反应中心光能转换效率和原初光能捕获效率较高,PSⅡ天线色素吸收光能并用于光合电子传递的量子产额较大、非环式电子传递速率较高。同时,突变体的NPQ明显较低,说明其PSⅡ天线色素吸收的光能以热形式耗散较少(表4)。
由图3可以看出,实际光量子效率(ΦPSⅡ)和光化学淬灭系数(qP)随光强的增加呈下降趋势,而相同光强下突变体显著高于野生型。表观电子传递速率(ETR)和非光化学淬灭系数(NPQ)则随着光强增加呈上升趋势,相同光强下突变体的ETR显著高于野生型,NPQ显著低于野生型。结果表明突变体表现出电子传递和光能分配的优势,获得较高的光能转化效率,弥补了光能吸收不足且对光抑制的敏感性降低,使其区别于其他叶色突变体,表现出较强的碳同化和电子流,较高的光能利用效率,该结果与突变体冀麦5265yg具有较高净光合速率的检测结果一致。
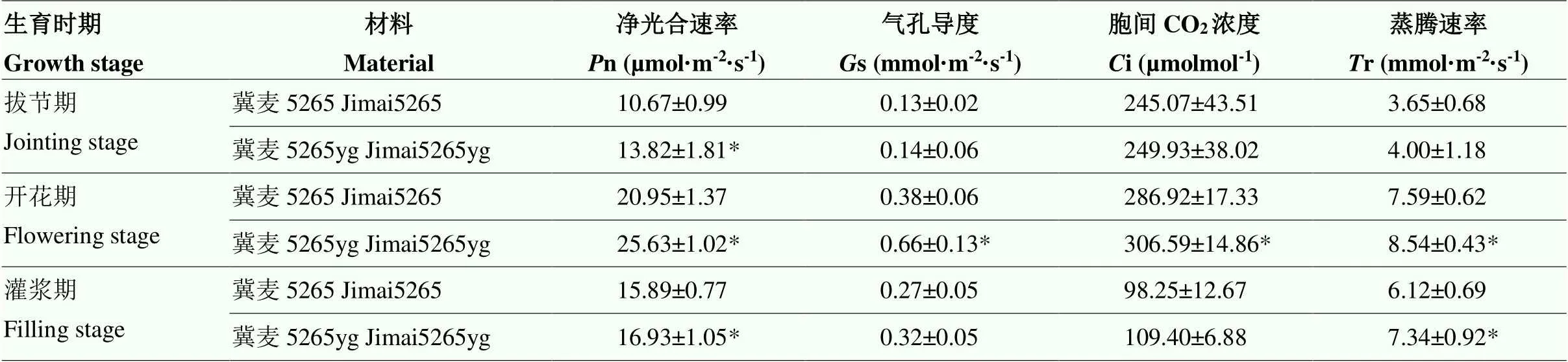
表3 不同生育时期冀麦5265和冀麦5265yg旗叶的光合特性
数据为5次重复的平均值±标准差,*表示差异达到显著水平(<0.05)。下同
Data are means ±SD of 5 replicates. *, significant level at<0.05. The same as below
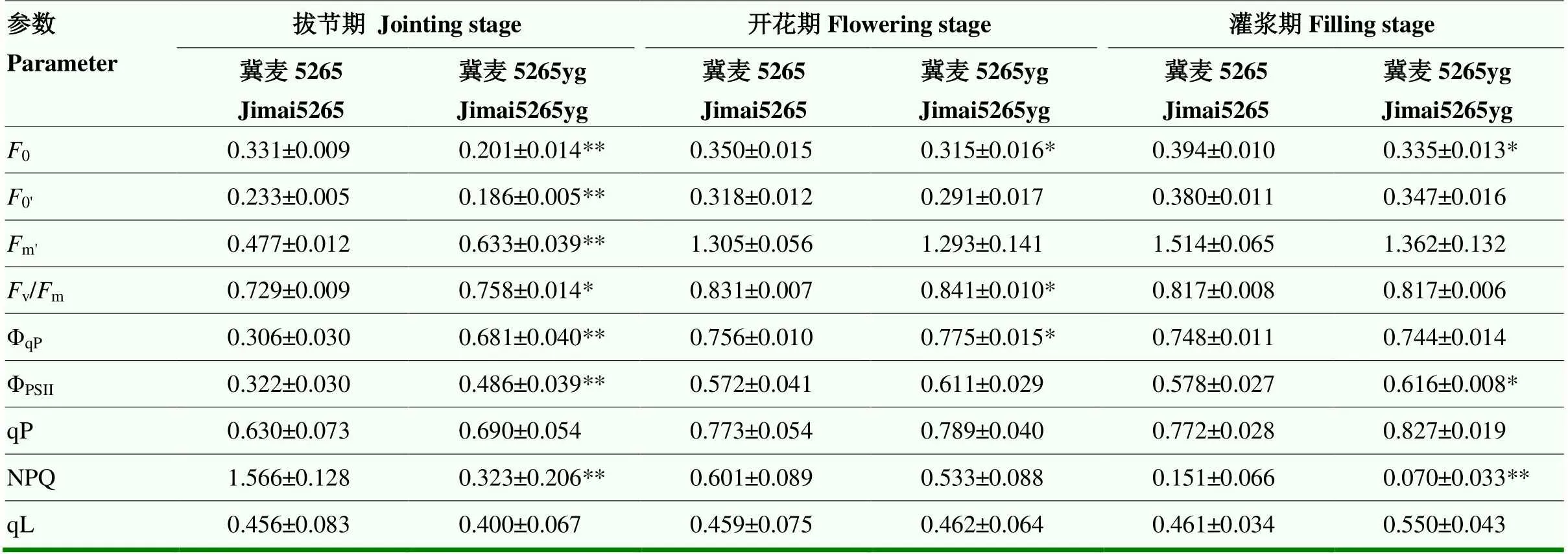
表4 野生型冀麦5265和突变体冀麦5265yg的叶绿素荧光动力学参数
数据为5次重复的平均值±标准差,** 表示差异达到极显著水平(<0.01)
Data are means±SD of 5 replicates. ** significant level at<0.01, test by Ducan
2.5 抗氧化酶活性和丙二醛含量分析
抗氧化酶活性和丙二醛含量检测如图4所示,突变体冀麦5265yg SOD的活性在拔节期、开花期和灌浆期分别为267.22、215.49和233.52 U·mL-1,比野生型高15.17%、10.33%和11.25%。CAT活性也显著高于野生型,分别为野生型的1.14倍、1.20倍和1.26倍。拔节期和开花期突变体POD活力低于野生型,但灌浆期其活力略高于野生型。MDA的含量分析表明,突变体在拔节期、开花期和灌浆期MDA含量分别为7.68、8.73和6.09 nmol·mL-1,比野生型降低了22.03%、17.49%和20.70%,且两者间达到显著性差异。结果说明突变体具有较强的抗氧化能力,能及时地清除细胞内产生的活性氧,减少质膜的氧化。
2.6 可溶性糖和可溶性蛋白分析
对可溶性糖和可溶性蛋白含量显著性分析表明,突变体的可溶性糖含量分别为492.00、516.04和463.88 µg·mL-1,显著高于野生型。随着小麦的发育进程,突变体可溶性蛋白含量呈现先降低后升高趋势,而野生型则呈现先升高后降低趋势,除了开花期,突变体可溶性蛋白也显著高于野生型(图5)。
为了进一步分析可溶性糖种类和含量变化,分别对拔节期突变体和野生型叶片中单糖、双糖和三糖进行RP-HPLC分析,结果见表5。突变体中的4种可溶性糖,包括葡萄糖、果糖、蔗糖和松三糖的含量均高于野生型。其中葡糖糖和果糖差异不显著,松三糖和蔗糖差异显著。可溶性糖和可溶性蛋白作为碳同化有机产物,其含量的增加进一步证实了突变体叶片的高光合性能。
2.7 光合碳同化途径关键酶活性分析
随着小麦的发育进程,Rubisco酶和PEPC酶活性呈现先升高后下降趋势(图6)。与野生型相比,突变体Rubisco的活性显著低于野生型,而PEPC酶的活性则显著高于野生型。光合关键酶Ca2+-ATPase的活性变化呈现先降低后升高趋势,Mg2+-ATPase活性则先升高后降低。拔节期和开花期突变体Ca2+- ATPase和Mg2+-ATPase的活性显著低于野生型,但灌浆期其Ca2+-ATPase和Mg2+-ATPase的活性显著高于野生型。
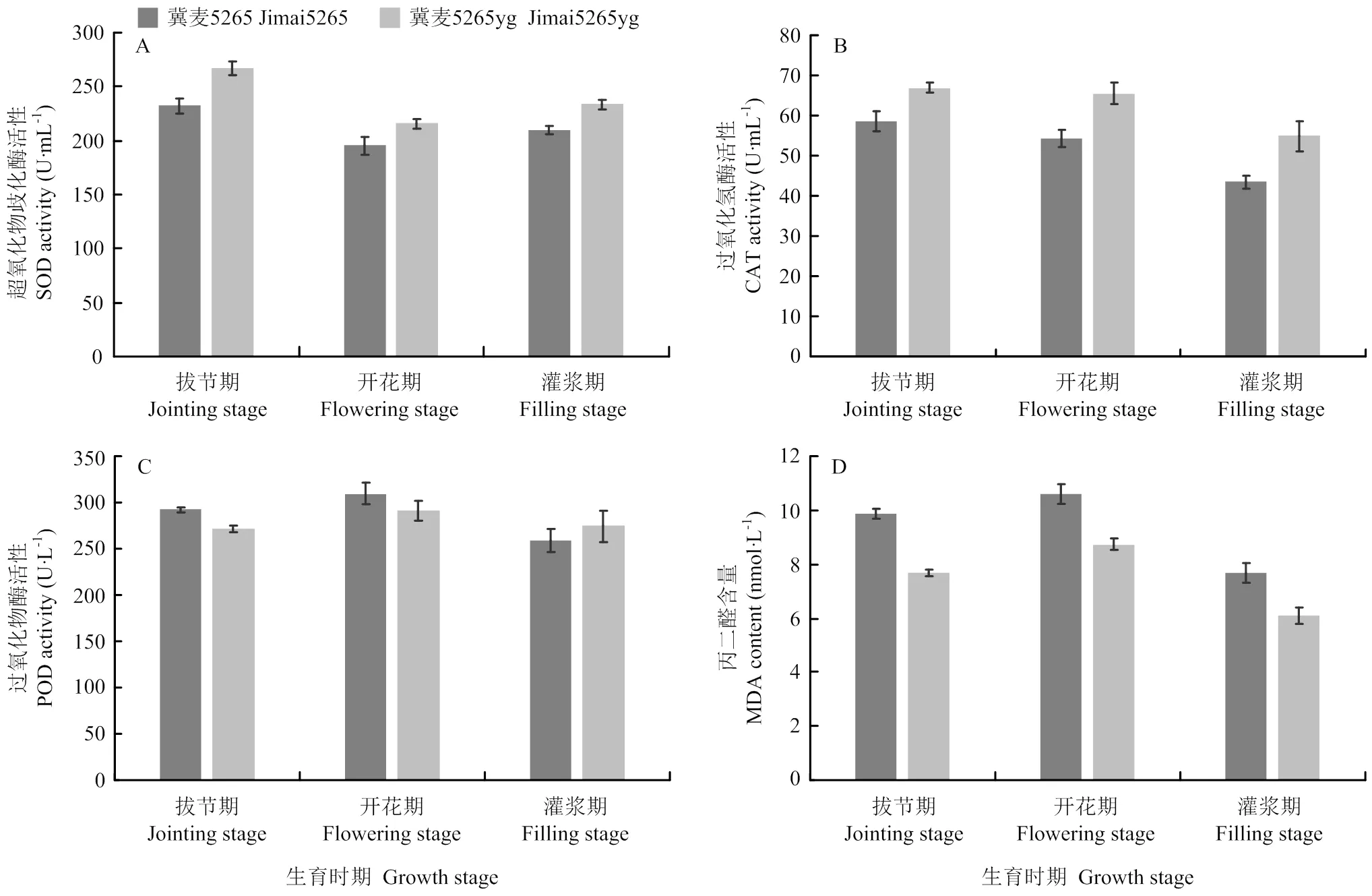
图4 冀麦5265与冀麦5265yg旗叶抗氧化酶活性和丙二醛含量
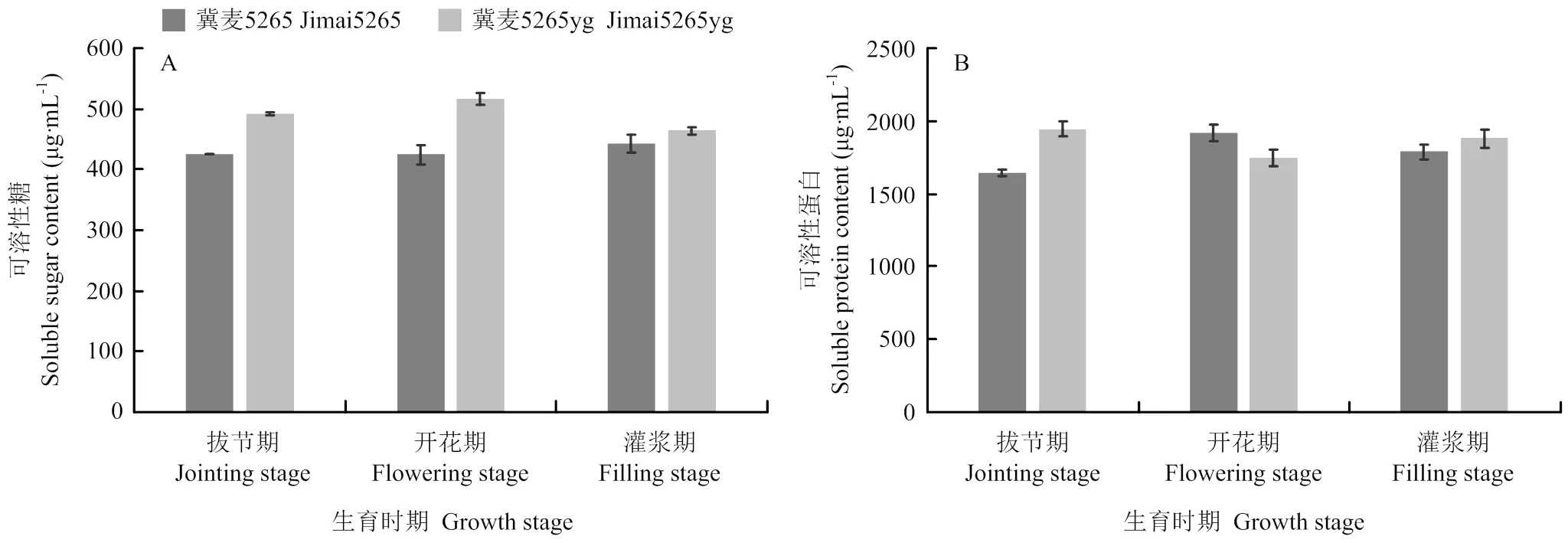
图5 冀麦5265与冀麦5265yg旗叶可溶性糖和可溶性蛋白含量的动态变化

表5 冀麦5265和冀麦5265yg叶片中可溶性糖的种类和含量
数据为平均值±标准差,10次重复 Data are means±SD of 10 replicates
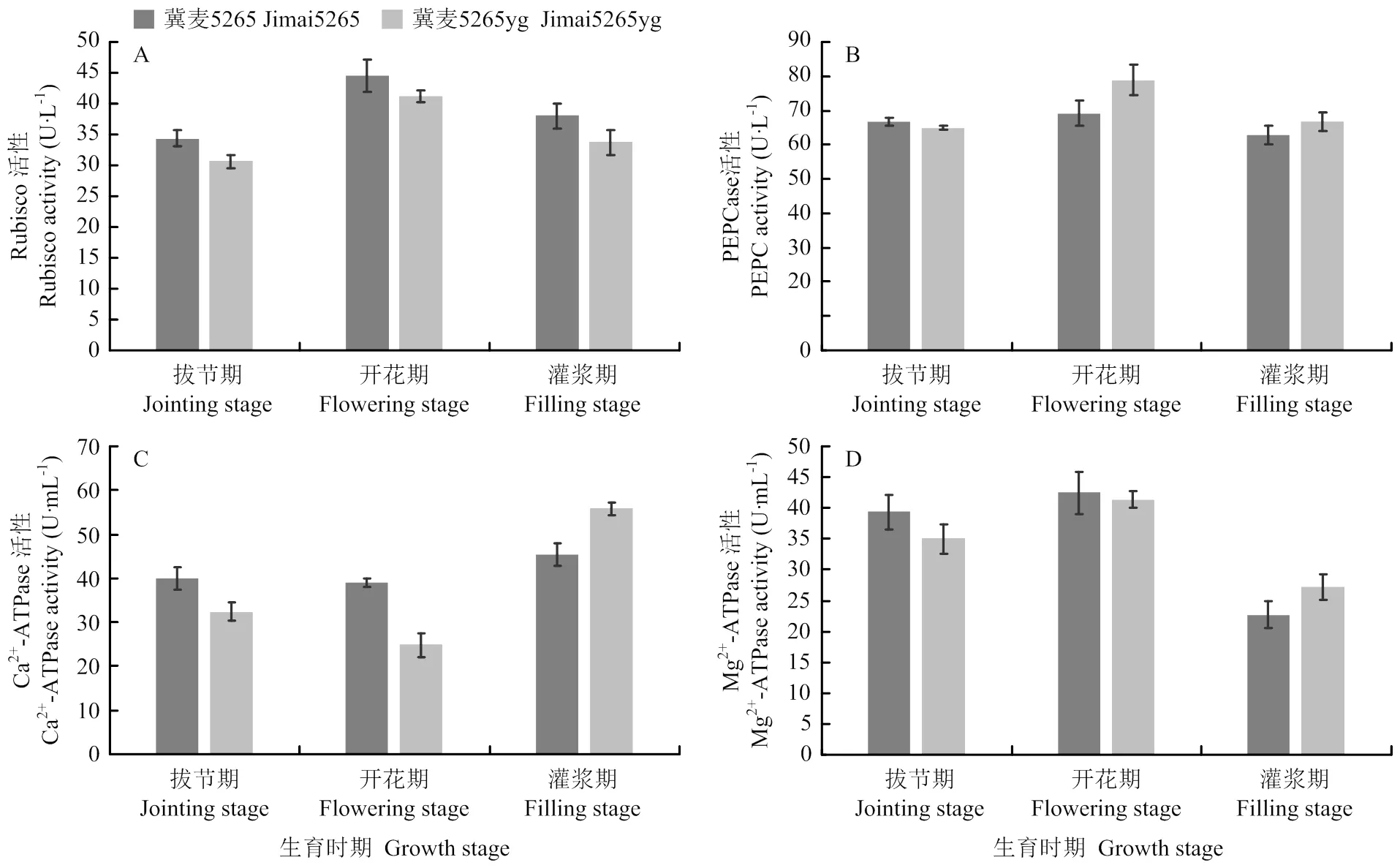
图6 冀麦5265与冀麦5265yg旗叶光合碳同化关键酶的活性变化
2.8 遮阴和外源喷施抗坏血酸(AsA)及二硫苏糖醇(DTT)处理对冀麦5265和冀麦5265yg光合特性的影响
为了研究光照强度对黄绿叶色的影响,抽穗期对突变体冀麦5265yg和野生型冀麦5265在大田条件下进行遮阴处理,发现突变体叶片颜色逐渐复绿,但始终比野生型略浅,说明遮阴能促进其叶绿素含量补偿性合成。由于遮阴处理后,光照强度只有正常光照的1/3,因而严重影响了植物叶片的光合性能,净光合速率和气孔导度均显著下降。野生型光合速率和气孔导度比对照叶片降低20.72%和26.31%,突变体净光合率和气孔导度比对照叶片分别降低39.48%和66.67%,说明突变体比野生型对光强变化更敏感,属于光诱导转绿型突变体。经过10 d处理后恢复生长3 d重新测定光合参数发现,突变体和野生型的光合性能明显升高,且突变体的净光合速率高于野生型,说明突变体的修复和代偿功能较好(表6)。
叶黄素循环在作物光合作用和叶片光合色素稳定中发挥重要作用,依赖于叶黄素循环的热耗散是防御光抑制的主要途径。为了研究野生型和突变体叶黄素循环是否存在差异,对小麦旗叶进行外源喷施抗坏血酸(AsA)和二硫苏糖醇(DTT)处理,测量其光合指标。AsA作为叶黄素循环组分紫黄质脱环氧化酶(VDE)的辅酶,对保护光合机构及光合调节过程起重要作用,保持较高含量的AsA能更高效地清除过量的活性氧(ROS)。AsA处理后野生型叶片的净光合速率和气孔导度比对照增加了23.63%和50.00%。但突变体叶片净光合速率和气孔导度却比对照减少了43.50%和50.00%。外源AsA处理改善了野生型的光合特性,但抑制了突变体的光合性能,推测可能与突变体叶片内本身含有较高的AsA有关。DTT作为VDE专一性抑制剂,抑制花药黄质和玉米黄质组分的生成。外施DTT使叶黄素循环受阻,光合作用下降,气孔导度降低,不能正常耗散光能,光合器官受损伤。野生型的光合速率和气孔导度比对照叶片降低了45.30%和15.79%,突变体的净光合率和气孔导度比对照叶片分别降低了31.68%和27.27%。结果表明,野生型与突变体叶黄素循环效率存在差异,具体原因还需进一步分析。
3 讨论
3.1 叶色突变对冀麦5265yg的光合性能的影响
气孔特性的改善对小麦光合作用的提高有重要作用,突变体冀麦5265yg的气孔导度显著高于野生型,开花期突变体的气孔导度比野生型高73.68%。气孔导度和胞间CO2浓度的增加,为突变体同化作用提供更高的CO2供应。虽然突变体因叶绿素含量降低限制了其对光能的捕获,但电子传递速率(ETR)显著提高,自然光下的高电子流速有利于RuBP的再生(核酮糖-1,5-二磷酸羧化酶催化CO2生成核酮糖-1,5-二磷酸),从而保证了较高的光合速率。研究表明,将C4作物玉米的PEPCase基因超表达转入水稻后,转基因水稻的气孔导度增加,光合速率提高[37]。欧立军[38]研究发现,水稻叶色突变体标810S中PEPC活性显著高于野生型,其净光合速率和气孔导度均显著升高。与前人研究结果一致,本试验突变体冀麦5265yg的C4光合酶PEPC也具有较高的活性,说明突变体能更有效地固定CO2,推测C4途径的光合关键酶PEPC活性的升高可能是冀麦5265yg维持较高净光合速率的原因之一。
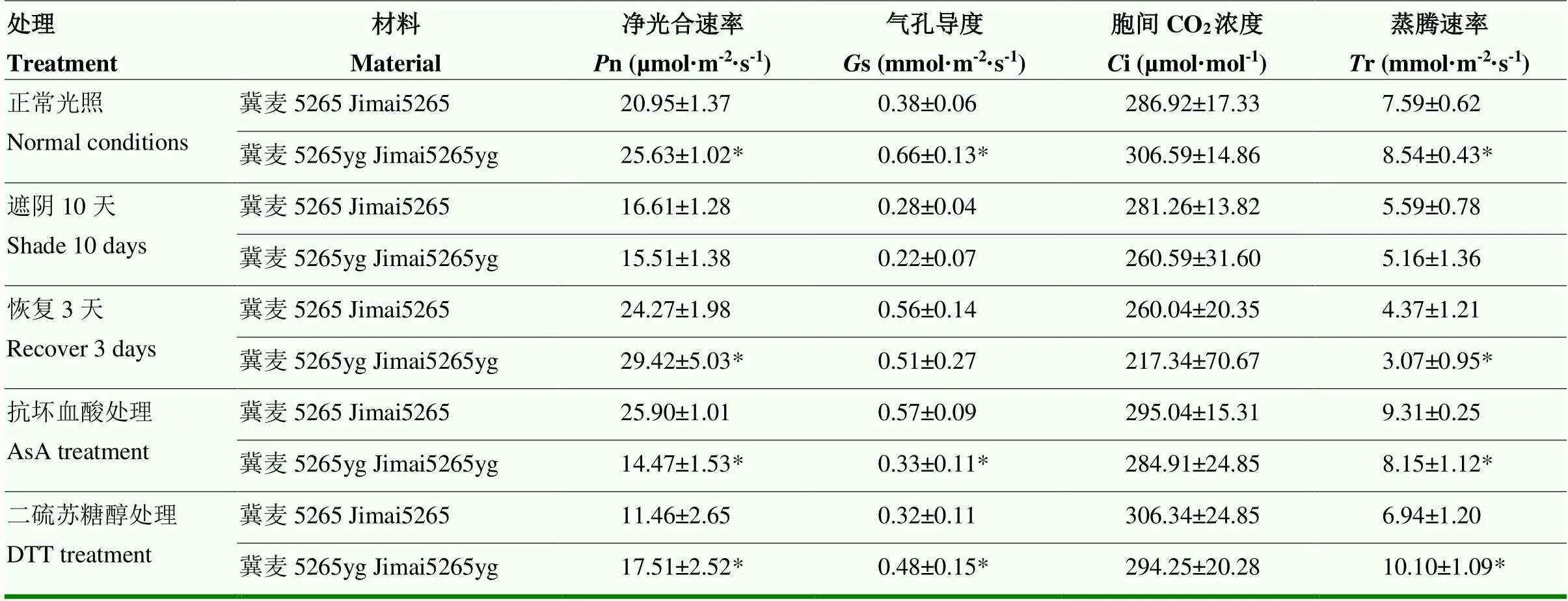
表6 不同处理条件下冀麦5265和冀麦5265yg叶片光合指标的比较
3.2 叶色突变对冀麦5265yg热耗散(NPQ)的影响
植物光合作用吸收的光能一部分转化成化学能贮存在体内,还有相当一部分通过各种形式耗散掉。当光能被PSⅡ吸收后,一部分用于光合作用(ΦPSII),另外一部分以荧光的形式重发射(ΦNQ)和非辐射能量耗散(ΦNPQ)。非光化学猝灭(NPQ)表示以热能途径耗散的光能,即热耗散。热耗散作为植物叶片重要的光防御机制,在维持光能转化平衡中起着重要作用[39]。热耗散的诱导受跨类囊体膜ΔpH、叶黄素循环和PsbS蛋白的调控[40]。热耗散发生在光合系统Ⅱ(PSⅡ)的捕光色素复合体(LHCⅡ)内,叶黄素循环的激活和LHCⅡ蛋白的聚集导致了光系统II中NPQ的形成,中间经历跨类囊体膜质子梯度ΔpH形成、LHCⅡ质子化、紫黄素去环氧化、LHCⅡ构象转换等过程。本研究显示,突变体冀麦5265yg在吸收能的分配上与野生型不同。突变体冀麦5265yg的v/M和ΦPSⅡ均显著高于野生型,qP和NPQ分别是野生型的106%和52%,说明突变体 PSⅡ反应中心将更多光能的分配用于光合作用,推测较低的热耗散是突变体光合速率提高的另一个重要原因。此外,NPQ依赖于叶黄素的循环,利用紫黄质去环化酶的辅助因子AsA和紫黄质脱环氧化酶抑制剂DTT处理突变体和野生型叶片的结果进一步表明,二者叶黄素循环效率存在差异,推测这可能是NPQ降低的直接因素。
3.3 叶色突变对冀麦5265yg抗氧化性能力的影响
在正常条件下,植物细胞的多种代谢反应均会产生活性氧(ROS),低浓度的ROS作为重要信号分子,参与生物与非生物逆境胁迫信号的传导。在逆境条件下,植物细胞会产生大量活性氧,高浓度的ROS对植物产生毒害,造成包括DNA、蛋白和膜脂等结构分子的氧化伤害,导致MDA含量的增多。为有效防止ROS的氧化损伤,植物形成了一套有效的活性氧防御机制,以维持其体内活性氧的浓度范围。可溶性糖和可溶性蛋白的含量有利于植物在逆境下维持细胞的结构功能正常运行。因此SOD活性、POD活性、MDA含量、可溶性糖和可溶性蛋白含量成为植物细胞氧化损伤、植物抗性强弱的生理生化指标。本研究显示,突变体SOD和CAT活性在各个阶段都高于野生型,突变体的MDA含量较野生型明显下降,可溶性糖含量和可溶性蛋白明显升高。说明突变体抗氧化酶SOD、CAT和POD通过清除氧自由基降低了氧化损伤,叶片细胞膜受到的伤害程度低,其抗逆性比野生型强。
4 结论
对冀麦5265yg的光合生理研究发现,突变体叶绿素含量低于野生型,净光合速率、气孔导度、蒸腾速率高于野生型;PSⅡ的最大光能转化效率和实际光化学效率高于野生型,非光化学淬灭系数低于野生型;SOD和CAT活性在各个阶段都高于野生型,可溶性糖和可溶性蛋白含量明显升高,MDA含量明显下降;光合关键酶Rubisco的活性显著低于野生型,而PEPC酶活性则显著高于野生型。结果表明,冀麦5265yg的净光合速率提高,抗氧化能力增强,为一种新型小麦黄绿叶突变体。该研究结果为小麦叶色突变体的光合生理特性研究提供了理论基础,为小麦高光效育种的应用提供参考依据。此外,突变体冀麦 5265yg 黄绿叶特性可作为标记性状,直接应用于杂交小麦育种。
[1] CHEN H, CHENG Z J, MA X D, WU H, LIU Y L, ZHOU K N, CHEN Y L, MA W W, BI J C, ZHANG X, GUO X P, WANG J L, LEI C L, WU F Q, LIN Q B, LIU Y Q, LIU L L, JIANG L. A knockdown mutation of yellow-green leaf2 blocks chlorophyll biosynthesis in rice. Plant Cell Reports, 2013, 32(12): 1855-1867.
[2] 曹莉. 一个新的小麦黄化突变体研究[D]. 杨凌: 西北农林科技大学, 2007.
Cao L. Characterization and genetics of a novel aurea mutant in wheat [D]. Yangling: Northwest A&F University, 2007. (in Chinese)
[3] 李宁. 小麦黄绿突变体特性研究与遗传分析[D]. 北京: 中国农业科学院, 2012.
LI N. Characterization and genetic analysis of yellow green mutants in wheat[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012. (in Chinese)
[4] 李倩倩. 小麦白斑突变体I30的特征特性及遗传分析[D]. 杨凌: 西北农林科技大学, 2017.
LI Q Q. Characteristic and genetic analysis of common wheat mutant I30 with white stripe pattern[D]. Yangling: Northwest A&F University, 2017. (in Chinese)
[5] CAMPBELL B W, MANI D, CURTIN S J, SLATTERY R A, MICHNO J M, ORT D R, SCHAUS P J, PALMER R G, ORF J H, STUPAR R M. Identical substitutions in magnesium chelatase paralogs result in chlorophyll-deficient soybean mutants. G3 Genes Genomes Genetics, 2015, 5(1): 123-131.
[6] 孔可可, 许孟歌, 刘美凤, 孔杰杰, 盖钧镒, 赵团结. 大豆芽黄新突变体 vl-1的光合特性与基因定位.核农学报, 2018, 32 (5): 840-847.
KONG K K, XU M G, LIU M F, KONG J J, GAI J Y, ZHAO T J. Identification and fine mapping of a new virescent mutant vl-1 in soybean. Journal of Nuclear Agricultural Sciences, 2018, 32(5): 840-847. (in Chinese)
[7] 钟世宜, 魏海忠, 王红红, 赵燕, 徐长利, 韩帅, 刘保申. 玉米白化突变体As-81647的鉴定及基因定位.山东农业科学, 2013, 45(10): 12-15.
ZHONG S Y, WEI H Z, WANG H H, ZHAO Y, XU C L, HAN S, LIU B S. Identification and molecular mapping of an albino mutant gene As-81647 in maize (L.). Shandong Agricultural Sciences, 2013, 45(10): 12-15. (in Chinese)
[8] 江媛, 何筠, 范术丽, 俞嘉宁, 宋美珍. 棉花芽黄突变体10个叶绿体蛋白编码基因RNA编辑位点的测定及分析.棉花学报, 2011, 23(1): 3-9.
JIANG Y, HE Y, FAN S L, YU J N, SONG M Z. The identification and analysis of RNA editing sites of 10 chloroplast protein-coding genes from virescent mutant of. Cotton Science, 2011, 23(1): 3-9. (in Chinese)
[9] 宋明梅, 范术丽, 庞朝友, 魏恒玲, 喻树迅, 宋美珍. 棉花芽黄材料主要光合特性和农艺性状的研究.棉花学报, 2015, 26(6): 531-538.
SONG M M, FAN S L, PANG C Y, WEI H L, YU S X, SONG M Z. Research on the main photosynthetic characteristics and agronomic traits in virescent cotton materials. Cotton Science, 2015, 26(6): 531-538. (in Chinese)
[10] 孙捷音, 张年辉, 杜林方. 油菜叶绿素b减少突变体 Cr3529叶绿素生物合成的研究. 西北植物学报, 2007, 27(10): 1962-1966.
SUN J Y, ZHANG N H, DU L F. Chlorophyll biosynthesis in a chlorophyll b deficient oilseed rape mutant cr3529. Acta Botanica Boreali-Occidentalia Sinica, 2007, 27(10): 1962-1966. (in Chinese)
[11] 殷家明, 杨惠娟, 彭柳, 黄梦珠, 唐章林, 李加纳, 李超. 甘蓝型油菜叶色黄化突变体Bn.el1研究.西南大学学报(自然科学版), 2016, 38(5):1-6.
YIN J M, YANG H J, PENG L, HUANG M Z, TANG Z L, LI J N, LI C. Preliminary research on the etiolation leaf-color mutant Bn. el1 in. Journal of Southwest University (Natural Science Edition), 2016, 38(5): 1-6. (in Chinese)
[12] BRAUMANN I, STEIN N, HANSSO M. Reduced chlorophyll biosynthesis in heterozygous barley magnesium chelatase mutants. Plant Physiology and Biochemistry, 2014, 78: 10-14.
[13] QIN D D, DONG J, XU F C, GUO G G, GE S T, XU Q, XU Y X, LI M F. Characterization and fine mapping of a novel barley stage green-revertible albino gene () by bulked segregant analysis based on SSR assay and specific length amplified fragment sequencing. BMC Genomics, 2015, 16(1): 838.
[14] AWAN M A, KONZAK C, RUTGER J. Mutagenic effects of sodium azide in rice. Crop Science, 1980, 20: 663-668.
[15] SHI J Q, WANG Y Q, GUO S, MA L, WANG Z W, ZHU X Y, SANG X C, LING Y H, WANG N, ZHAO F M, HE G H. Molecular mapping and candidate gene analysis of a yellow-green leaf 6 () mutant in rice. Crop Science, 2015, 45(4): S41.
[16] MA X Z, SUN X Q, LI C M, HUAN R, SUN C H, WANG Y, XIAO F L, WANG Q, CHEN P R, MA F R, ZHANG K, WANG P R, DENG X J. Map-based cloning and characterization of the novel yellow-green leaf genein rice (). Plant Physiology and Biochemistry, 2017, 111: 1-9.
[17] MEI J S, LI F F, LIU X R, HU G C, FU Y P, LIU W Z. Newly identifiedgene localized in chloroplasts affects leaf color in rice. Plant Science, 2017, 256: 39-45.
[18] GUAN H Y, XU X B, HE C M, LIU C X, LIU Q, DONG R, LIU T S, WANG L M. Fine mapping and candidate gene analysis of the leaf-color genein maize. PLoS ONE, 2016, 11(4): e0153962.
[19] SHI D Y, ZHENG X, LI L, LIN W H, XIE W J, YANG J P, CHEN S J, JIN W W. Chlorophyll deficiency in the maize elongated mesocotyl2 mutant is caused by a defective heme oxygenase and delaying grana stacking. PLoS ONE, 2013, 8(11): e80107.
[20] XING A Q, WILLIAMS M E, BOURETT T M, HU W N, HOU Z L, MEELEY R B, JAQUETH J, DAM T, LI B L. A pair of homoeologgenes underlies a virescent yellow-like mutant and its modifier in maize. Plant Journal, 2014, 79(2): 192-205.
[21] LI W, TANG S, ZHANG S, SHAN J G, TANG C J, CHEN Q N, JIA G Q, HAN Y H, ZHI H, DIAO X M. Gene mapping and functional analysis of the novel leaf color genein foxtail millet ((L.) P. Beauv). Physiologia Plantarum, 2015, 157(1): 24-37.
[22] WANG Y K, HE Y J, YANG M, HE J B, XU P, SHAO M Q, CHU P, GUAN R Z. Fine mapping of a dominant gene conferring chlorophyll- deficiency in. Scientific Reports, 2016, 6: 31419.
[23] WANG R, YANG F, ZHANG X Q, WU D X, TAN C, WESTCOTT S, BROUGHTON S, LI C D, ZHANG W Y, XU Y H. Characterization of a thermo-inducible chlorophyll-deficient mutant in barley. Plant Science, 2017, 14(8): 1936.
[24] 秦丹丹, 李梅芳, 许甫超, 徐晴, 葛双桃, 董静.大麦黄绿叶色突变体ygl的农艺性状及其调控基因初步定位. 麦类作物学报, 2019, 39(6): 653-658.
QIN D D, LI M F, XU B C, XU Q, GE S T, DONG J. Analysis of agronomic characters and preliminary mapping of regulatory genes of a barley yellow-green leaf mutant ygl. Journal of Triticeae Crops, 2019, 39(6): 653-658. (in Chinese)
[25] ZHANG L L, LIU C, AN X Y, WU H Y, FENG Y, WANG H, SUN D J. Identification and genetic mapping of a novel incompletely dominant yellow leaf color gene,, on chromosome 2BS in wheat. Euphytica, 2017, 213(7): 141.
[26] WU H Y, SHI N R, AN X Y, LIU C, FU H F, CAO L, FENG Y, SUN D J, ZHANG L L. Candidate genes for yellow leaf color in common wheat (L.) and major related metabolic pathways according to transcriptome profiling. International Journal of Molecular Sciences, 2018, 19(6): 1594.
[27] 茹广欣, 刘小囡, 朱秀红, 张龙冲, 王鋆瑞, 周霜晴.泡桐黄化突变体生理特性分析.南京林业大学学报(自然科学版), 2017, 41(4): 181-185.
RU G X, LIU X N, ZHU X H, ZHANG L C, WANG J R, ZHOU S Q. Physiological characteristic analysis of etiolation mutant in. Journal of Nanjing Forestry University (Natural Sciences Edition), 2017, 41(4): 181-185. (in Chinese)
[28] 杨小苗, 吴新亮, 刘玉凤, 李天来, 齐明芳.一个番茄EMS叶色黄化突变体的叶绿素含量及光合作用. 应用生态学报, 2018, 29(6): 1983-1989.
YANG X M, WU X L, LIU Y F, LI T L, QI M F. Analysis of chlorophyll and photosynthesis of a tomato chlorophyll-deficient mutant induced by EMS. Chinese Journal of Applied Ecology, 2018, 29(6): 1983-1989. (in Chinese)
[29] 胡亮亮, 赵子瑶, 张海强, 陈菲帆, 张朝文, 戎福喜, 陈鹏, 李玉红. 一个新的黄瓜叶色突变体的光合特性分析.西北农业学报, 2018, 27(11): 1622-1628.
HU L L, ZHAO Z Y, ZHANG H Q, CHEN F F, ZHANG C W, WU F X, CHEN P, LI Y H. Photosyntheic characteristic analysis of new leaf color mutant in cucumber. Acta Agriculturae Boreali-Occidentalia Sinica, 2018, 27(11): 1622-1628. (in Chinese)
[30] 曹莉, 王辉, 孙道杰, 冯毅, 李学军, 闵东红. 小麦黄化突变体类囊体蛋白组分及叶绿素的合成特性.麦类作物学报, 2010, 30(4): 638-643.
CAO L, WANG H, SUN D J, FENG Y, LI X J, MIN D H. Chloroplast thylakoid protein composition and characteristics of chlorophyll biosynthesis in a novel aurea mutant of wheat. Journal of Triticeae Crops, 2010, 30(4): 638-643. (in Chinese)
[31] DAI X B, XU X M, LU W. Photoinhibition characterristics of a low chlorophyll b mutant of high yield rice. Photosynthetica, 2003, 41: 57-60.
[32] ZHOU X S, SHEN S Q, WU D X, SUN J W, SHU Q Y. Introduction of a xantha mutation for testing and increasing varietal purity in hybrid rice. Field Crops Research, 2006, 96(1): 71-79.
[33] DENG X J, ZHANG H Q, WANG Y, HE F, LIU J L, XIAO X, SHU Z F, LI W, WANG G H, WANG G L. Mapped clone and functional analysis of leaf-color genein a rice hybrid (L. ssp. indica). PLoS ONE, 2014, 9(6): e99564.
[34] LICHTENTHALER H K. Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes. Methods Enzymol, 1987, 148: 350-382.
[35] 叶子飘. 光合作用对光和CO2响应模型的研究进展. 植物生态学报, 2010, 34(6): 727-740
YE Z P. A review on modeling of responses of photosynthesis to light and CO2. Chinese Journal of Plant Ecology, 2010, 34(6): 727-740. (in Chinese)
[36] 黄小辉, 冯大兰, 刘芸, 朱恒星, 陈道静, 耿养会. 模拟石漠化异质生境中桑树的生长和叶绿素荧光特性. 北京林业大学学报, 2016, 38(10): 50-58.
HUANG X H, FENG D L, LIU Y, ZHU H X, CHEN D J, GENG Y H. Growth and chlorophyll fluorescence characteristics of mulberry trees in simulated environment of heterogeneous habitats of a rocky desertification area. Journal of Beijing Forestry University, 2016, 38(10): 50-58. (in Chinese)
[37] AGARIE S, MIURA A, SUMIKURA R, TSUKAMOTO S, NOSE A, ARIMA S, MATAUOKA M, MIYAO-TOKUTOMI M. Overexpression of C4PEPC caused O-2-insensitive photosynthesis in transgenic rice plants. Plant Science, 2002, 162(2): 257-265.
[38] 欧立军. 水稻叶色突变体的高光合特性. 作物学报, 2011, 37(10): 1860-1867.
OU L J. High photosynthetic efficiency of leaf colour mutant of rice (L.). Acta Agronomica Sinica, 2011, 37(10): 1860-1867. (in Chinese)
[39] RUBAN A V. Identification of a mechanism of photoprotective energy dissipation in higher plants. Nature, 2007, 450(7169): 575-578.
[40] MASAHIRO I, NOZOMU U, FUMIHIKO S, TSUYOSHI E. Physiological functions of PsbS-dependent and PsbS-independent NPQ under naturally fluctuating light conditions. Plant and Cell Physiology, 2014, 55(7): 1286-1295.
Photosynthetic and Physiological Characteristics Analysis of Yellow- Green Leaf Mutant in Wheat of Jimai5265yg
ZHENG Wei, SHI Zheng, LONG Mei, LIAO YunCheng
College of Agriculture, Northwest A & F University, Yangling 712100, Shaanxi
【】Leaf color mutants are ideal materials for studying chlorophyll synthesis, chloroplast development and photosynthesis.In order to clarify the regulation mechanism of photosynthesis and lay a foundation for the further utilization of wheat yellow-green leaf mutants, the photosynthetic physiological characteristics of wheat were studied.【】The wild type jimai5265 and the mutantJimai5265yg were used as test materials. The phenotype of leaf color was observed, the chlorophyll content and enzyme activity were measured by spectrophotometer and kit, respectively. The photosynthetic characteristics and chlorophyll fluorescence parameters were determined by the Li-6400 portable photosynthetic apparatus and PAM100 modulated chlorophyll fluorometer.】The results of phenotypic observation and pigment content showed that the leaves ofthe mutant were yellow-green at seedling stage, and gradually changed to light green after heading stage. Leaf color of the mutant was partly recovered by shading treatment, but it was slightly lighter than the wild type, which indicated that it belonged to the mutants of light induced to promote greening. The content of chlorophyll a and b in the mutant leaves was significantly reduced, and the ratio of chlorophyll a to chlorophyll b was increased, indicating that Jimai5265yg was a typicalchlorophyll deficient mutant. The light response curves and CO2response curve displayed that surface sight-seeing quantum efficiency (AQY), light saturation point (LSP), maximum net photosynthetic rate (n-max), light compensation point (LCP), dark respiration rate (Rd), spindle efficiency (CE) and saturated CO2concentration (Isat) of the mutant was significantly higher than the wild type, indicating thatthe mutant had quite stable the photosynthetic mechanism and higher photosynthetic rate under the strong light; The photosynthetic gas exchange parameters and chlorophyll fluorescence kinetic parameters indicated that the net photosynthetic rate (n), transpiration rate (r), stomatal conductance (s), photochemical quantum efficiency (v/m), the actual photochemical efficiency (Φ PSII) and light chemical quenching coefficient (qP) of the mutant were significantly higher compared with the wild type, which showed that Jimai5265yg had the ability of strong light energy conversion and CO2fixation; The content of malondialdehyde (MDA) in mutant was decreased significantly, while the activity of superoxide dismutase (SOD) and catalase (CAT), as well as the content of soluble sugar and soluble protein, were significantly increased. The results indicated that the antioxidant enzyme system could reduce oxidative damage by scavenging oxygen free radicals. The damage degree of cell membrane in the mutant leaf was reduced and its stress resistance was enhanced. The activity of ribulose 1, 5-bisphosphate carboxylase/oxygenase (Rubisco) in mutant was significantly lower, while the activity of the phosphoenolpyruvate carboxylase (PEPC) was significantly higher than that of the wild type. It was speculated that the increased activity of the C4pathway photozyme PEPC might be the key factor for the higher net photosynthetic rate of the mutant. Post-flowering shading and exogenous spraying of Ascorbic acid and dithiothreitol DTT showed that the mutants were more sensitive to change of light intensity, and the content of AsA in leaves and the efficiency of xanthophyl cycle were higher.【】Improvement of stomatal conductance, decrease of heat dissipation and increase of C4pathway photozyme activity in yellow green leaf mutant Jimai5265yg were the main reasons for the increase of photosynthetic rate. These results laid the foundation for the molecular regulation of high photosynthesis properties of wheat leaf mutants.
wheat; yellow-green leafmutant; photosynthetic gas exchange parameters; chlorophyll fluorescence parameter; enzyme activity

10.3864/j.issn.0578-1752.2021.21.005
2021-01-25;
2021-04-09
国家自然科学基金面上项目(31871618)、国家重点研发计划(2017YFD0100706)、陕西省重点研发计划(2021NY-082)
郑伟,E-mail:zwalhx@126.com。通信作者廖允成,E-mail:yunchengliao@163.com
(责任编辑 杨鑫浩)

