养殖容器颜色对拟穴青蟹幼蟹生长、应激和甲壳颜色的影响
马湘成,张高立,高广春,王春琳,母昌考,叶央芳,史 策*
(1.宁波大学 海洋学院,浙江 宁波 315832;2.浙江海洋高效健康养殖协同创新中心,浙江 宁波 315832;3.杭州横士蟹客海洋科技有限公司,浙江 杭州 311106;4.浙大城市学院 信息与电气工程学院,浙江 杭州 310015)
青蟹(Scyllaspp.)味道鲜美、营养价值高,深受东亚和东南亚地区消费者喜爱[1-2].作为我国主要海水养殖蟹类,其2019 年养殖产量为16.06×104t,占海水蟹类养殖总产量的54.7%[3],其中,90%以上产量来自拟穴青蟹(Scylla paramamosain)[4].我国拟穴青蟹生产以池塘养殖为主,但该方式相对粗放,亩产较低,制约了拟穴青蟹养殖业的进一步发展[5].工厂化苗种培育为解决上述问题提供了新的途径,但目前拟穴青蟹的工厂化中间培育技术还不成熟,苗种存活率仍然较低[6].
现有研究表明,适宜的养殖容器颜色可显著促进养殖对象的生长和存活,提高饵料利用率[7-9],而不适宜的养殖容器颜色则会导致养殖动物生长迟缓,甚至死亡[10].如Eslamloo 等[11]发现金鱼(Carassius auratus)在白色背景中生长最快,其血浆的皮质醇水平显著低于红色背景.对于甲壳动物,红螯螯虾(Cherax quadricarinatus)在黑色养殖容器中的体重增长量、特定生长率和存活率最高[12].而锯缘青蟹(S.serrata)幼体在暗色的养殖容器中发育更快、存活率更高[13].
此外,养殖容器颜色还会影响养殖动物的体色[14].Kasagi 等[15]发现虹鳟(Oncorhynchus mykiss)的体色亮度与养殖容器颜色的亮度呈正相关.而黑色容器能显著促进红樱桃虾(Neocaridina davidi)的着色,明显提高其虾青素含量[16].养殖动物体色是影响消费者选购的重要依据之一[17],因此有必要对养殖动物的体色进行调控.
尽管已经发现养殖容器会影响水生生物的生长和体色,但目前其对拟穴青蟹的影响尚未见报道.为此本研究通过46 d的拟穴青蟹幼蟹养殖,评估了6 种养殖容器颜色(红、黄、绿、蓝、黑和白)对幼蟹生长、应激和甲壳颜色的影响,以期获得拟穴青蟹幼蟹较适宜的养殖容器颜色,为拟穴青蟹幼蟹的工厂化中间培育提供技术支持.
1 材料与方法
1.1 实验设计和养殖条件
实验于2020 年7 月至8 月间进行,实验动物选用宁波市某水产养殖企业的拟穴青蟹C1 期幼蟹.实验前,在塑料桶内对幼蟹暂养3 d,选择健康、活力好且附肢完整的幼蟹(0.02±0.01)g 装于有0.5 L海水的聚乙烯养殖容器(内尺寸:130 mm×83 mm× 48 mm)中.养殖容器的颜色分别为红、黄、绿、蓝、黑和白共6 种,容器颜色的Lab 值见表1.每个养殖容器内放1 只幼蟹,每个颜色处理设置30个重复.养殖用海水经过滤和紫外消毒后,盐度22‰~ 25‰,温度21~27 ℃,溶解氧>6 mg·L-1,pH 值8.0~ 8.5,总氨氮(TAN)<0.5 mg·L-1.每个养殖盒中都放置1个透明聚乙烯网片供幼蟹栖息和躲避(规格:10 目,30 mm×20 mm).实验使用的自然光周期约为14 h光照和10 h黑暗,光强范围为2 000~3000 lx.于每天7:00 和18:00 各投喂一次商品饲料(浙江天邦公司,40.0%蛋白质、6.0%脂肪、5.0%纤维、12.0%水分、18.0%灰分、1.2%总磷、2.0%赖氨酸),每次投喂后2 h 收集残留饵料,记录幼蟹前5 周的日摄食量.每天6:00 换水,换水率为100%,记录幼蟹的蜕壳和存活情况.于养殖结束后称量幼蟹体重并拍照,然后液氮冻存备用.
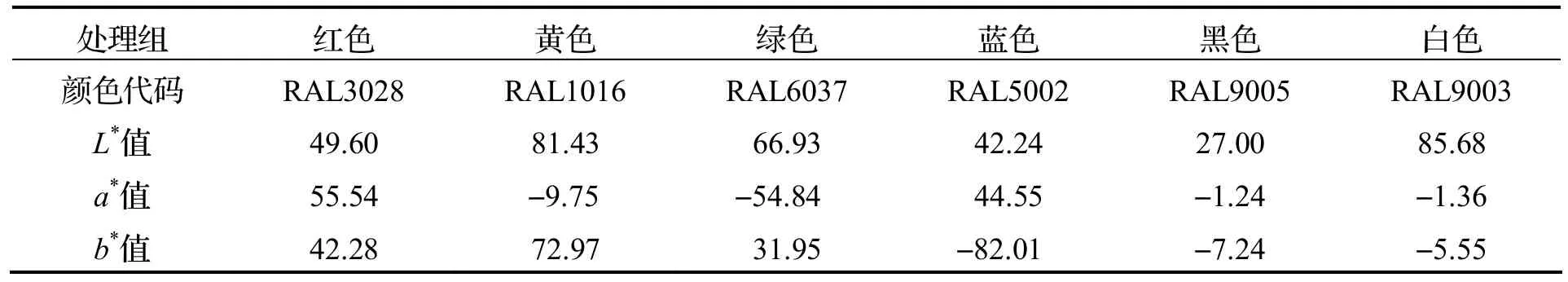
表1 不同养殖容器颜色的L*值、a*值和b*值
1.2 存活和生长数据测定
存活率、生物量、特定生长率(SGR)、增重率(WG)、重量变异系数(CV)、蜕壳频率和摄食量的计算公式如下:

式中:C为存活率,%;Oi为实验开始时活蟹数量,只;Of为实验结束时活蟹的数量,只;S为生物量,g·m-3;Wt为蟹的总质量,g;V为养殖容器容积,m3;ZSGR为特定生长率,%·d-1;Wf为蟹最终质量,g;Wi为蟹的初始质量,g;t为实验持续时间,d;GWG为增重率,%;VCV为质量变异系数;U为末重标准差;k为蜕壳频率;K为存活青蟹总蜕壳次数;L为存活青蟹数量;n为摄食量,g·(只·d)-1;N为存活青蟹的总摄食量,g;E为存活青蟹数量,只;D为总天数,d.
1.3 代谢物和酶活测定
皮质醇、葡萄糖(Glu)、乳酸(LD)、丙二醛(MDA)和样本的蛋白含量以及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙酮酸激酶(PK)和己糖激酶(HK)活力测定均采用南京建成生物工程研究所的试剂盒,方法参照试剂盒的操作说明.
SOD的活力定义:每毫克组织蛋白在1 mL 反应液中SOD 抑制率达50%时所对应的SOD 量为1个SOD 活力单位(U).
CAT的活力定义:每毫克组织蛋白每秒分解1 μmol H2O2的量为1个活力单位(U).
PK的活力定义:在37 ℃、pH 7.6 条件下,每克组织蛋白每分钟分解1 μmol 磷酸烯醇式丙酮酸(PEP)为丙酮酸为1个酶活力单位.
HK的活力定义:在37 ℃、pH 7.6 条件下,每毫克组织蛋白每分钟生成1 mmol 还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)定义为1个酶活力单位.
1.4 体色测定
采用数码相机(iphone,MWF12CH/A)拍摄幼蟹,并选择Pantone 国际标准色卡作为拍摄比色卡,以便于校准.拍摄时固定数码相机的相关拍摄系数,在相同的布光条件下(6 000 lx,全光谱)拍摄样本.利用Lab 颜色模型分析青蟹幼蟹的体色变化,该模型由3个要素组成,1个要素是亮度(L*),取值范围是0~100.另2个要素是颜色通道a*和b*,a*代表从绿色到红色的分量,取值范围是-128~127;b*代表从蓝色到黄色的分量,取值范围是-128~127.利用Adobe Photoshop CS9 软件分析图像Lab值.
1.5 数据分析
使用SPSS 22.0 软件对各处理组进行单因素方差分析(one-way ANOVA)和Duncan 多重比较,数据均用“平均值±标准误差”表示.使用线性回归评估养殖容器颜色和甲壳颜色之间的关系.决定系数(R2)表示线性回归的适用性,当R2的值接近1时,表明可以更好地拟合回归模型.
2 结果与分析
2.1 养殖容器颜色对拟穴青蟹幼蟹生长的影响
在不同的养殖容器颜色下,拟穴青蟹幼蟹的生长产生了一定的差异(图1),主要表现在黄色组与蓝色组幼蟹的增重率、特定生长率和生物量都显著高于其他组(P<0.05).黄色组、黑色组和蓝色组幼蟹的存活率均大于63%,高于白色组(50%)、绿色组(50%)和红色组(36.67%)(图1(a)).黑色组幼蟹CV 最低,其次是黄色组、蓝色组、绿色组和白色组的CV 在10~17 之间,红色组的CV 最高,达到32.25(图1(c)).此外,黄色组的幼蟹摄食量显著高于其他组(P<0.01,图1(d)).

图1 不同颜色养殖容器中拟穴青蟹幼蟹的存活率(a)、末重(b)、质量变异系数(c)、摄食量(d)、增重率(e)、特定生长率(f)、蜕壳频率(g)和生物量(h)
2.2 养殖容器颜色对拟穴青蟹幼蟹应激的影响
养殖容器颜色对拟穴青蟹幼蟹产生了一定的应激影响.红色组和黄色组幼蟹的皮质醇水平显著高于蓝色组、黑色组和白色组,而黑色组幼蟹的皮质醇水平最低,显著低于红色组、黄色组和绿色组(P<0.01).尽管养殖容器颜色对幼蟹的葡萄糖含量无显著影响(P>0.05),但蓝色组的幼蟹HK 活力最低,显著低于红色组、绿色组和白色组(P<0.05).养殖容器颜色对幼蟹的PK 活力也无显著影响(P>0.05),但红色背景导致幼蟹的乳酸水平显著高于其他组(P<0.01).
养殖容器颜色还导致幼蟹膜脂过氧化和抗氧化酶活性变化.如红色组的幼蟹MDA 含量显著高于其他处理组,而蓝色和黑色组的幼蟹MDA 含量显著低于其他处理组(P<0.01).黄色组幼蟹SOD活力显著高于其他组(P<0.01).而黄色和蓝色组的幼蟹CAT 活力显著高于红色组、黑色组和白色组(P<0.05).
2.3 养殖容器颜色对拟穴青蟹幼蟹甲壳颜色影响
养殖容器颜色显著影响了拟穴青蟹幼蟹的甲壳颜色(图2 和表2).黑色组幼蟹甲壳亮度L*值(17.73±1.88)最低(P<0.01),其次是红色组和蓝色组,最高的是绿色组、黄色组和白色组.黑色组和红色组幼蟹甲壳颜色的a*值显著高于其他组,其次是蓝色组和白色组,绿色组和黄色组的最低.此外,黄色组幼蟹甲壳颜色的b*值最高,其次是绿色组、白色组、蓝色组和红色组,黑色组的b*值最低.

表2 不同颜色养殖容器中拟穴青蟹幼蟹甲壳颜色的Lab 值

图2 不同颜色养殖容器中拟穴青蟹幼蟹
由图3 可知,L*、a*、b*的R2分别为0.801 7、0.412 8 和0.191 3,说明拟穴青蟹幼蟹甲壳颜色的L*、a*、b*值的80.17%、41.28%和19.13%由养殖容器的颜色决定.幼蟹甲壳颜色与容器颜色的L*值的拟合程度更好.

图3 实验容器颜色的L*、a*、b*值(x)与拟穴青蟹甲壳颜色的L*、a*、b*值(y)的关系
3 讨论
养殖动物的存活和生长会受到养殖容器颜色的影响[9,18-20].同样,拟穴青蟹幼蟹的存活和生长也受到养殖容器颜色的直接影响.拟穴青蟹幼蟹在红色养殖容器中存活率最低,在蓝色和黄色容器中特定生长率和生物量最高,这与黄颡鱼(Pelt-eobagrus fulvidraco)幼鱼的研究结果相似[21].但与本研究不同的是,锯缘青蟹幼体在深色背景中(黑色、暗红及暗绿)存活率较高[13],而罗氏沼虾(Macrobrachium rosenbergii)幼体在红色和绿色容器中的存活率较高[22],这可能暗示着养殖动物对养殖容器颜色的偏好具有物种特异性[23].
当外界环境或机体内环境发生剧烈变化时,生物体内往往产生活性氧(ROS),过量的ROS 对生物体造成氧化损伤[24].蟹类作为无脊椎动物,含非特异性免疫系统,特别是抗氧化系统在抵抗外界环境胁迫方面发挥着重要作用[25].正常状态下,生物体内抗氧化系统可清除代谢产生的多余ROS[26].抗氧化系统主要由SOD 和CAT 组成,其中SOD能够清除机体内部的活性氧自由基,将其转化为H2O2,随后CAT 将H2O2完全分解成水和氧气,保护生物体的组织和细胞不受氧化损伤[27].本研究中,红色组幼蟹的SOD 和CAT 活力较低,而脂质过氧化产物MDA的含量较高,说明红色背景会使拟穴青蟹幼蟹产生较多氧化应激.与红色相反,黄色对幼蟹氧化应激是适中的,没有造成严重氧化损伤,这可能是由于黄色组青蟹通过增加摄食获得更多能量,以抵抗应激胁迫.Kang等[28]发现明亮的养殖容器颜色可促进牙鲆(Paralichthys olivaceus)血液中的皮质醇适当增加,反而增强了其摄食和生长.
皮质醇是生物体在应激状态下产生的一种类激素,其水平的高低反映了生物体的应激状态[29].抵抗胁迫是一个能量消耗的过程,需要消耗大量的储能物质以补充机体消耗的能量[30].皮质醇可促进糖原分解,增加葡萄糖含量,并通过糖异生作用促进脂质的利用,进而为机体供能[31].本研究中,红色组和黄色组青蟹的皮质醇水平较高,表明其受到了更多胁迫.另一方面,在有氧呼吸产生的能量不足以满足代谢需求时,生物体会通过糖酵解途径来补充能量[32].糖酵解途径是葡萄糖在无氧条件下分解供能的过程,其中丙酮酸激酶(PK)和己糖激酶(HK)是糖酵解途径两个关键限速酶[33].本研究中红色养殖容器激活了幼蟹的HK 活性,并导致了乳酸积累,表明幼蟹已借助糖酵解途径产能以抵抗应激.
甲壳动物的体色不但能够作为个体间的通讯讯号,也可以作为生理变化的表观表现[34],是基因和环境因素共同作用的结果[35].本研究表明拟穴青蟹幼蟹的甲壳颜色逐渐趋近于养殖容器颜色.如黄色组幼蟹甲壳颜色的+b*值趋近黄色,红色组幼蟹甲壳颜色的+a*值趋近红色,而绿色组幼蟹甲壳颜色的-a*值趋近绿色,黑色组幼蟹甲壳颜色的L*值亮度最低.斑节对虾(Penaeus monodon)也表现出类似的颜色适应反应,在暴露于深色或浅色的基质时会扩张或收缩其皮下的着色结构[36].该过程往往是通过富集虾青素完成[37],而虾青素的富集需要消耗能量,从而负面影响了甲壳动物的生长[38],鱼类中也存在类似现象[39].保护色无疑有助于动物躲避敌害,但过于强烈的体色变化可能意味着更多的能量消耗.前人研究发现,黑色容器中养殖的三疣梭子蟹(Portunus trituberculatus)幼蟹体色变化剧烈,导致了最低的生长速度[40].因此,本研究中黑色组幼蟹强烈的体色变化可能影响了其存活和生长.
4 结语
尽管拟穴青蟹幼蟹在黄色和蓝色的容器都具有较好的生长表现,但黄色组具有较高的皮质醇和无氧呼吸水平,可能表明其消耗了更多能量以抵抗应激.因此,蓝色容器更适合拟穴青蟹幼蟹的中间培育.

