盐胁迫对黄蜀葵不同部位总黄酮含量及抗氧化活性的影响
宁亚茹 韩民利 张晓东 李俊萍 王秀萍


摘要:为探明盐胁迫对黄蜀葵不同部位总黄酮的含量及抗氧化活性影响。采用自吸水梯度鉴定法,研究了梯度盐胁迫下黄蜀葵花、根、茎、叶的总黄酮含量及其抗氧化活性的变化规律,为黄蜀葵功能产品的开发,盐碱地区黄蜀葵产业的发展提供理论依据。结果表明,黄蜀葵不同部位总黄酮含量为花>叶>茎>根。当盐胁迫浓度为2 g/L时,黄蜀葵花中总黄酮含量最高,达5.018%,其中,金丝桃苷含量较高,达1.416%;而金丝桃苷在黄蜀葵茎、叶和根中含量利用HPLC法已经无法检出。当盐胁迫浓度在2 g/L时,黄蜀葵花的抗氧化活性最高,T-AOC 能力为3.4 U/mL、·OH 清除率为98.45%、DPPH自由基清除率84.65%。说明2~3 g/L低盐胁迫有利于黄蜀葵总黄酮的积累,可提高其抗氧化活性。
关键词:黄蜀葵;盐胁迫;HPLC;总黄酮;抗氧化活性
中图分类号:S567.21+9.01;R284 文献标志码: A文章编号:1002-1302(2021)19-0196-05
黄蜀葵[Abelmoschus manihot (L)],又名金芙蓉、菜芙蓉、野芙蓉,为锦葵科秋葵属1年生草本植物,且其为一种传统的药食两用植物,干燥花冠入药,具有清利湿热、消炎解毒等功效[1-3]。黄蜀葵含有黄酮类化合物、不饱和脂肪酸及锌、硒、铁人体必需微量元素等,黄酮类化合物是最主要的功能成分,且含量超出目前黄酮生产常用原料银杏、大豆等数十倍[4-5],具有抗氧化、调节机体免疫力、降低心血管疾病发生、抗炎、抗菌、降血糖等生理活性,黄蜀葵功能产品市场开发潜力很大[6-7]。
滨海盐渍土是盐渍化土壤的一种类型,土壤NaCl含量高,通透性差,严重影响作物的生长[8]。筛选耐盐经济植物,既有经济价值并改善当地生态环境的植被),改良滨海盐土,是盐碱地改良利用最经济有效的方法。黄蜀葵对土壤要求不严,抗旱耐涝,适应性较强,具有一定的耐盐能力[9],可在我国滨海地区大面积种植,不仅能够高效利用盐土资源,改良修复盐碱地,还可发展盐碱地功能植物开发利用产业,为滨海盐碱区农业种植结构调整、农民增收、农业增效探索新途径,为滨海现代农业发展提供新模式。
不同植物耐盐机理不同,盐胁迫对同一植物的不同部位功能成分影响也不同。对于耐盐性较强的植物而言,低浓度盐脅迫在一定程度上会促进植物的生长;高浓度盐胁迫下,植物虽株高降低、茎粗减小、干质量降低,但其依旧存活[10]。陈云香等比较了黄蜀葵花、茎、叶多糖与黄酮含量[11];李佳慧研究了黄蜀葵不同药用部位总黄酮、多糖、金丝桃苷的含量[12];饶琳莉等研究了盐胁迫对黄蜀葵花中金丝桃苷累积影响[13];张晓倩等研究了盐胁迫对黄蜀葵生长及金丝桃苷含量的影响[14]。国内外关于盐胁迫对黄蜀葵不同部位功能成分及活性影响均无相关文献报道,为探明盐胁迫对黄蜀葵根、茎、叶、花不同部位的功能性成分总黄酮含量及抗氧化活性的影响,本研究采用自吸水设施梯度耐盐鉴定法,人为设置7种盐胁迫浓度进行试验,为黄蜀葵功能产品研发及其在滨海盐碱区的合理开发利用提供技术支撑。
1材料与方法
1.1试验材料
供试材料黄蜀葵品种由河北清竹农业科技有限公司提供,在河北省农林科学院滨海农业研究所综合试验基地塑料遮雨棚内进行试验。在开花期160 d时,均匀采集不同盐胁迫处理的黄蜀葵鲜花、叶、茎、根样品同步进行试验。
1.2试剂和仪器设备
氯化钠,天津市致远化学试剂有限公司;无水乙醇(分析纯),天津市恒兴化学试剂制造;磷酸,甲醇(色谱纯),Fisher Chemical;芸香苷标准品、金丝桃苷标准品,德国Dr.Ehrenstorfer有限公司;DPPH,麦克林试剂公司;纯净水,屈臣氏纯净水。
FA2004B电子天平,上海精科天美科学仪器有限公司;DDS-11A数显电导率仪,上海雷磁·创益仪器仪表有限公司;KQ2200V型超声波清洗器,昆山市超声仪器有限公司;旋转蒸发仪Heidolph,天津西纳国际贸易有限公司;高效液相色谱仪,美国Agilent公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3试验设计
黄蜀葵采用盆栽法,过筛后将土壤改为草炭 ∶蛭石 ∶珍珠岩=2 ∶1 ∶1[15]。采用NaCl配成的1、2、3、5、7、9 g/L等6个浓度盐水,以清水为对照(CK),每盆3株黄蜀葵,每个浓度设6盆进行平行试验。
1.4样品处理
准确称取1 g干粉,加入80%乙醇25 mL,超声处理1 h,超声波功率100 W,水浴温度50 ℃。冷却至室温后,4 000 r/min离心25 min,取上清液,旋转蒸发至干,用少量甲醇(色谱纯)溶解,备用[16]。
1.5总黄酮含量的测定
HPLC条件:色谱柱为钻石1代C18 (4.6 mm ×250 mm,5 μm);流动相A(体积分数0.02%磷酸水溶液) ∶B(甲醇)= 50 ∶50;检测波长350 nm;柱温30 ℃;流速1 mL/min;进样量10 μL[16]。流动相均经真空泵过滤除杂和超声清洗机脱气。
以芸香苷和金丝桃苷标准品制作标准曲线,以峰面积定量,对不同盐胁迫浓度胁迫的黄蜀葵不同部位提取液进行HPLC分析,利用标准曲线法,通过回归方程对黄蜀葵花、茎、叶和根中的总黄酮进行定量分析。
1.6黄蜀葵抗氧化活性
1.6.1总抗氧化能力(T-AOC)测定体外总抗氧化能力采用Fe3+还原试剂盒测定,酸性环境下,黄蜀葵提取液中的抗氧化物质能使Fe3+还原成Fe2+[17]。利用分光光度计在593 nm波长处测定其吸光度,每个样品平行测定3次。按照试剂盒计算黄蜀葵提取液总抗氧化能力(T-AOC)(U/mg)。
1.6.2黄蜀葵清除DPPH自由基能力的测定分别取不同盐胁迫处理的提取液1.0 mL,置于10 mL离心管中,加入3.0 mL的0.004% DPPH溶液,室温避光反应30 min,无水乙醇為空白,于517 nm波长处测定吸光度。按公式计算DPPH自由基清除率[18]。试验重复3次。
式中:D0为1.0 mL蒸馏水+3.0 mL DPPH溶液的吸光度;Ds为1.0 mL样品溶液+3.0 mL DPPH溶液的吸光度;Dc为1.0 mL样品溶液+3.0 mL无水乙醇的吸光度。
1.6.3黄蜀葵清除羟基能力的测定清除· OH能力的测定采用Fenton反应试剂盒法,Fe2+与H2O2通过Fenton反应产生· OH,将邻二氮菲-Fe2+水溶液中Fe2+氧化成Fe3+,从而导致536 nm下吸光度下降,样品536 nm吸光度下降速率的抑制程度反映其清除自由基的能力。取不同盐胁迫处理的黄蜀葵提取物进行试验,以蒸馏水调0,在536 nm波长处测定吸光度。每个样品平行测3次。按照试剂盒计算抑制·OH清除率(%)。
1.7数据分析
试验数据用“x±s”表示,采用t检验方法,P<0.05表示差异显著,P<0.01表示差异极显著,数据处理采用SPSS软件。
2结果与分析
2.1标准曲线建立及黄蜀葵活性成分液相图谱
选取6个不同梯度浓度的标准品溶液进行液相分析,以峰面积为纵坐标、浓度为横坐标制作标准曲线。芸香苷标准曲线回归方程为y=15 467x+1.9,决定系数(r2)0.999 6,有效测试浓度在0.0~0.1 mg/mL范围内;金丝桃苷标准曲线回归方程为y=27 146x-19.905,决定系数0.999 6,有效测试浓度在0~0.1 mg/mL范围内。通过高效液相色谱法测得标准品芸香苷保留时间为8.885 min;标准品金丝桃苷保留时间为9.732 min。图1为黄蜀葵提取液HPLC色谱图,以黄蜀葵花为例。
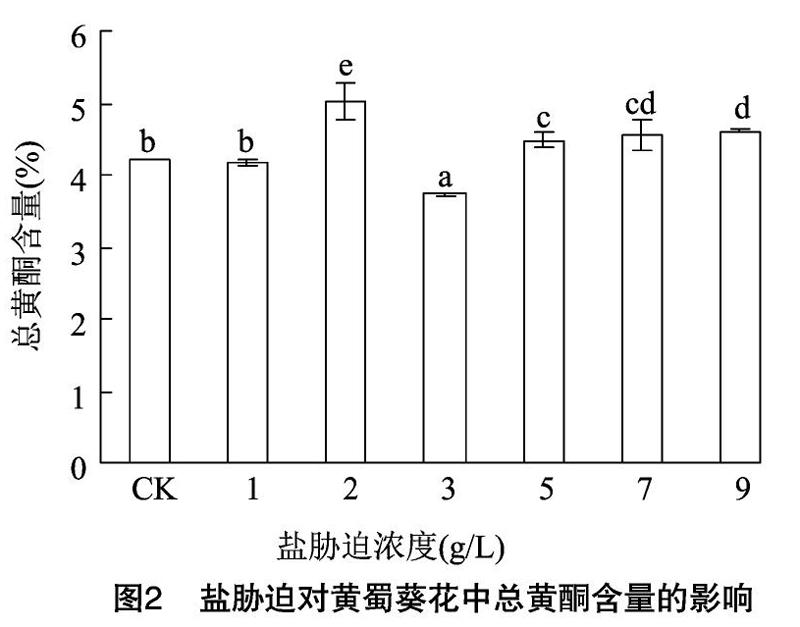
2.2盐胁迫对黄蜀葵花中总黄酮含量的影响
黄蜀葵花中总黄酮含量是黄蜀葵全株总黄酮含量最高的部位,其中金丝桃苷是黄蜀葵中主要活性成分之一。1 g/L盐胁迫下,花中总黄酮的含量与CK相比无显著性差异;而当盐胁迫浓度≥2 g/L时,与CK相比表现出显著性差异。低浓度的盐胁迫可以使黄蜀葵花中总黄酮含量增加,在盐胁迫浓度为2 g/L时,黄蜀葵花中总黄酮含量最高,为5.018%,但在盐胁迫浓度为3 g/L(3.724%)时,与CK(4209%)相比呈下降趋势,出现此结果的原因有待进一步研究。
由图2和图3可知,随着盐胁迫浓度增加,金丝桃苷含量的变化规律与黄酮含量变化基本一致。在盐胁迫浓度为2 g/L时,黄蜀葵花中金丝桃苷含量达到最大值1.416%,与CK相比有显著的提高,3、7 g/L盐胁迫处理与对CK相比差异不显著。说明一定浓度的盐胁迫有利于黄蜀葵花中金丝桃苷的积累。
2.3盐胁迫对黄蜀葵叶中总黄酮含量的影响
由图4可知,随着盐胁迫浓度增加,黄蜀葵叶中总黄酮含量呈先上升后下降的趋势,且不同浓度的盐胁迫对黄蜀葵叶中的总黄酮含量影响显著。当盐胁迫浓度为2 g/L时,黄蜀葵叶中总黄酮含量达到最高值,为0.778%,与CK(0.6%)相比增加297%;当盐胁迫浓度>3 g/L时,黄蜀葵叶中总黄酮含量开始呈下降趋势,在盐胁迫浓度为9g/L
(0.416%)时,黄蜀葵叶中总黄酮含量比CK显著低30.7%。综上所述,轻度盐胁迫可以提高黄蜀葵叶中总黄酮含量。在黄蜀葵叶、茎、根中总黄酮含量较低,金丝桃苷的含量利用HPLC法已经无法检出。
2.4盐胁迫对黄蜀葵茎中总黄酮含量的影响
由图5可知,黄蜀葵茎中总黄酮含量变化趋势不明显。1、3 g/L盐胁迫下茎中的总黄酮含量与CK相比无显著性差异,盐胁迫浓度为7 g/L(0171%)对黄蜀葵茎中总黄酮含量提高幅度相对较大,与CK(0.160%)相比提高了6.9%;与CK相比,最大下降量是盐胁迫浓度为9 g/L(0.139%)时,下降了13.1%。
2.5盐胁迫对黄蜀葵根中总黄酮含量的影响
由图6可知,随着盐胁迫浓度增加,黄蜀葵根中总黄酮含量呈先下降后上升的趋势,与盐胁迫对黄蜀葵其他部位的影响不同,呈现出低盐胁迫降低总黄酮含量、高盐胁迫提高总黄酮含量的现象。在刚开始胁迫时,黄蜀葵根中总黄酮含量有下降的趋势,在盐胁迫浓度为3 g/L(0.028%)时,黄蜀葵根中总黄酮含量与CK(0.040%)相比下降了30%;当盐胁迫浓度>3 g/L时,黄蜀葵根中总黄酮含量呈上升趋势,其中盐胁迫浓度为7 g/L(0.048%)时,黄蜀葵根中总黄酮含量比CK增加20%。
2.6盐胁迫对黄蜀葵花抗氧化活性的影响
黄蜀葵花中的黄酮含量明显高于其他部位,因此,利用黄蜀葵花提取液进行抗氧化试验,探究盐胁迫对黄蜀葵抗氧化活性的影响。由表1可知,在T-AOC能力、·OH清除率、DPPH自由基清除率3个抗氧化活性指标中,黄蜀葵花醇提液的·OH清除能力最高,而T-AOC能力相对较弱。当盐胁迫浓度在2 g/L时,黄蜀葵花的抗氧化活性最高,T-AOC能力为3.4 U/mL、·OH清除率为98.45%、DPPH自由基清除率8465%;当盐胁迫浓度在3 g/L时,抗氧化活性均最低,此结果与“2.2”节中总黄酮含量相一致,其他盐胁迫浓度组抗氧化活性无明显规律,且与总黄酮含量无明显对应关系。盐浓度在0~2 g/L 时,随盐胁迫浓度升高·OH清除率升高;但盐胁迫浓度超过3 g/L时,·OH清除率下降。说明高于2 g/L的盐胁迫浓度会使·OH清除降低。
3结论与讨论
3.1不同部位总黄酮含量
目前,关于黄蜀葵不同部位总黄酮含量的相关文献极少,本试验比较了黄蜀葵不同部位总黄酮含量。结果显示,各部位醇提液中總黄酮含量为花>叶>茎>根,其原因可能是不同生长时期不同部位对总黄酮积累不同。黄蜀葵花中总黄酮含量最高,有极高的利用价值,而黄蜀葵根、茎、叶中总黄酮含量较少,但其可能含有较高的其他功能性物质,如陈云香等研究发现黄蜀葵叶和茎中多糖含量很高[11]。黄蜀葵全身是宝,不同部位所含功能物质不同,因此黄蜀葵功能产品的开发更有针对性。
3.2不同部位金丝桃苷含量
在盐胁迫浓度为2 g/L下,黄蜀葵花中金丝桃苷达到最大值,与CK相比有显著差异;而金丝桃苷在茎和叶中未检出,表明金丝桃苷是黄蜀葵花中总黄酮的指标性成分。张晓倩等研究发现,当NaCl 浓度为0.3%时,金丝桃苷含量达到最大,当NaCl浓度为0.7%时,金丝桃苷含量急剧下降,说明盐胁迫并不能无限制诱导植物次生代谢产物增加,当盐浓度超过一定临界值,植株遭受盐害,将影响代谢产物的合成[15]。综上,低浓度盐胁迫有利于金丝桃苷的积累。
综上所述,黄蜀葵不同部位总黄酮含量为花>叶>茎>根。当盐胁迫浓度为2 g/L时,黄蜀葵黄酮含量与金丝桃苷含量均达到最大值,而黄蜀葵根茎叶中金丝桃苷无检出。黄蜀葵的抗氧化活性规律与总黄酮含量规律大致相同,均在盐胁迫浓度为2 g/L时达到最高,说明在黄蜀葵花中总黄酮起到主要的抗氧化活性。
参考文献:
[1]邱金玲,刘朋,熊维政,等. 金花葵中金丝桃苷的含量测定[J]. 中医学报,2015,30(12):1793-1795.
[2]陈海龙,江帆,丁小艳,等. 响应面分析法优化黄蜀葵花中金丝桃苷、异槲皮苷、槲皮素提取工艺的研究[J]. 食品工业科技,2015,36(24):216-221.
[3]Middleton E,Kandaswami C,Theoharides T C. The effects of plant flavonoids on mammalian cells:Implications for inflammation,heart disease,and cancer[J]. Pharmacological Reviews,2000,52(4):673-751.
[4]温锐,谢国勇,李旭森,等. 黄蜀葵化学成分与药理活性研究进展[J]. 中国野生植物资源,2015,34(2):37-44.
[5]白云,朱瑞超,李晋,等. 超高效液相色谱法同时测定金花葵花中5个黄酮类成分含量[J]. 天津中医药,2018,35(2):147-150.
[6]杨秀松. 金花葵粗黄酮提取物的免疫调节作用研究[J]. 中国药师,2013,16(9):1307-1311.
[7]黎望,孙培冬,季晓彤,等. 黄蜀葵花黄酮抗氧化性及对DNA氧化损伤的保护作用[J]. 食品与机械,2017,33(2):135-139.
[8]刘雅辉,杨雅华,王秀萍,等. 黄秋葵苗期的盐胁迫反应及耐盐阈值分析[J]. 安徽农业科学,2017,45(23):27-28,57.
[9]曹利华,苗明三. 金花葵的现代研究与综合利用分析[J]. 中医学报,2016,31(12):1966-1968.
[10]Deinlein U,Stephan A B,Horie T,et al. Plant salt-tolerance mechanisms[J]. Trends in Plant Science,2014,19(6):371-379.
[11]陈云香,刘国钢,陈敏,等. 黄蜀葵花、茎、叶多糖与黄酮含量比较[J]. 安徽科技学院学报,2016,30(6):50-53.
[12]李佳慧. 药用植物黄蜀葵不同部位的对比研究[D]. 北京:北京中医药大学,2016.
[13]饶琳莉,王雅男,王康才,等. 盐胁迫对黄蜀葵花中金丝桃苷累积影响研究[J]. 现代中药研究与实践,2012,26(3):3-4.
[14]张晓倩,王康才,王雅男,等. 盐胁迫对黄蜀葵生长及金丝桃苷含量的影响[J]. 安徽农业大学学报,2013,40(3):510-513.
[15]宁亚茹,晋梦珂,王秀萍,等. 盐胁迫对黄蜀葵生长生理指标及总黄酮含量的影响[J]. 中药材,2020,43(2):259-263.
[16]刘松,董晓芳,佟建明.多糖提取和抗氧化活性评价方法的研究现状和进展[J]. 动物营养学报,2016,28(11):3391-3399.
[17]王婷婷,王少康,黄桂玲,等. 菊花主要活性成分含量及其抗氧化活性测定[J]. 食品科学,2013,34(15):95-99.
基金项目:河北省科学技术研究与发展计划(编号:16226304D);河北省唐山市科技创新团队培养计划(编号:18130206B)。
作者简介:宁亚茹(1992—),女,河北唐山人,硕士,助理研究员,主要从事耐盐植物研究。E-mail:2501116178@qq.com。
通信作者:王秀萍,研究员,主要从事耐盐植物高效利用研究。E-mail:bhswxp@163.com。

