2018-2019年广州市区某院甲型流感流行病学特点和检测方法比较
黄佳斯 何宇婷 陈瑶 余学高 黄浩 陈培松★
流行性感冒是指因流行性感冒病毒引起的急性呼吸道传染疾病,多为自限性,但在儿童、老年及机体免疫功能低下人群,可出现病毒性肺炎等并发症,重者可因急性呼吸窘迫综合征(Acute Respiratory Distress Syndrome,ARDS)合并多脏器功能衰竭致死。根据流感病毒核蛋白和基质蛋白抗原性的差异,可分为甲、乙、丙三型。世界卫生组织(World Health Organization,WHO)发布的最新全球流感流行病学报告[1],2018-2019年冬春季,季节性流感以甲型流感为主。鉴于甲型流感病毒临床症状的非特异性,迫切需要一种准确的早期诊断方法,以期能早期应用抗病毒药物,及时控制病情。本研究分析了12 506 例流感样病例(influenza⁃like illness,ILI),探讨甲型流感病毒的流行特征、流行结构和分布规律,并以Real⁃time RT⁃PCR 为参考方法,分析胶体金标记免疫层析法对甲型流感病毒的检测性能。
1 资料与方法
1.1 一般资料
收集2018年8月1日至2019年7月31日医院门诊、急诊患者和住院患者中的ILI 为研究对象,ILI 的定义采取《全国流感检测方案(2017年版)》[2]标准,即发热(体温≥38℃),伴咳嗽或咽痛之一者。排除标准:①非首诊患者;②已服用神经氨酸酶抑制剂类抗流感药物者;③已有明确实验证据可以解释发热原因者;④不明原因发热患者;⑤不愿或不能配合进一步检查者。共纳入12 506 例患者,其中男性6 379 例,女性6 127 例,年龄平均(27.37±23.20)岁;其中161 例使用Real⁃time RT⁃PCR 法检测,11654 例使用胶体金标记免疫层析法检测,691 例同时使用了Real⁃time RT⁃PCR 法和胶体金标记免疫层析法检测。本研究经医院医学伦理委员会批准,全部入组患者均签署知情同意书。
1.2 仪器与试剂
Clearview 甲型/乙型流感病毒抗原检测试剂盒(艾博生物医药(杭州)公司);核酸提取或纯化试剂(中山大学达安基因股份有限公司,批号:DA0623)、全自动核酸提取仪(中山大学达安基因股份有限公司,型号:Smart32);甲型流感病毒核酸检测试剂盒(中山大学达安基因股份有限公司);实时荧光定量PCR 分析仪(美国ABI 公司,型号:Prism7500)
1.3 方法
1.3.1 标本采集与处理
用两支灭菌棉棒同时采取疑似患者鼻拭子样本,放入无菌容器后于常温保存,并在30 min 内送至检验科检测。标本采集与运输均按照《广东省流感监测方案(2017年版)》[3]实施。
1.3.2 核酸提取
在上述灭菌棉棒中加入1 mL 无菌生理盐水,震荡混匀后取300 mL 于核酸提取试剂盒,严格按照说明书操作。
1.3.3 反转录实时(Real⁃time RT)PCR 检测流感病毒
严格按照说明书,利用一步法Real⁃time RT⁃PCR检测技术,以甲型流感病毒基因编码区的高度保守区为靶区域,设计特异性引物及荧光探针,实现对样本中流感病毒的定性检测。
1.3.4 胶体金标记免疫层析法操作流程
向软管内滴6 滴Flu 裂解液,将一支棉棒放入后,旋转挤压棉头,拔出棉棒,将检测试剂条放入软管,15 min 后医务人员根据条带判读结果。
1.3.5 诊断标准
诊断标准采用《流行性感冒诊疗方案(2018年版)》[4]确诊病例标准。流感临床症状加上Real⁃time RT⁃PCR 和/或胶体金标记免疫层析法检测阳性诊断为甲型流感病例。当两种方法结果不一致时,以Real⁃time RT⁃PCR 法检测为参考方法。
1.4 统计分析
采用SPSS 19.0 统计软件包进行数据描述和统计分析,计数资料以n或(%)表示,2×2 四格表总结检测结果,并计算敏感度、特异度、阳性预测值、阴性预测值、符合率及尤登指数,一致性用Kappa 检验。如敏感度、特异度和符合率超过90%,则认为研究方法与参考方法结果一致;一致性Kappa 值≥0.75 表示研究方法与参考方法高度一致,Kappa≥0.40 为基本一致,Kappa<0.40 为不一致。P<0.05 为差异有统计学意义。
2 结果
2.1 ILI 及甲型流感的时间分布
2018年8月到2019年7月甲型流感检出主要集中在1月到7月,最高峰在1月,其他月份以散发为主。见表1。
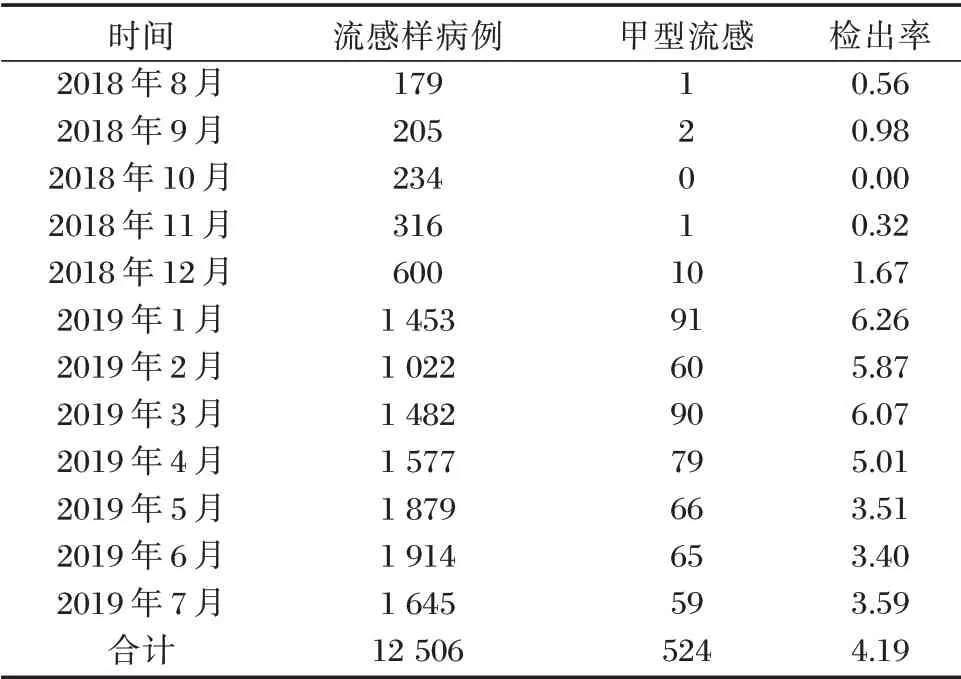
表1 甲型流感检出率月份分布[n(%)]Table 1 The t detection rates of influenza A in months[n(%)]
2.2 不同性别ILI 甲型流感检出率
不同性别ILI 甲型流感检出率比较,差异无统计学意义(χ2=0.606,P>0.05)。见表2。

表2 不同性别ILI 甲型流感检出率比较[n(%)]Table 2 Comparison of detection rates of ILI influenza A between male and female patients[n(%)]
2.3 不同年龄组ILI 甲型流感检出率
按照年龄的大小,病例共分为5 个年龄组,7~17 岁组阳性率最高,为6.19%,年龄≥66 岁组(4.54%)次之,不同年龄组间ILI甲型流感阳性率比较,差异有统计学意义(χ2=31.260,P<0.05)。见表3。

表3 不同年龄组ILI 甲型流感检出率比较Table 3 Comparison of detection rates of ILI influenza A among different age groups
2.4 Real⁃time RT⁃PCR 和胶体金标记免疫层析法结果比较
在691 例同时使用两种方法检测的ILI 鼻咽拭子标本中,胶体金标记免疫层析法检测出甲型流感病毒17 例,见表4。Real⁃time RT⁃PCR 法105份阳性标本中,胶体金标记免疫层析法阳性11例,另94 例未检出;而586 例阴性标本中,6 例胶体金标记免疫层析法阳性。与参考方法比较,胶体金标记免疫层析法灵敏度为10.48%,特异度为98.98%,阳性预测值为64.71%,阴性预测值为86.05%,符合率85.53%,尤登指数0.095,一致性Kappa 值0.144(P<0.01)。

表4 Real⁃time RT⁃PCR 和胶体金标记免疫层析法结果Table 4 Results of Real⁃time RT⁃PCR and colloidal gold labeled immunochromatography
3 讨论
甲型流感病毒经常发生抗原转变及抗原漂移,其抗原变异直接导致人类特异性免疫失效,是引起流感世界大流行爆发的主要病原体。因此,甲型流感病毒的研究受到更多关注。该院地处广州市区,2018年8月至2019年7月甲型流感病毒病原学监测结果显示,甲型流感检出主要集中在1月到7月,最高峰在1月,其他月份以散发为主。这与北方地区多为冬季流行有所不同[5],与广东省流感的流行特征相似[6⁃8],且与我国南方地区春夏季是流感病毒主要流行季节的观点一致[9]。由于该段时间广州的天气特征是温暖多雨,多雾霾,温差大,空气流动性差,与国内其他省市流行特征不尽相同[10]。但本研究中甲型流感病毒的总体阳性率及峰值阳性率均低于世界卫生组织(WHO)发布的2018~2019年冬春季全球流感流行病学报告数据[1],可能与采用的检测方法有关。
大量研究显示,年龄影响流感病毒的表达,但研究结果尚无统一定论。蒋小仙[11]等发现25~60岁青壮年为流感高发人群,而葛爱华[12]等则报道5~14 岁学龄儿童ILI 阳性率更高。本调查发现,7~17 岁的学龄儿童及少年阳性率最高,其次是66 岁以上老年人及3~6 岁学龄前儿童。分析原因可能是学龄前儿童、学龄儿童和青少年以集体活动为主,且自我保护意识较差,一旦有流行病毒入侵,容易造成大规模的流行;而66 岁以上老年人的阳性率仅次于7~17 岁的学龄儿童及青少年,与国内外的研究报道[13⁃14]不一致,这可能与该院接收的该年龄阶段人群多为急重症患者,常合并基础疾病,免疫力低下有关。
目前用于流感病毒的检测技术主要包括病毒分离培养法、免疫荧光技术、酶联免疫测定法、胶体金免疫层析技术、RT⁃PCR 等。本研究采用临床上常用的两种方法(Real⁃time RT⁃PCR 法和胶体金标记免疫层析法)进行甲型流感病毒检测,与参考方法比较,胶体金标记免疫层析法的灵敏度较差,漏检率高达89.52%,且存在假阳性,两种方法一致性较差。可能原因有:①流感病毒HA 和NA 核酸序列易发生变异引起病毒抗原漂移,导致抗原检测出现假阴性结果[15];②胶体金标记免疫层析法的灵敏度受拭子材料、患者年龄、病程、呼吸道标本种类等影响[16];③由于采样或实验操作导致的污染可造成胶体金标记免疫层析法假阳性;④试剂与不同的病毒、细菌及真菌可能存在交叉反应影响导致假阳性;⑤胶体金标记免疫层析法结果判读具有一定的主观性。Real⁃time RT⁃PCR 检测技术通过保守区域序列扩增来实现病毒核酸的检测,具有灵敏度高、特异性强、自动化程度高和大大降低污染可能性等特点,优于胶体金标记免疫层析法[15]。但Real⁃time RT⁃PCR 检测成本较高,操作人员需要特殊培训上岗,且出于节约人力物力成本等考虑,临床实验室经常批量检测,周转时间延长,导致Real⁃time RT⁃PCR 法较难常规开展。本研究中12 506 例ILI 使用Real⁃time RT⁃PCR 法检测的比例仅为6.81%,这也正是导致总体阳性率偏低的原因。因此,临床上应该更加重视病原学的核酸检测,同时不断提高包括胶体金法在内的快速法的灵敏度和特异度,为临床流感患者提供更加快速、准确的诊断辅助措施。

