猪骨氮掺杂碳量子点制备及其用于检测Co2+
钱 玟, 何 利, 潘无双, 陈燕华, 王 惠, 刘书亮, 陈姝娟, 刘爱平
(四川农业大学 食品学院, 四川 雅安 625014)
1 引 言
碳量子点(Carbon quantum dots,CQDs)是一类尺寸小于10 nm具有量子限域效应的新型零维碳纳米材料[1],与金属纳米团簇和传统的半导体量子点相比,CQDs由于其低毒性[2]、更宽的光致发光光谱[3]和高荧光稳定性[4]等独特优势,可被开发为具有快速、选择性好、灵敏度高和低毒性等出色性能的荧光探针,用于选择性检测有害物质。
钴离子(Co2+)是人体必需的一种微量元素,可以促使红细胞和部分酶的合成、调节酶和辅助因子的催化活性,在人体中起着重要作用[5-6]。但是,过量摄入Co2+会使机体内的自由基过剩,导致细胞凋亡,进而使人患上哮喘、鼻炎、过敏性皮炎和心肌病等疾病[7]。考虑到Co2+引起的毒性作用,世界卫生组织(WHO)规定饮用水中Co2+的限量为40 μg/L[8]。现有的CQDs检测Co2+方法大多以化学物质为前体,对环境及人体健康造成一定的危害,且量子产率较低。田等[9]以化学物质对苯二胺和天冬酰胺为原料,通过一步水热法合成了绿色荧光的N-CQDs,用于检测Co2+及生物成像,但量子产率仅为15.5%。京等[10]以丙烯酸碳源,乙二胺为氮源,采用水热法制备了N-CQDs,量子产率为22.7%。因此,以生物质材料为碳源,采用简单、快速、可控的水热法合成高荧光CQDs,成为了分析检测研究的热点。
我国是世界上禽、畜产量最多的国家之一, 2018年中国猪肉总产量为5 400万吨,约占全球产量的50%,若以猪骨占猪肉的9%~14%计算[11],我国年均产生486~756万吨猪骨。然而,除排骨和腔骨可直接用于饮食而被大量需求外,其他骨头的利用率均不高,造成了极大的资源浪费和环境危害。由于猪骨富含脂肪与蛋白质等物质,可作为制备碳量子点的良好碳源,因此本文以生物质废弃物猪骨(棒子骨)、乙二胺为前驱体,采用绿色经济的水热法合成猪骨氮掺杂碳量子点(N-CQDs),通过各种表征技术研究了N-CQDs的结构和光学性质,探究了N-CQDs的稳定性,建立了一种快速检测Co2+的碳量子点荧光分析方法,并用于实际样品中Co2+的检测。
2 实 验
2.1 实验试剂与仪器
试剂:猪骨(棒子骨)收集于中国雅安苍坪山农贸市场(将猪骨剔除碎肉洗净后,置于60 ℃烘箱中烘干,然后用粉碎机研磨成粉末状,100目过筛保存备用)。乙二胺、CoCl2、KCl、ZnCl2、BaCl2、MgCl2、NaCl、CdCl2、CaCl2、NiCl2、FeCl3、CuCl2、HgCl2、AlCl3、MnCl2、CrCl3、硝酸溶液均购于成都市科隆化学品有限公司(中国成都)。硫酸奎宁购自迈坤化工有限公司(中国上海)。其他化学药品和溶剂均购自万科试剂有限公司(中国雅安),所有试剂均为分析纯。
仪器:Varioskan Flash全波长扫描式酶标仪(美国赛默飞世尔科技有限公司);Lumina荧光分光光度计(美国赛默飞世尔科技有限公司);NICOLETiS10 型傅里叶变换红外光谱仪(美国赛默飞世尔科技有限公司);TEM-2100透射电子显微镜(日本LJEMOC);Milli-Q Gradient超纯水系统(美国密理博公司);Shimadzu D/Max-2500 X射线衍射仪(日本岛津公司)等。
2.2 N-CQDs制备
本实验采用水热法制备绿色生物质猪骨氮掺杂碳量子点。制备方法如下:将骨粉与乙二胺混合在60 mL去离子水中搅拌均匀,然后将混合物转移到100 mL四氟乙烯内胆 Teflon反应釜中,并在烘箱中恒温加热,待反应液冷却得到黄褐色溶液。离心(4 000 r/20 min)后用0.22 μm滤膜过滤除去大颗粒杂质得到N-CQDs溶液,在4 ℃冰箱中避光保存。考察反应温度(160,180,200,220,240 ℃)、反应时间(8,10,12,14,16 h)、骨粉量(4,5,6,7,8 g)和乙二胺量(0.6,0.7,0.8,0.9,1 mL)对N-CQDs荧光强度的影响,确定最佳制备条件。
2.3 N-CQDs表征
TEM-2100透射电子显微镜进行形貌特征分析;Lumina荧光分光光度计测量N-CQDs的荧光光谱;NICOLETiS10 型傅里叶变换红外光谱仪测定N-CQDs表面官能团;XRD-6000X射线衍射光谱仪测定XRD 谱图;Shimadzu D/Max-2500 X射线衍射仪测定XPS谱图;MAZ2012马尔文粒度仪测定Zeta电位。
2.4 量子产率(QY)测定
使用硫酸奎宁(在350 nm的0.1 mol/L H2SO4中 QY=54%)为参比物质,分别测试N-CQDs和硫酸奎宁的紫外-可见吸收光谱及荧光光谱,代入公式(1):
(1)
其中η为量子产率,I表示荧光发射强度,n表示溶剂的折射率,A表示吸光度。下标R和S分别表示已知的荧光标准样品和实验样品[10]。
2.5 N-CQDs稳定性测定
将制备得到的N-CQDs溶液每隔7 d记录荧光发射光谱,考察N-CQDs储藏时间稳定性。将N-CQDs溶液置于365 nm紫外光下,分别照射0,30,60,90,120,150,180 min,考察N-CQDs光漂白稳定性。用0.5 mol/L的盐酸和氢氧化钠溶液调节N-CQDs溶液的pH值,考察N-CQDs的pH稳定性。在N-CQDs溶液中加入50 μL NaCl溶液,其浓度分别为0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1 mol/L,考察N-CQDs的离子稳定性。上述所有测试均是在417 nm激发波长下记录荧光发射光谱,平行测定3次。
2.6 N-CQDs检测Co2+
在荧光比色皿中,加入1 mL 100倍分散体 N-CQDs 溶液、1 mL PBS(pH=7)以及分别加入浓度为 0.1,0.5,1,2,5,8,10,12,15, 20,25,30,40,50,60,70,80,90,100 μg/mL 的Co2+溶液,混合均匀后20 ℃反应10 min。417 nm激发波长下记录荧光发射光谱,以荧光猝灭率F/F0为指标(F是加入Co2+溶液时的荧光强度,F0是不加入Co2+溶液时的荧光强度)。
在N-CQDs溶液中,分别加入1 mL浓度为100 μg/mL的金属离子水溶液(Co2+、K+、Zn2+、Ba2+、Mg2+、Na+、Cd2+、Ca2+、Ni2+、Fe3+、Cu2+、Hg2+、Al3+、Mn2+、Cr3+),检测存在不同代表性离子的荧光强度,考察其选择性。
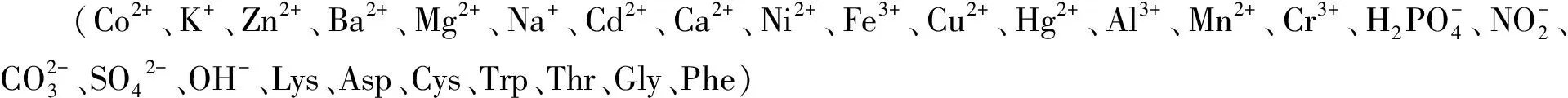
2.7 实际样品测定
分别以来自实验室的自来水和青衣江(中国雅安)的河水作为实际检测样品,评估N-CQDs检测Co2+的实际适用性。根据HJ/T 91-2002采集样品后,将两种样品都分为两份。一份经0.45 μm微孔滤膜过滤,用硫酸溶液调节水样pH小于2,用于分光光度法检测(HJ 550-2015);另一份经0.22 μm微孔滤膜过滤,用硫酸溶液调节水样pH至中性,用于N-CQDs检测。
3 结果与讨论
3.1 N-CQDs制备条件优化
为了获得高荧光性能的N-CQDs,考察了水热反应温度、水热反应时间、骨粉量和乙二胺量对N-CQDs荧光强度的影响。由图2(a)可知,水热反应温度为200 ℃时(6 g骨粉,0.8 mL乙二胺,12 h),N-CQDs荧光强度最高。当水热反应温度开始升高,N-CQDs荧光强度也随之增加,可能是由于在碳化过程中合成了更多的N-CQDs颗粒;但随着温度进一步升高,N-CQDs荧光强度下降,这可能是由于N-CQDs颗粒发生了团聚[12]。由图2(b)可知,当水热反应时间为12 h时(6 g骨粉,0.8 mL乙二胺,200 ℃),N-CQDs荧光强度达到最高值。由图2(c)可知,在骨粉量为6 g时(0.8 mL乙二胺,水热12 h,200 ℃)N-CQDs荧光最强。由2(d)可知,在乙二胺量为0.8 mL时(6 g
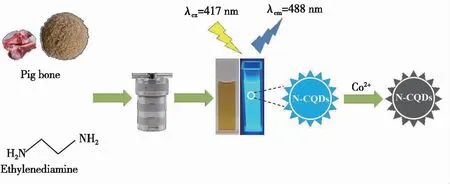
图1 N-CQDs的制备及检测Co2+示意图
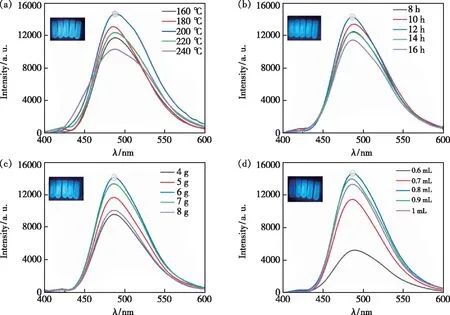
图2 水热反应温度(a)、水热反应时间(b)、骨粉量(c)、乙二胺量(d)对N-CQDs荧光强度的影响。插图:N-CQDs在紫外暗箱中的图片。
骨粉,0.8 mL乙二胺,12 h),N-CQDs荧光强度最高,随着乙二胺用量继续增加,N-CQDs荧光强度降低,可能是由于表面氨基数量增加,更易导致碳量子点聚合,产生自猝灭[13]。
3.2 N-CQDs表征

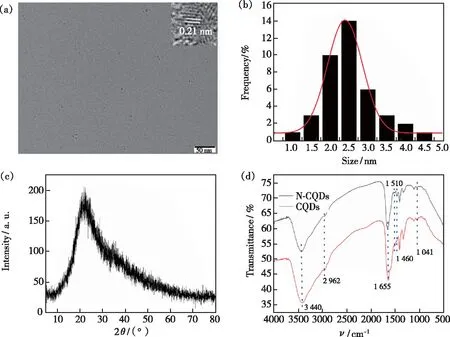
图3 N-CQDs的TEM图(a)、粒径分布图(b)、XRD谱图(c)、FT-IR谱图(d)。插图:N-CQDs的HRTEM图。

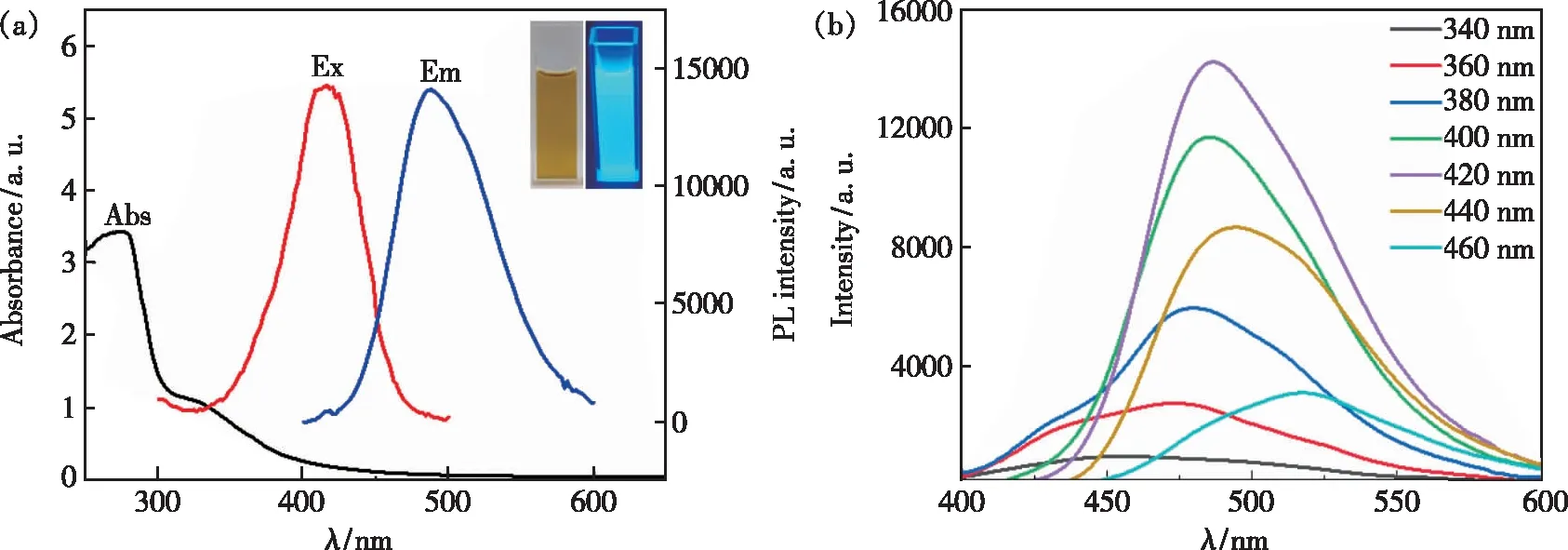
图4 (a)N-CQDs的紫外-可见吸收光谱和荧光光谱,插图:N-CQDs水溶液在可见光(左)和紫外光(365 nm,右)下的照片;(b)不同激发波长下N-CQDs的发射光谱。
采用XPS分析了N-CQDs表面的化学元素及
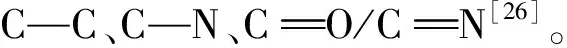
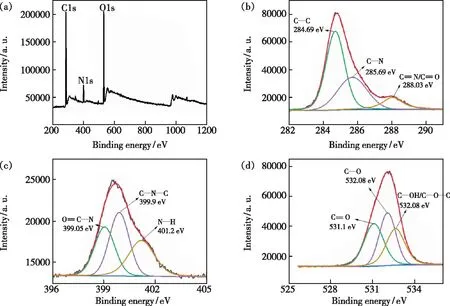
图5 (a)N-CQDs的XPS谱图;(b)C1s的高分辨率XPS谱图;(c)N1s的高分辨率谱图;(d)O1s的高分辨率XPS谱图。
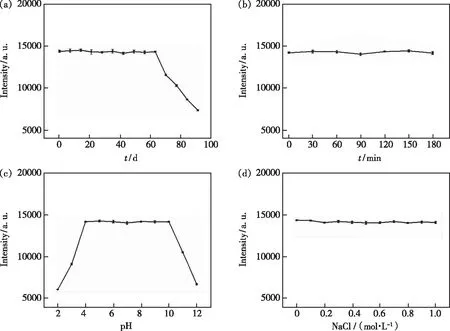
图6 储藏时间(a)、紫外照射时间(b)、pH(c)、NaCl浓度(d)对N-CQDs荧光强度的影响。
照射180 min、不同浓度NaCl条件和较宽的pH范围内,N-CQDs依然显示出强荧光、良好的稳定性和抗漂白性。
3.3 N-CQDs检测Co2+
如图7(a)所示,研究了N-CQDs对不同金属离子的选择性,将各种金属离子分别添加到N-CQDs的水溶液中,包括Co2+、K+、Zn2+、Ba2+、Mg2+、Na+、Cd2+、Ca2+、Ni2+、Fe3+、Cu2+、Hg2+、Al3+、Mn2+、Cr3+,金属离子的浓度均为100 μg/mL,仅Co2+具有猝灭N-CQDs荧光强度的能力,而其他金属离子几乎没有猝灭作用。图7(b)显示,在N-CQDs/Co2+溶液中加入其他干扰物质后,溶液的荧光强度无明显变化,表明这些干扰物质对Co2+的测定基本无干扰,这可能是由于Co2+与N-CQDs表面的某些官能团(—COOH、—OH、—CONH)反应形成复合物,促使电子从N-CQDs的激发态转移到Co2+的3d轨道,导致荧光猝灭[38]。如图7(c)、(d)所示,随着Co2+浓度的
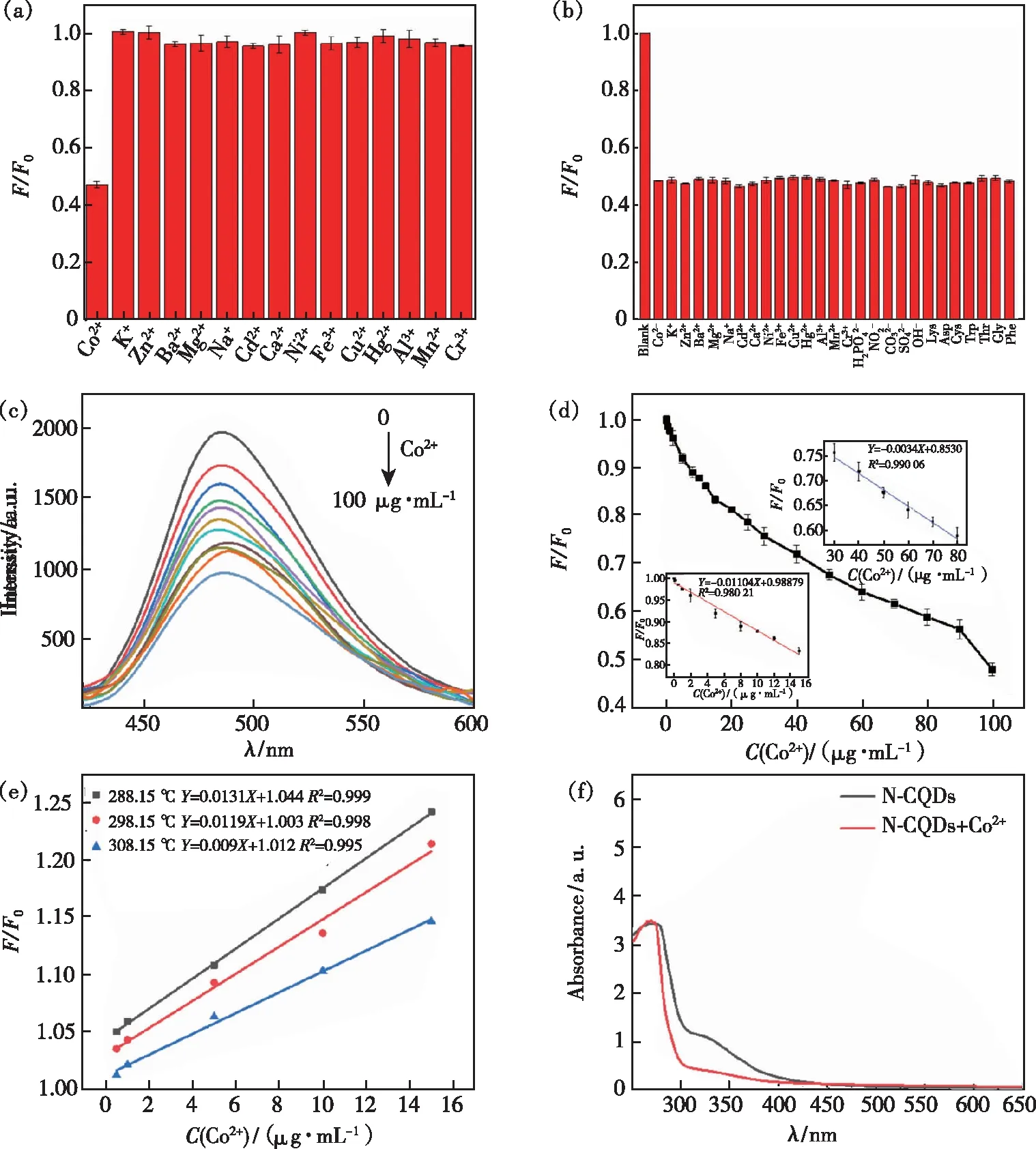
图7 (a)不同金属离子对N-CQDs荧光强度的影响;(b)其他物质存在时Co2+的测定;(c)不同Co2+浓度对N-CQDs荧光强度的影响;(d)F/F0与Co2+浓度在0~100 μg·mL-1的关系曲线(F是加入Co2+溶液时N-CQDs的荧光强度,F0是不加入Co2+溶液时N-CQDs的荧光强度),插图:F/F0与Co2+浓度的线性关系(红色曲线:0~15 μg·mL-1;蓝色曲线:30~80 μg·mL-1);(e)在不同温度下Co2+猝灭的N-CQDs的Stern-Volmer曲线;(f)不存在和存在 Co2+ 时N-CQDs的紫外-可见吸收光谱。
增加,N-CQDs在488 nm处的荧光强度逐渐降低。Co2+浓度为0~15 μg/mL(Y=-0.01104X+0.98879,R2=0.980 21)和30~80 μg/mL(Y=-0.0034X+0.85301,R2=0.990 06)时与N-CQDs猝灭程度呈线性关系,检出限(S/N=3)达到20 μg/L,低于WHO规定的限量值。与表1中Co2+检测方法相比较,本方法具有检出限较低、线性范围宽、成本低等优点。
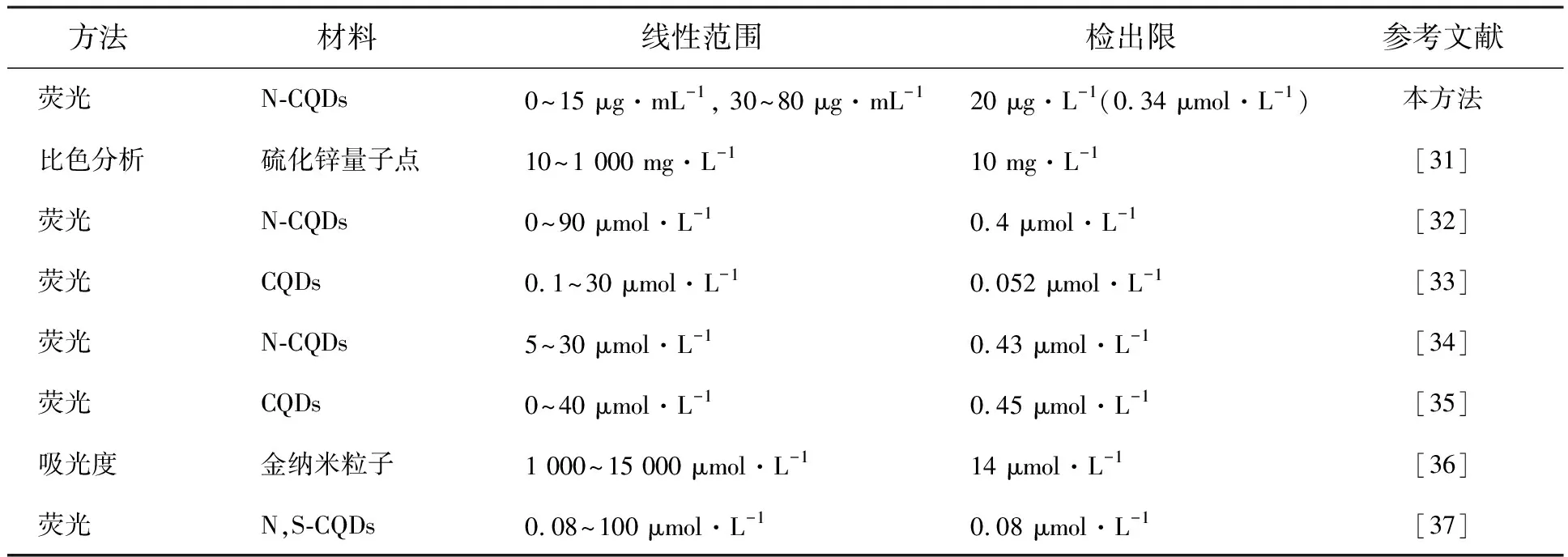
表1 Co2+检测方法比较
荧光猝灭是荧光分子的表面基团与猝灭物质发生反应,导致荧光强度降低,通常分为静态猝灭和动态猝灭。静态猝灭的荧光猝灭常数随温度升高而减小,动态猝灭的荧光猝灭常数随温度升高而增大[29]。为了研究Co2+对N-CQDs荧光猝灭的机理,本文考察了不同温度下Co2+对N-CQDs的猝灭作用,并用Stern-Volmer方程来判断猝灭机理。Stern-Volmer方程为:
F0/F=1+KSVC(Co2+),
(2)
其中F0是不加入Co2+溶液时N-CQDs的荧光强度,F是加入Co2+溶液时N-CQDs的荧光强度,KSV是Stern-Volmer猝灭常数,C为加入Co2+的浓度,曲线如图7(e)所示。在15,25,35 ℃下,猝灭常数KSV分别为0.013 1,0.011 9,0.009,即随着温度升高,猝灭常数KSV减小,表明Co2+是通过静态猝灭使得N-CQDs的荧光发生猝灭。此外,图7(f)显示,在N-CQDs溶液中加入Co2+后,其紫外吸收峰发生了变化,这可能是Co2+与N-CQDs的表面官能团形成了非荧光的基态复合物,并没有在N-CQDs的激发态发生反应。以上结果充分证明Co2+对N-CQDs的荧光猝灭类型为静态猝灭。
3.4 实际样品中Co2+的检测
选择自来水和河水为实际样品,然后采用加标回收法检测水样中的Co2+,结果如表2所示。该方法的回收率为97.26%~109.14%,RSD<3.24%,回收率的准确度优于分光光度法分析结果96.15%~117.05%,表明N-CQDs能够用于实际水样中Co2+的检测。
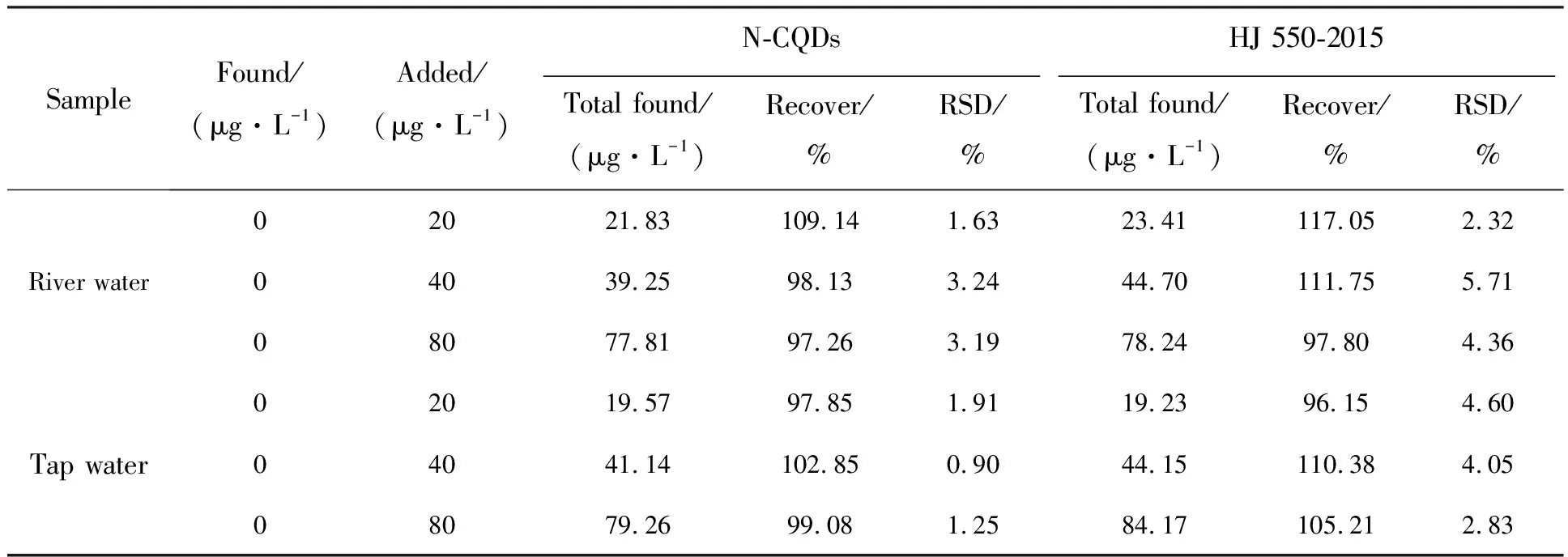
表2 自来水和河水中Co2+的检测结果
4 结 论
本文以生物质废弃物猪骨为碳源,通过一步水热法合成了N-CQDs。XPS和FT-IR表征分析表明氮元素成功掺杂到碳量子点的结构中。N-CQDs的平均粒径为2.34 nm,颗粒分散均匀,表现出良好的溶解度、高稳定性和高荧光强度。基于Co2+能够有效猝灭N-CQDs的荧光,建立了一种高灵敏性和选择性的Co2+的检测方法,检测线性范围为0~15 μg/mL和30~80 μg/mL,检出限为20 μg/L,并能够用于实际样品中Co2+的检测,为环境分析提供了一种简单、快速、灵敏的检测Co2+的新方法。
本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20210260.

