类风湿关节炎的发病机制及药物治疗研究进展
苏雨荷,王 刚,文振华,田 锋,李敬扬
(中南大学湘雅医学院附属株洲医院,株洲 412000)
类风湿关节炎(RA)是一种慢性、全身系统性的自身免疫性疾病,其主要病理特征为滑膜炎与肿胀、软骨与骨破坏及血管翳[1]。RA与进行性残疾、系统性并发症、早期死亡、社会经济成本增加有关[2],其中系统性并发症主要包括心血管疾病、肺间质病变、关节畸形、恶性肿瘤及抑郁症等[3]。流行病学调查结果显示,RA 的全球发病率为 0.5%~1.0%,中国大陆地区发病率为0.42%,总患病人群约为500万,男女患病比例约为1∶4[4-7]。RA既造成患者身体机能、生活质量和社会参与度的下降,也会给患者家庭和社会带来巨大的经济负担[5,8-9]。因此,对RA的规范化治疗十分重要。近年来,有关RA的药物研究越来越多,主要集中在对药物作用机制的研究、临床应用以及新药的开发方面[10-11]。本文主要收集近年来RA的发病机制及药物治疗研究进展并对其进行综述。
1 RA的发病机制
RA的发病机制较为复杂,遗传因素、环境因素、免疫细胞、细胞因子、自身抗体等共同作用最终引起RA关节损伤、骨破坏及多系统疾病。遗传学研究发现,RA的遗传风险为60.0%,人类Ⅱ型白细胞抗原(HLA-Ⅱ)位点编码可能含有共享表位(HLA-DRB1*01、HLA-DRB1*04)的主要组织相容性复合体(MHC)分子,其与RA的发病密切相关。RA发病的危险因素包括性别、吸烟、二氧化硅、牙周及肠道微生物群等。Josef S Smolen等[4]研究认为,吸烟、牙周微生物等危险因素可作为应激源促进关节黏膜部位细胞内蛋白(组蛋白等)、基质蛋白(纤维蛋白原、波形蛋白、胶原蛋白)瓜氨酸化或氨甲酰化,这些经修饰的蛋白质可作为自身抗原被抗原提呈细胞(APC)提呈并与MHC分子结合,之后传递给T细胞促使T细胞激活并分化为Th1、Th17或Tfh细胞,释放细胞因子并激活巨噬细胞及B细胞活化,促进类风湿因子(RF)和抗瓜氨酸合成蛋白抗体(ACPA)分泌。此外,自身抗原抗体结合形成自身免疫复合物,激活关节黏膜部位的成纤维样滑膜细胞(FLS)、巨噬细胞、T细胞等,引起白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、基质金属蛋白酶(MMPs)、核因子-κB (NF-κB)受体活化因子配基(RANKL)等炎性介质的分泌。自身免疫复合物的形成以及炎症因子的持续分泌,使关节局部处于持续慢性炎症损害状态,导致血管翳形成、滑膜增生和破骨细胞增殖活化,最终导致关节软骨及骨破坏[12-13]。
2 RA的药物治疗
RA关节软骨及骨破坏可由细胞因子及炎性介质共同作用引起,尽早抑制细胞因子的产生能有效阻止或减缓关节病变。RA一经确诊,应及时给予规范化治疗。《2018中国类风湿关节炎诊疗指南》中指出,RA的治疗目标是促进疾病缓解或降低疾病活动度,最终控制病情、减少致残率,改善患者的生活质量[14]。目前治疗RA的药物包括糖皮质激素(GCs),非甾体抗炎药(NSAIDS),传统合成改善病情的抗风湿药物[csDMARDs,如甲氨蝶呤(MTX)、来氟米特(LEF)、柳氮磺胺吡啶(SSZ)和环磷酰胺(CTX)],生物类改善病情的抗风湿药物[bDMARDs,如肿瘤坏死因子(TNF-α)抑制剂、抗CD20抗体、抗IL-6受体抗体],靶向合成类改善病情的抗风湿药物[tsDMARDs,如两面神激酶(JAK)抑制剂]。
2.1GCs GCs是治疗RA的经典药物。GCs可通过抑制花生四烯酸及前列腺素的生成与释放、下调炎症因子[TNF-α、白细胞介素-2(IL-2)、IL-6]表达,从而产生快速抗炎镇痛、缓解病情的效果[15]。Li Hua等[16]进行了一项为期1年的随机对照双盲临床试验, 将80名未经治疗的RA患者分为小剂量GCs+羟氯喹(HCQ)+MTX组及安慰剂+HCQ +MTX组,结果表明,小剂量GCs联合HCQ和MTX可显著改善ACR20和DAS28-ESR,延缓关节损伤放射学的进展,并改善RA患者的早期临床表现。因此,小剂量GCs的使用可改善RA患者的临床症状,减缓影像学进展并取得更好的预后。
2.2NSAIDS NSAIDS可抑制环氧化酶(COX)和前列腺素的合成,减轻患者的疼痛、发热、炎症及关节肿胀症状。在RA发病过程中,环氧化酶-2(COX-2)通过参与合成病理性前列腺素引起RA患者慢性炎症及疼痛发热等症状,而环氧化酶-1(COX-1)可保护胃黏膜、肾脏及血管内皮[17]。阿司匹林、布洛芬、双氯芬酸等传统NSAIDS可同时抑制环氧化酶-1(COX-1)及COX-2。传统NSAIDS具有抗炎镇痛的作用,但会增加胃肠道溃疡、出血和穿孔的风险,并可能引起血压升高等不良反应。近年来研发的塞来昔布、依托考昔为选择性COX-2抑制剂,可避免胃肠道溃疡出血等情况[18]。
塞来昔布属于选择性COX-2抑制剂,有效性与安全性较高。塞来昔布通过抑制COX-2的活性减少前列腺素产生,从而促进消炎镇痛并缓解关节肿胀。此外,塞来昔布可减少因作用于COX-1而带来的消化道出血及穿孔的风险。1996年Lee S Simon等[19]进行了一项关于塞来昔布的临床试验,结果表明,100、200、400 mg的塞来昔布在改善关节疼痛、肿胀方面与500 mg萘普生效果相当;塞来昔布及萘普生ACR20应答率均高于安慰剂,且200 mg的塞来昔布在第2、6周的ACR20应答率均高于萘普生(P<0.05)。此外,塞来昔布引起消化道溃疡的风险小于萘普生。因此,塞来昔布是一种镇痛效果良好且消化道出血风险小的NSAIDS。
2.3csDMARDs csDMARDs包括MTX、LEF、CTX、SSZ等药物。csDMARDs可延缓患者的病情发展,是国内外指南共同认可的一线药物。
2.3.1MTX MTX是RA的锚定药。《2018中国类风湿关节炎诊疗指南》中提到,在一般情况下,2/3的 RA 患者单用MTX或与其他csDMARDs 联用,即可达到治疗目标[14]。Bruce N Cronstein等[20]提出,MTX可通过抑制5-氨基咪唑-4-甲酰胺核糖核苷 (AICAR)转换酶,导致AICAR在细胞内积聚并增加腺苷释放,从而抑制炎症和免疫反应;MTX也可通过抑制二氢叶酸还原酶,阻止二氢叶酸还原为四氢叶酸,导致一氧化氮合酶解偶联,增加T细胞对凋亡的敏感性,降低免疫应答;MTX还可通过增加腺苷释放并抑制二氢叶酸还原来抑制NF-κB,从而抑制免疫反应;此外MTX通过增加长链非编码RNA-21(lincRNA-p21)的表达直接和间接调节各种关键的免疫和炎症过程。欧美国家研究显示,欧美国家MTX的使用率高达83.0%,我国使用率仅为55.9%。因此,MTX在我国RA 治疗领域的核心地位和作用应得到进一步巩固和加强。
2.3.2羟氯喹(HCQ) HCQ属于抗疟药,常用于病情轻、病程短的RA患者,常与其他DMARDs合用治疗。HCQ在RA中的作用机制与干扰溶酶体活性、抑制抗原提呈反应及Toll样受体信号有关。《类风湿关节炎诊断及治疗指南》中提到,HCQ有视网膜毒性,因此用药前和治疗期间应每年检查1次眼底,以监测该药可能导致的视网膜损害[21]。Hui-Zi Li等[22]研究表明,使用HCQ的患者总胆固醇(TC)、低密度脂蛋白(LDL)和总三酰甘油(TG)水平低于非HCQ使用者,而高密度脂蛋白(HDL)水平高于非HCQ使用者。此外,使用HCQ的RA患者糖尿病发病率会降低。因此,使用HCQ能改善RA患者的体内代谢,降低心血管事件发生的风险。HCQ与其他DMARDs联用对调控RA患者的代谢和预防心血管事件的发生可能是一个有效的辅助手段。
2.4bDMARDs bDMARDs是针对靶点的生物制剂,能迅速有效地延缓RA造成的关节损伤的进展,被认为是一种更直接、更明确和更有针对性的治疗方法。近年来,bDMARDs得到了广泛应用。常见的bDMARDs有TNF-α抑制剂(阿达木单抗、依那西普、英夫利昔单抗、戈里木单抗)、抗IL-6受体抗体(托珠单抗)、抗CD20抗体(利妥昔单抗)、抗白细胞介素-1 (IL-1)受体抗体(阿纳白滞素)等。但生物制剂可能增加感染风险,因此掌握生物制剂的适应证、禁忌证及不良反应十分重要。
2.4.1TNF-α抑制剂
2.4.1.1阿达木单抗 阿达木单抗是一种抗TNF-α的单克隆抗体,可用于治疗RA、强直性脊柱炎、克罗恩病、幼年特发性关节炎、银屑病等风湿免疫疾病,是目前使用范围最广、安全性较高、疗效好的TNF-α抑制剂。阿达木单抗与可溶性TNF-α具有高亲和力,可通过阻断TNF-α与细胞表面肿瘤坏死因子(TNF)受体(TNFR1或TNFR2)的结合而抑制其生物学功能,这一过程使促炎细胞因子、C-反应蛋白、内皮细胞白细胞黏附分子-1 (ELAM-1)、血管内皮细胞黏附分子-1(VCAM-1)、细胞间黏附分子-1(ICAM-1)、MMP-1和MMP-3水平迅速下降。此外,阿达木单抗与TNF-α的结合可以激活补体级联反应,导致补体介导的细胞溶解。阿达木单抗还能抑制反向信号传递、诱导细胞凋亡并下调促炎细胞因子的分泌。Michael E Weinblatt等[23]研究认为,对于csDMARDs反应不佳的RA患者可加用阿达木单抗,并且其最佳剂量为每2周皮下注射40 mg。阿达木单抗对于关节损害及临床功能的影响也深受重视。Denis Poddubnyy等[24]研究表明,对MTX反应不佳的活动期RA患者来说,使用阿达木单抗组在放射学进展、ACR20、健康调查问卷(HAQ)指数改善等方面均优于安慰剂组,即阿达木单抗对于改善RA患者的临床表现、减缓放射学进展、改善患者身体功能均有较好的效果。此外,阿达木单抗安全可靠,使用该药的患者在不良事件发生率、严重不良事件发生率、感染率方面与安慰剂组比较差异无统计学意义。因此,阿达木单抗作为一种高效、安全的生物制剂可被广泛应用。但高昂的成本以及感染等不良事件仍影响阿达木单抗的普及和利用。
2.4.1.2英夫利昔单抗 英夫利昔单抗是一种与人免疫球蛋白G1 (IgG1)中Fc区结合的嵌合单抗,含有鼠抗肿瘤坏死因子-α抗体的可变区(FAB),可用于治疗RA。英夫利昔单抗与可溶性TNF-α、已与受体结合的TNF-α和膜上附着的TNF-α结合,占据全部TNF-α位点,并抑制细胞因子与相关受体的结合,从而触发对表达TNF-α的细胞的抗体和补体依赖性反应[25]。Jingyang Li等[26]通过一项Ⅱ/Ⅲ期研究也发现,英夫利昔单抗治疗效果优于MTX及安慰剂。英夫利昔单抗不仅可改善患者症状及生存质量,使DAS28显著降低,且经济有效,可用于中重度RA患者的治疗。但感染、肺结核、恶心、瘙痒、恶性肿瘤的发生以及相对于csDMARDs较高的费用限制了英夫利昔单抗的使用。
2.4.1.3依那西普 依那西普是第一种用于治疗RA的TNF-α抑制剂,相较于其他TNF-α抑制剂,依那西普与TNF-α亲和力高于TNF-α受体,易与可溶性TNF-α紧密结合,从而防止TNF-α与受体结合加重炎性反应。在一项为期52周的TEMPO实验中,Lars Klareskog等[27]证明了依那西普联合MTX的效果优于单用MTX或依那西普,并且在延缓RA患者关节放射学进展方面效果更佳,而两者在安全性方面并无明显差别。此外,与安慰剂组相比,依那西普组的临床症状缓解率更高,并且其与MTX或SSZ联合的治疗效果也优于三者的单药治疗。Sizheng Zhao等[28]研究认为,依那西普联合放射治疗效果优于单用csDMARDs或依那西普。在安全性方面,与阿达木单抗与英夫利昔单抗相比,使用依那西普后患者的不良反应更少,停药率更低,引起严重感染及活动性结核概率也更低。但依那西普引起注射部位不适的概率高于阿达木单抗及英夫利昔单抗。综上,依那西普是一种疗效好、安全性高的TNF-α抑制剂,并且与csDMARDs联用可更好地减轻症状,延缓放射学进展。
2.4.2托珠单抗(TCZ) TCZ是一种重组人源化抗IL-6受体单抗,可通过抑制糖蛋白130(gp130)通路限制IL-6细胞因子作用。TCZ可通过静脉或皮下注射给药,欧洲抗风湿病联盟(EULAR)推荐剂量为8 mg·kg-1,每4周给药1次。TCZ可用于对csDMARDs或TNF-α抑制剂无效的中重度RA患者。G Jones等[29]通过一项前瞻性的随机对照实验(RCT)研究证明,在24周时使用TCZ的中重度RA患者达到20%的缓解 (ACR20) (69.9%vs52.5%,P<0.001)和疾病活动度评分(DAS28)缓解率 (26.6%vs12.1%)均高于单用MTX。Norihiro Nishimoto等[30]通过总结6项临床研究,对TCZ的长期疗效和安全性进行了评估。结果发现,在接受TCZ治疗(5年以上的患者中,第5年时91.3%的患者达到了ACR20的疗效标准,73.0%的患者达到了50%的缓解(ACR50)的疗效标准,51.3%的患者达到70%的缓解(ACR70)的疗效标准,59.7%的患者在第5年时达到临床缓解(DAS28<2.6),77.8%的患者可减少GCs使用,35.2%的患者可完全停用GCs,并且感染等不良事件发生率也未见升高[30]。Roy M Fleischmann等[31]对TCZ与MTX的联合治疗进行了研究。结果表明,TCZ联合MTX可显著减缓RA患者关节损伤的放射学进展,其联合用药效果显著优于单用MTX[31]。综上所述,TCZ是一种极优秀的bDMARDs,临床缓解能力远优于MTX等csDMARDs,并且可显著改善RA患者关节损伤的放射学进展,其长期使用的疗效及安全性也十分可靠,并且可减少RA患者对GCs的使用率。但其高昂的成本及给药方式限制了其应用。
2.4.3利妥昔单抗 利妥昔单抗是一种嵌合的抗CD20抗体,由鼠抗CD20单克隆抗体的可变区Fab片段与人免疫球蛋白G1抗体恒定区Fc片段组成,可通过B细胞的凋亡、补体和抗体依赖的细胞毒作用等途径耗竭B细胞,用于治疗中重度RA。Frank Behrens等[32]研究发现,针对LEF反应不佳的患者,加用利妥昔单抗可显著提高ACR50应答率(32%vs15%,P<0.02),但该疗法会增加严重不良反应(主要是感染和肌肉骨骼疾病)的发生率(20%vs2%)。Duncan Porter等[33]研究发现,利妥昔单抗对于中重度RA的疗效优于TNF-α抑制剂,不良事件方面无明显差别,并且利妥昔单抗治疗费用明显低于TNF-α抑制剂。综上,利妥昔单抗单用临床效果优于TNF-α抑制剂,与LEF、MTX等csDMARDs联用对于中重度RA有更好的作用,并且其治疗费用低于TNF-α抑制剂,因此是一种极有潜力的生物制剂。
2.5tsDMARDs tsDMARDs是指可多靶点治疗的JAK抑制剂。JAK是一种非受体型酪氨酸蛋白激酶, JAKs的激活可以促使下游的信号传导及转录激活蛋白(STAT)磷酸化,随后,磷酸化的STAT二聚体被主动运送到细胞核内,调节基因表达,致使40多种细胞因子可通过JAK-STAT信号通路引起炎症及免疫反应。因此,JAK抑制剂可通过抑制JAK激酶来抑制免疫及炎症反应,从而达到治疗RA的作用。相比于csDMARDs及bDMARDs,JAK抑制剂有以下优势:相对分子质量小,可口服给药;可到达细胞内部,直接抑制细胞内信号分子;可针对多个细胞因子作用,起到多靶点治疗效果。目前已知的JAK抑制剂包括托法替布、巴瑞替尼、乌帕替尼及菲戈替尼,前3种药物已经进入临床使用,菲戈替尼还在临床Ⅲ、Ⅳ期药物试验阶段[34]。
2.5.1托法替布 托法替布是首个在多项临床研究中显示出良好疗效的JAK抑制剂,也是首批投入使用的tsDMARDs。托法替布与两面神激酶1(JAK1)、两面神激酶3(JAK3)有较高的亲和性和特异性,可减弱JAK1/JAK3介导的IL-2、白细胞介素-4(IL-4)、IL-6、白细胞介素-7(IL-7)、白细胞介素-15(IL-15)和白细胞介素-21(IL-21)以及干扰素信号,从而抑制免疫反应,减轻炎症,EULAR推荐托法替布用量为5 mg·次-1,口服,每日2次。Wilkinson B等[35]研究发现,托法替布组在ACR70、ACR20和ACR50应答率、DAS28-ESR缓解率方面显著高于MTX组;此外,在第6个月时,托法替布组的改良的夏普评分(mTSS)、糜烂评分和关节间隙狭窄评分增幅远小于MTX组。因此,托法替布单药治疗的临床疗效及减缓关节损伤放射学进展效果均优于MTX单药治疗[35]。Roy Fleischmann等[36]比较了托法替布联合MTX、阿达木单抗联合MTX及托法替布单药治疗的效果,结果发现,托法替布联合MTX疗效优于阿达木单抗联合MTX,且二者均优于托法替布单药治疗。托法替布是一种有独特优势的tsDMARDs,其作用靶点更精准,给药方式更安全方便,疗效优于阿达木单抗,使其得到广泛应用,但托法替布仍需要更多前瞻性、多中心的试验以探究其长期疗效及安全性。
2.5.2巴瑞替尼 巴瑞替尼是第2种推出的JAK抑制剂,对JAK1及两面神经酶2(JAK2)选择性高,而对JAK3选择性较弱。巴瑞替尼可通过抑制Ⅰ型干扰素的分泌下调CD80/86的表达,也可抑制IL-6细胞因子的表达以及B细胞和致病T细胞向Th1细胞及Th17细胞分化,促进中性粒细胞凋亡。食品药品监督管理局(FDA)建议巴瑞替尼用量为2 mg,每日1次,用于治疗中重度RA。Peter C Taylor等[37]研究表明,使用巴瑞替尼的患者其ACR20应答率高于使用阿达木单抗及安慰剂的患者(ACR20:70%∶61%∶40%,P<0.05)。并且第12周时巴瑞替尼组DAS28、SDAI评分及HAQ-DI评分的改善也优于阿达木单抗组(-2.24vs-1.95,P<0.001)。此外,第24周及第52周时巴瑞替尼组mTSS评分、糜烂评分和关节间隙狭窄评分增加均小于安慰剂组[37]。Roy Fleischmann等[38]进行了为期52周的RA-BEGIN研究来评估巴瑞替尼对既往未接受过csDMARDs及bDMARDs治疗的活动期RA的疗效。结果表明,巴瑞替尼效果优于MTX(ACR20:77.0%vs62.0%),并且巴瑞替尼联合MTX对于身体功能改善及减缓关节损伤的放射学进展效果最佳。巴瑞替尼不仅可作为中重度RA患者对于csDMARDs及bDMARDs不耐受后的选择,既往未接受治疗的RA患者使用巴瑞替尼也可取得良好的临床缓解效果并抑制关节损伤的放射学进展。因此,巴瑞替尼是一种极有潜力的tsDMARDs,巴瑞替尼的广泛应用也将为RA患者带来更好的预后。
2.5.3乌帕替尼 乌帕替尼是一种口服JAK抑制剂,对JAK1有更高的选择性。乌帕替尼适用于对csDMARDs反应较差的中重度RA患者,目前美国及欧盟建议使用量为15 mg·次-1,每日1次。Gerd R Burmester等[39]通过一项随机临床研究(RCT)对661名csDMARDs效果不佳的中重度RA患者进行了研究。结果表明,乌帕替尼15 mg组及30 mg组疗效显著优于安慰剂组(ACR20:64.0%∶66.0%∶36.0%),并且乌帕替尼组取得中低疾病活动度患者比例也高于安慰剂组。Roy Fleischmann等[40]对1 629名中重度RA患者进行研究,比较了乌帕替尼与阿达木单抗及安慰剂的疗效及安全性。结果表明,第12周时,乌帕替尼组ACR20应答率高于阿达木单抗及安慰剂组(71.0%∶63.0%∶36.0%,P<0.001),取得低疾病活动度患者更多(29.0%∶18.0%∶6.0%,P<0.001);第26周时,乌帕替尼组及阿达木单抗组放射学进展均低于安慰剂组,2组间无明显差别。另外,乌帕替尼在改善患者的生活质量方面优于阿达木单抗。乌帕替尼是一种极有潜力的tsDMARDs,中重度活动期RA患者接受乌帕替尼联合csDMARDs治疗后,临床体征和症状均有显著改善,此外乌帕替尼可减缓患者的关节损伤放射学进展,改善患者的生活质量,因此乌帕替尼可作为患者对于csDMARDs及bDMARDs反应不佳时的替代药物。
2.5.4菲戈替尼 菲戈替尼是一种JAK1抑制剂,目前在全球Ⅲ期药物试验中已取得良好的临床效果。Mark C Genovese等[41]进行了随机、双盲、多中心的FINCH 2 Ⅲ期临床研究,结果表明,200、100 mg菲戈替尼的疗效以及在改善患者生活质量等方面均优于安慰剂组。因此,对于bDMARDs反应不佳的中重度RA患者,改为菲戈替尼治疗或可取得良好的疗效。作为一种新型JAK1抑制剂,菲戈替尼对于中重度RA患者有着巨大的应用潜力,但其长期疗效及安全性仍需更多临床试验验证。
以上药物常见的不良反应见表1。
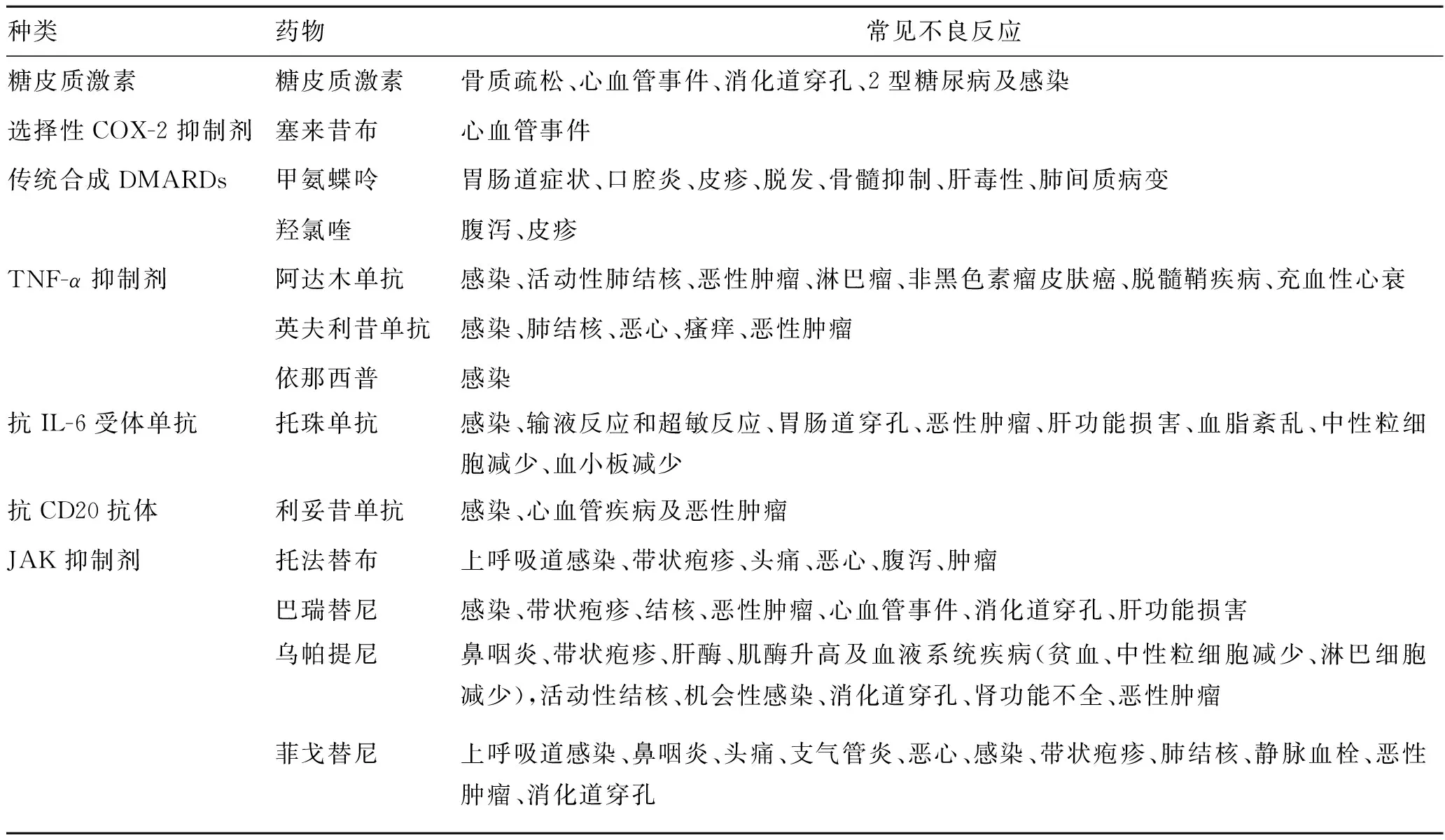
表1 RA药物不良反应
3 小结
RA作为一种以慢性炎症为特征的自身免疫性疾病,可引起关节破坏、畸形和残疾,RA带来的众多并发症如心血管疾病、肺间质病变等也严重影响患者的生存质量及寿命,因此对RA的规范治疗极为重要。2019年EULAR指南[42]指出,RA一经诊断,应立刻使用DMARDs药物治疗,MTX为治疗RA的一线药物,并且是联合治疗的基础,当csDMARDs疗效不佳时,可加用bDMARDs或tsDMARDs联合治疗。csDMARDs与bDMARDs或tsDMARDs联合治疗不仅可取得良好的临床效果,达到临床缓解效果,并且可显著改善患者的生活质量及身体机能,抑制关节损伤的放射学进展,因此联合治疗将成为RA治疗的热点。JAK抑制剂因其相对分子质量小、多靶点作用、给药途径便捷等特点将成为未来RA药物治疗发展的新方向。

