调控动脉导管闭合的分子机制研究进展
陈颖慧 张 琪综述 鲁亚南 于 昱 审校
上海交通大学医学院附属新华医院 1.心血管发育与再生医学研究所;2.儿心脏中心(上海 200092)
动脉导管(ductus arteriosus,DA)是胎儿时期连接肺动脉与主动脉弓之间的动脉管道,DA 在胎儿期持续开放和出生后自行闭合对维持胎儿的生存和出生后正常体肺循环血流分布至关重要。
胎儿期动脉导管保持开放,将血液从高阻力的肺循环分流到体循环,维持胎儿正常发育,磁共振研究表明,胎儿期通过动脉导管的血流量占心室输出量41%[1]。出生后,随着自主呼吸的建立,肺循环阻力下降,在生后10~15小时,DA会随着管壁平滑肌收缩发生功能上的关闭,80%儿童的DA 在生后3 个月发生解剖学关闭。DA自行闭合,切断了体循环和肺循环之间的血液分流,从而保证血流正常分布。至出生后1年,DA在解剖学上完全关闭,成为一条无功能的动脉韧带。DA 在先天性心脏病中具有非常重要的临床意义,其在开放和闭合之间的动态变化会对血流动力学产生极大的影响。
1 DA的特殊性
1.1 DA特殊的结构
尽管DA 连接的主动脉和肺动脉是两个弹性型动脉,但它本身却是一种肌肉型动脉,管壁主要由平滑肌细胞层组成,导致DA 较其他血管更容易被诱导发生收缩和开放,临床需要基于不同治疗目的来调控DA的开放和关闭。
1.2 单纯的PDA
DA 开放对于维持胎儿循环必不可少,但在出生后,主动脉压在收缩期和舒张期均超过肺动脉压,通过未闭合的DA 会形成从左到右的分流。出生后DA的持续分流会造成一系列严重并发症,比如肺动脉高压、右心功能衰竭,即为动脉导管未闭(patent ductus arteriosus,PDA),占先天性心脏病发病总数10%,在早产儿中,PDA 发病率可达50%。新生儿尤其是早产儿中,可因PDA出现大量肺充血,以致心功能不全和继发呼吸道感染等,增加并发症的发生率以及死亡率。对于单纯的PDA 患儿,促进开放的DA 闭合是治疗的核心。目前治疗PDA 的药物主要是非选择性COX 酶抑制剂,尽管可以有效促进DA 关闭,但会导致全身性血管收缩,影响大脑、肠系膜和肾脏血流灌注,加重PDA造成的损害。
1.3 依赖DA开放的疾病
在某些特殊类型先天性心脏病中,肺循环或体循环血液需要完全依赖未闭合的DA 分流输送,如完全大血管转位、肺动脉闭锁、严重的肺动脉狭窄。当DA缩小或闭合时,肺循环或体循环血流量会逐渐或者急骤下降,引起严重的低氧血症、循环衰竭,出现严重并发症和死亡风险增加。因此,在手术介入治疗原发心脏病前,阻止或逆转DA 自行闭合的趋势对于维持患儿生命至关重要[2]。
前列腺素疗法是目前保持DA 开放的有效疗法,存在两种不同的前列腺素制剂:前列腺素E1(prostaglandin E1,PGE1),又称为前列地尔;前列腺素E2(prostaglandin E2,PGE2),又称为地诺前列酮。PGE1和PGE2可作用于相同受体,发挥同等效力,但目前只有前列地尔获得维持DA 开放的临床应用许可,可能是由于此类药物性质较PGE2稳定。但前列地尔需要避光保存并且静脉维持使用,长期使用会改变DA结构而干扰治疗效果[3]。
2 影响DA功能性关闭的分子机制
DA 闭合分为两个过程:功能性关闭和解剖学闭合,DA的功能性闭合发生在生后数小时内。
2.1 前列腺素
2.1.1 PGE2前列腺素由花生四烯酸经过环氧化酶(COX-1和COX-2)催化合成,在新生儿体内PGE2活性明显高于其他前列腺素,因此目前认为PGE2是调节胎儿时期DA开放最重要的前列腺素(图 1)。孕母的胎盘和胎儿均会产生PGE2,PGE2受体(prostaglandin E receptor,EP)包括4类亚型EP1/2/3/4,在人的DA中主要表达EP3和EP4。在DA 中,PGE2与EP4结合后,通过EP4受体偶联的G蛋白,经AC-cAMP-PKA通路抑制肌球蛋白轻链激酶(myosin-light-chain kinase,MLCK)对肌球蛋白轻链(myosin-light-chain,MLC)的磷酸化,使平滑肌细胞舒张,导致DA 舒张;还能够激活电压门控钾离子通道(KV)增加K+外流,引起平滑肌细胞膜超极化,抑制电压门控L 型钙离子通道(CaL)减少Ca2+内流,降低细胞内[Ca2+],使平滑肌舒张[4]。在羊胎儿模型中发现,PGE2和EP3结合虽然抑制cAMP 产生,但能通过独立于cAMP 的途径激活ATP 敏感型钾离子通道(KATP)来介导DA 舒张(图 2)。目前认为,PGE2是通过这两条通路介导DA在宫内保持开放。出生后,失去产生PGE2的主要来源,部分PGE2由前列腺素转运蛋白(prostaglandin transporter,PGT)转导进入II 型肺泡上皮细胞,在肺内被15-羟基前列腺素脱氢酶(15-hydroxyprostaglandin dehydrogenase,15-PGDH)代谢(图2),使循环中PGE2迅速下降,触发DA发生收缩。在家兔模型中观察到,出生后EP 4 表达下调和升高的PaO2能够降低DA对PGE2的反应敏感性,有利于出生后DA发生收缩。部分早产儿体内PGE2对EP2、EP3和EP4受体结合能力增加,表现出对PGE2高敏感性;体内15-PGDH活性低于足月儿,PGE2降解速率减慢;降解cAMP的磷酸二酯酶(Phosphodiesterase,PDE)在早产儿体内表达降低,导致cAMP在体内积聚,以继续维持DA开放[5](图 1)。上述原因都可能是使用COX酶抑制剂类药物治疗早产儿PDA无效的原因。而EP4特异性拮抗剂能收缩早产大鼠DA[6];PGT敲除小鼠出现PDA表型,使用PGT 拮抗剂能够推迟DA 闭合时间,但此类研究结果的临床应用仍待进一步探索。尽管PGE2是维持DA 开放最重要的前列腺素,在妊娠期间慢性抑制PGE2合成会导致PDA患病率升高,提示除了介导DA扩张外,PGE2可能与DA解剖学关闭有关。
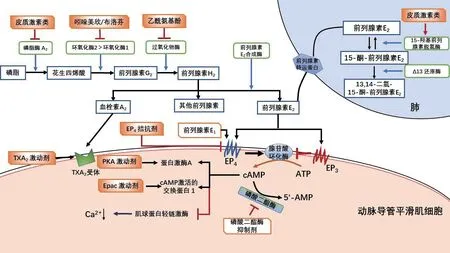
图1 出生前后DA 中前列腺素代谢途径和作用分子机制中可能的药物靶点
2.1.2 血栓素A2在人的DA 可检测到血栓素A2(thromboxane A2,TXA2)受体(thromboxane A2receptor,TP)丰富表达,TP特异性激动剂在低浓度下收缩DA的效果优于吲哚美辛,既不会收缩其他血管,也不会引起肺毛细血管微血栓,其作用机制可能是影响了动脉导管平滑肌细胞(ductus arteriosus smooth muscle cell,DASMC)中[Ca2+]。此外,TXA2作用于DASMC能产生某些分泌蛋白影响DA解剖学闭合,但具体机制尚不明晰[7]。深入研究TXA2对DA的影响,有望开发治疗PDA的新药物靶点。
2.2 生后PaO2升高
出生后,循环中PaO2增高,经线粒体裂变产生活性氧(reactive oxygen species,ROS)。ROS抑制平滑肌细胞膜的KV通道,导致平滑肌细胞膜去极化,激活CaL 离子通道,Ca2+内流增加,平滑肌细胞收缩,DA发生功能性关闭。ROS 还可以激活Rho 激酶途径,诱导DA中RhoB和Rho相关蛋白激酶1(rho-associated kinase 1,ROCK-1)表达,抑制肌球蛋白轻链磷酸酶(myosin-light-chain phosphatase,MLCP)活性,增加MLC 磷酸化和活性,导致平滑肌细胞收缩,DA 关闭(图2)。
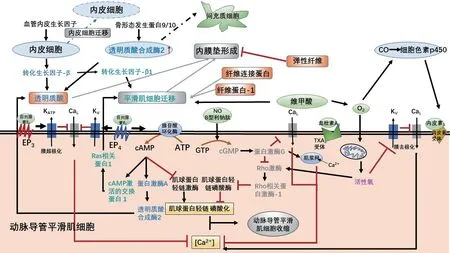
图2 调控DA 闭合的分子机制
在动物模型中,部分细胞膜离子通道表达下调,降低了DA 对PaO2反应性,这也可能是导致DA 在生后持续开放的原因[8]。基于此,新生儿及时通气治疗有望成为临床预防PDA的新干预手段。
2.3 NO
NO 由内皮细胞中内皮一氧化氮合酶(eNOS)产生,扩散到相邻平滑肌细胞后与可溶性鸟苷酸环化酶(sGC)结合,催化产生环磷酸鸟苷(cGMP),激活依赖cGMP的蛋白激酶(PKG)。PKG抑制CaL通道减弱Ca2+内流,促进肌浆网(SR)对Ca2+的摄取,降低平滑肌细胞内[Ca2+],使平滑肌细胞舒张,DA 开放[8]。PKG抑制Rho激酶,激活MLCP,介导MLC去磷酸化来诱导DA舒张(图 2)。
在人类胚胎中检测到eNOS 在妊娠早期高表达,目前认为在妊娠早期主要由NO维持DA扩张,妊娠中后期由PGE2起主要作用[9]。研究报道,联合使用一氧化氮合酶抑制剂和COX酶抑制剂治疗早产小鼠PDA,比单独使用COX酶抑制剂有更好的效果,为临床治疗早产儿PDA提供了新策略。
胎儿出生后,机体所处环境发生很大变化,除了上述分子机制改变以外,还存在其他机制参与。例如,临床证据显示在早产儿中较高的B 型利钠肽(BNP)水平预示PDA 已经引起了严重的血流动力学变 化[10],吲哚美辛治疗此类型PDA 效果不佳。但目前认为BNP能够通过GC-cGMP途径介导血管舒张,其介导DA 扩张的机制尚未得到充分研究。O2和CO 通过对细胞色素P 450 和内皮素ET-1 的调节介导DA的舒缩等。找到能够介导DA 收缩和扩张,而对周围大血管作用微弱的分子,是PDA 潜在的高效治疗靶点。
3 影响DA解剖学闭合的分子机制
除了生后数小时内发生的急性收缩,DA 还会以血管重塑的方式发生特有的形态学改变,这些改变不会发生在周围的主动脉和肺动脉上。只有发生解剖学闭合才算是彻底完成体内到体外循环的转变,杜绝DA关闭后再开放。
3.1 内皮细胞
从妊娠中期开始,内皮细胞逐渐离开内弹性板,创造一个游离的内皮下环境。在DA 功能性关闭后,DA内壁出现缺血缺氧,在缺氧诱导下释放各类因子,如低氧诱导因子1 α(HIF-1 α)、血管内皮生长因子(VEGF)等,加剧内皮细胞的增殖和迁移。在狭窄的DA 中,VEGF 的分布与缺氧区域密切相关,使用抗VEGF 抗体能够抑制单核细胞黏附至DA 管腔,减少内膜垫的形成与发展。如果DA收缩没有产生足够的缺血缺氧区域,就不能启动内皮细胞迁移,造成DA解剖学关闭失败。研究发现,骨形态发生蛋白9/10(BMP 9/10)能够影响DA 关闭时内皮细胞向间充质细胞转换,从而干扰内膜垫增厚,导致小鼠DA在生后4天出现闭合后再开放[11](图 2)。
3.2 内膜垫的形成(intimal cushion formation,ICF)
内膜垫的形成是动脉导管解剖学闭合一个关键步骤,主要包括细胞外基质沉积和平滑肌细胞增殖迁移。在动物模型和人的PDA中都能观察到DA内膜垫的结构异常。因此,阐述参与ICF过程的分子机制,可为说明PDA可能的发病机制提供理论依据。
3.2.1 细胞外基质 细胞外基质被定义为细胞分泌的非细胞成分,就目前研究进展,透明质酸、硫酸软骨素、弹性蛋白纤维、纤维连接蛋白这些分子在PDA内膜垫结构异常中有不同程度的参与[12]。正常情况下与毗邻血管相比,DA血管壁中层的弹性纤维更加稀疏,内弹性板弹性减弱,DA更容易发生坍塌而闭合。PDA患者的DA中往往没有内膜和中层弹性纤维形成减弱。PGE2-EP4途径激活后减弱赖氨酰氧化酶(LOX)表达,抑制弹性纤维的形成。但是,使用关于PGE2-EP4-ACcAMP-Epac/PKA通路中的类似物均不能抑制弹性纤维生成,提示PGE2通过EP4受体抑制弹性纤维生成的通路独立于cAMP 通路,其下游仍待进一步探究[13]。解剖学关闭后的DA 中有大量透明质酸(hyaluronic acid,HA)沉积,HA沉积创造的环境有利于平滑肌细胞迁移,对DA重塑有重要影响。PGE2通过PGE2-EP4-cAMP-PKA 信号促进HA 产生,使用PGE1、PGE2和EP4受体激动剂,在胎鼠DASMC 中均能观察到透明质酸合成酶2(HAS2)表达上调以及HA合成增多,此表现能被PKA抑制剂拮抗。BMP 9/10能够上调内皮细胞中HAS 2 表达影响DA 的闭合[11](图2)。内皮细胞分泌TGF-β 和IL-15,前者能够介导HA和硫酸软骨素的合成与沉积,后者能剂量依赖性的减少PGE1诱导的HA沉积。近期发现,纤维连接蛋白和糖蛋白Fibulin-1 帮助形成一个利于DASMC 向内皮下定向迁移的环境促进ICF过程,两者任一的缺乏都会导致ICF受阻发生PDA[14-15]。
3.2.2 DASMC 迁移和增殖 和其他循环系统疾病所导致的血管重塑类似,平滑肌细胞增殖和迁移在DA 重塑中起着重要作用。Epac 是cAMP 另一个下游靶标,Epac 能够影响血管平滑肌细胞迁移和内膜增厚,是其他血管疾病中影响血管重塑的关键分子[16]。在DA 中,Epac 选择性cAMP 激动剂能在4 小时内促进大鼠DASMC迁移。相反,PKA 选择性cAMP 激动剂在此急性期抑制DASMC迁移。提示Epac 是独立于PKA的cAMP信号通路,尤其是Epac1。通过PGE2-EP4-AC-cAMP-Epac1-Rap1途径,参与DASMC迁移以促进DA内膜垫增厚。Epac 1刺激不会增加HA产生,认为Epac1对DASMC迁移的影响独立于透明质酸积累的影响(图2)。此外,维甲酸可以刺激DASMC 增殖,孕鼠服用维生素A 不仅增加纤维连接蛋白和HA产生,还可以增强DA对[Ca2+]以及O2变化的敏感性,对功能性和解剖学DA 闭合都起作用。有研究表明,早产儿生后行维生素A补充,可以显著降低PDA发病 率[17]。TGF-β1通过增加整合素与细胞骨架黏附,促进DASMC 局部斑块形成,来维持重塑过程中DA 收缩所需的张力。Notch 系统在人类血管中高度表达,Notch信号抑制剂γ分泌酶抑制剂(DAPT)可以阻止血管紧张素Ⅱ诱导的DASMC增殖和迁移,可能是通过Notch 3-HES 1/2/5 通路减轻Ca2+内流,减少ROS产生和下调ERK1/2、JNK和Akt来实现的[18]。
4 血细胞的相互作用
出生后,DA收缩导致血管壁缺血缺氧,造成局部炎症环境,激活白细胞通过ICAM-1和P-选择素相互聚集,激活单核细胞和巨噬细胞通过VCAM-1黏附于血管壁,这种黏附能够促进ICF过程。
DA收缩后,内皮细胞脱离触发了血小板黏附,在DA壁上形成了血小板团块,进一步堵塞管腔。如果血小板功能受损或注射了抗血小板抗体,会损害导管重塑。对PDA患者血浆蛋白质进行检测,发现了与血小板活化和凝血级联相关蛋白质的下调[19]。
由于ICF 过程需要由管壁缺氧触发,早产儿DA在出生后的收缩不易出现缺氧,血小板团块形成在DA关闭中就更重要,生后24小时血小板计数降低能够预测DA在早产儿中的延迟关闭[20]。
5 遗传因素
PDA 作为一种常见的先天性心血管畸形,也受到遗传因素影响。从Char Syndrome患者中第一次鉴定出与PDA发病有关的致病基因—转录因子AP-2β(TFAP2B)后,还发现TNF受体相关因子1(TRAF1)和前列腺素合酶(PTGIS)遗传变异与PDA 的致病有关。近年来,对DA和主动脉进行差异表达基因筛选,发现TGF-β受体-Ⅱ(TGFBR2)与PDA发病有关[21]。对PDA 患者行外周血外显子测序(WES),找到了可能与PDA发病有关的7个候选基因[22],目前关于PDA的遗传性致病因素研究已经取得部分进展,但是其涉及的分子机制仍不清楚。
针对前文所述的部分分子机制,构建基因敲除鼠,如编码前列腺素代谢通路的基因(Ptgs 1/2、Ptger 4、Hpgd、Slco 2 a 1),编码平滑肌发育的基因(Tfap 2 b、Myocd、Myh 1),以及编码细胞外基质中糖蛋白Fibulin-1的基因Fbln1,均能出现PDA表型,提示这些基因发生遗传学改变也会导致PDA。通过鉴定某些特定基因的表达是否发生变化,选择针对该基因涉及的分子机制进行精准治疗将会是未来工作的重心。
综上,DA 在出生前后发生的缓慢解剖学变化和迅速的功能性变化,使DA 在恰当时间关闭。各类分子通过不同途径参与DA 关闭,且其调控机制也不尽相同。目前临床治疗大多使用针对前列腺素作用途径的非特异性COX酶抑制剂类药物进行治疗,除了并发症以外,往往还有很大一部分患者对此治疗无反应。可见,研究影响DA 闭合的分子靶点,找出能够影响DA闭合但不作用于其他血管的分子作为治疗PDA的靶点,具有可观的研究前景,对血管生物学研究和临床儿科转化应用领域至关重要。

