3D-STI对原发性高血压亚临床动脉粥样硬化病人左心室功能的评价
单晓英 陈晓菲 孙瑞聪 姜志荣 马建敏
[摘要] 目的 应用三维斑点追踪成像(3D-STI)联合颈部血管超声评价原发性高血压亚临床动脉粥样硬化病人的左心室功能。
方法 选取90例原发性高血压病人纳入研究组,行颈部血管超声检查,根据颈动脉内-中膜层厚度(CIMT)及斑块情况分为颈动脉正常组(A组)33例、颈动脉内-中膜增厚且未见斑块组(B组)27例、颈动脉斑块形成组(C组)30例,另选取29例健康体检者为对照组。对所有研究对象均行3D-STI检查,获取左心室整体纵向应变(GLS)、整体径向应变(GRS)、整体圆周应变(GCS)及三维应变(3DS)等,分析各组间参数的差异及心肌应变的相关影响因素。
结果 与对照组比较,原发性高血压A组、B组、C组GLS均减低,C组GCS、GRS、3DS减低;B组、C组GLS较A组减低;C组GLS较B组减低,差异均有统计学意义(F/H=10.11~85.71,P<0.05);C组GLS<-18%人数较A组明显增多,差异有统计学意义(χ2=24.07,P<0.05)。研究组GLS与CIMT、颈动脉斑块、舒张末室间隔厚度((IVSd)中等程度呈负相关(r=-0.560~-0.400,P<0.05);GCS、GRS、3DS与CIMT及IVSd呈弱负相关(r=-0.380~-0.190,P<0.05);GRS与颈动脉斑块弱相关(r=-0.210,P<0.05)。多元线性回归分析显示,原发性高血压病人SBP、CIMT、左心室心肌质量指数(LVMI)及颈动脉斑块形成对GLS有影响(β=-0.254~0.200,P<0.05,调整后R2=0.49)。
结论 3D-STI技术联合颈部血管超声能够敏感评价原发性高血压亚临床动脉粥样硬化病人左心室的收缩功能改变;随着亚临床动脉粥样硬化进展,左心室功能逐渐降低。
[关键词] 原发性高血压;动脉粥样硬化;超声心动描记术,三维;斑点追踪成像;心室功能,左
[中图分类号] R544.11;R445.1
[文献标志码] A
[文章编号] 2096-5532(2021)05-0750-06
doi:10.11712/jms.2096-5532.2021.57.182
[開放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.r.20211101.1334.004.html;2021-11-02 15:39:02
VALUE OF THREE-DIMENSIONAL SPECKLE-TRACKING IMAGING IN EVALUATING LEFT VENTRICULAR FUNCTION IN PATIENTS WITH ESSENTIAL HYPERTENSION AND SUBCLINICAL ATHEROSCLEROSIS
SHAN Xiaoying, CHEN Xiaofei, SUN Ruicong, JIANG Zhirong, Ma Jianmin
(Echocardiography Department of the Affiliated Hospital of Qingdao University, Qingdao 266003, China)
[ABSTRACT] Objective To investigate the value of three-dimensional speckle-tracking imaging (3D-STI) combined with cervical vascular ultrasound in evaluating left ventricular function in patients with essential hypertension and subclinical atherosclerosis.
Methods A total of 90 patients with essential hypertension were enrolled as study group and underwent cervical vascular ultrasound, and according to carotid intima-media thickness (CIMT) and plaque conditions, they were divided into in group A with 33 patients (normal carotid artery), group B with 27 patients (thickened carotid intima-media without plaque), and group C with 30 patients (formation of carotid plaque). In addition, 29 healthy individuals who underwent physical examination were enrolled as control group. All subjects underwent 3D-STI to obtain the data on global longitudinal strain (GLS), global radial strain (GRS), global circumferential strain (GCS), and three-dimensional strain (3DS) of the left ventricle, and the differences in these parameters were analyzed between groups. The influencing factors for myocardial strain were also analyzed.
Results Compared with the control group, groups A, B, and C had a significant reduction in GLS, and group C had significant reductions in GCS, GRS, and 3DS; compared with group A, groups B and C had a significant reduction in GLS, and group C had a significant reduction in GLS compared with group B (F/H=10.11-85.71,P<0.05); compared with group A, group C had a significantly higher number of patients with GLS <-18% (χ2=24.07,P<0.05). GLS was moderately negatively correlated with CIMT, carotid plaque, and thickness of the interventricular septum (IVSd) (r=-0.560 to -0.400,P<0.05); GCS, GRS, and 3DS were weakly negatively correlated with CIMT and IVSd (r=-0.380 to-0.190,P<0.05); GRS was weakly correlated with carotid plaque (r=-0.210,P<0.05). The multivariate linear regression analysis showed that systolic blood pressure, CIMT, left ventricular mass index, and carotid plaque formation had an influence on GLS in patients with essential hypertension (β=-0.254 to 0.200,P<0.05), with an adjusted R2 of 0.49.
Conclusion 3D-STI combined with cervical vascu-lar ultrasound provides a sensitive evaluation of changes in the systolic function of the left ventricular myocardium in patients with essential hypertension and subclinical atherosclerosis. Left ventricular function gradually decreases with the progression of subclinical atherosclerosis.
[KEY WORDS] essential hypertension; atherosclerosis; echocardiography, three-dimensional; speckle tracking imaging; ventricular function, left
原发性高血压是世界范围内影响人们生命健康的重要疾病之一,为诱发动脉粥样硬化的主要危险因素之一[1],而动脉粥样硬化作为心脑血管疾病的最重要的病理基础,可导致心肌梗死、脑卒中等一系列心脑血管不良事件的发生。研究結果表明,在初次发生心血管事件人群中约50%既往无相关临床症状[2],因此在亚临床动脉粥样硬化阶段早期明确高血压病人的心脏功能改变至关重要[3]。然而,目前对原发性高血压亚临床动脉粥样硬化病人左心室收缩功能研究匮乏。本研究拟应用三维斑点追踪成像(3D-STI)技术联合颈部血管超声,检测原发性高血压亚临床动脉粥样硬化病人左心室心肌的三维应变指标,评价原发性高血压病人亚临床动脉粥样硬化不同时期左心室功能改变,为早期防治心血管疾病提供参考。
1 资料与方法
1.1 研究对象
收集2019年11月—2020年5月就诊于青岛大学附属医院东院区的原发性高血压病人109例(研究组),后因图像质量欠佳排除19例。90例中男56例,女34例;年龄29~74岁,平均(55.9±1.0)岁。入选标准:①原发性高血压的诊断符合《中国高血压防治指南(2010年版)》标准[1];②无胸闷、胸痛等临床症状;③二维超声心动图检测左心室射血分数(LVEF)≥55%。排除标准:继发性高血压、糖尿病、冠心病、心肌病、肺源性心脏病、心脏瓣膜病、恶性肿瘤、内分泌疾病等病史病人。根据颈动脉的内-中膜层厚度(CIMT)及斑块情况,将病人分为颈动脉正常组(A组)33例、颈动脉内-中膜增厚且未见斑块组(B组)27例、颈动脉斑块形成组(C组)30例。判断标准如下。①正常:CIMT<1.0 mm;②内-中膜增厚:1.0 mm≤CIMT≤1.5 mm;③斑块[4]:CIMT>1.5 mm,或大于周围CIMT至少0.5 mm,或CIMT大于周围CIMT 50%以上,并且局部凸向动脉管腔内。另选同期在该院查体的健康者29例为对照组,其中男14例,女15例;年龄28~74岁,平均(53.3±9.0)岁。入选标准:心电图、颈部血管超声及超声心动图、生化指标等检查均无明显异常,否认高血压及冠心病病史。所有研究对象均知情同意并签署知情同意书。
1.2 检查指标及方法
1.2.1 检查设备 使用PHILIPS IE33型彩色多普勒超声诊断仪,配备L11-3探头(频率3~11 Hz)、S5-1探头(频率1~5 Hz)及X5-1探头(频率1~3 Hz),配备Tomtec分析软件。
1.2.2 颈动脉超声检查 受检者仰卧位,颈部充分暴露,头偏向对侧。使用L11-3探头,调节声束使颈总动脉前后壁清晰显示,依次扫查双侧颈总动脉及双侧颈内外动脉起始处,观察有无斑块。同时于颈总动脉分叉处下1.5 cm处后壁测量CIMT,连续测量3次,取两侧的平均值。
1.2.3 超声心动图检查 受检者左侧卧位,采用S5-1探头,嘱平静呼吸并同步连接心电图,红色、黄色导联分别连于受检者乳头连线胸骨旁左右两侧,绿色导联连于中下腹;于胸骨旁及心尖处采集二维图像,获取左心室收缩末内径(LVEDs)、左心室舒张末内径(LVEDd)、舒张末室间隔厚度(IVSd)、舒张末左心室后壁厚度(LVPWd)、相对室壁厚度(RWT)、左心房前后径(LAD)、左心室心肌质量指数(LVMI),Simpson法测量LVEF。分别用脉冲多普勒(PW)测量二尖瓣口前向血流舒张早期峰值流速E峰、舒张晚期峰值流速A峰,计算E/A;组织多普勒(TDI)测量二尖瓣瓣环侧壁侧及间隔侧舒张早期的心肌运动峰值e(取两者平均值)、收缩末期峰值(s),并计算E/e。切换X5-1探头,显示清晰完整的心尖四腔心切面,嘱病人屏气,启用Full Volu-
me模式连续采集4个心动周期的三维图像。应用Tomtec软件脱机分析,软件自动分割图像成心尖四腔心、心尖三腔心及心尖两腔心切面,手动微调至切面标准、图像清晰,选取中心尖处及二尖瓣瓣环中点,软件自动包络心内膜,手动调节勾画线使其与心内膜贴合,分析获取左心室整体纵向应变(GLS)、整体径向应变(GRS)、整体圆周应变(GCS)以及三维应变(3DS)等参数。
1.2.4 一致性检验 随机抽取29例受检者,由检查者及观察者分别测量1次,再由检查者重复测量1次,观察同一检查者与不同检查者之间测量的一致性。
1.2.5 一般临床资料 测量受检者身高、体质量,计算体质量指数(BMI);测量病人收缩压(SBP)、舒张压(DBP);询问病人病史,获取病人病程时间。
1.3 统计学分析
采用SPSS 23软件进行统计学分析。正态分布的计量资料用±s表示,组间比较先行方差齐性Levene检验,若方差齐,多组间比较采用单因素方差分析,两两比较采用LSD检验;若方差不齐,多组间比较采用welch检验,组间两两比较采用Dunnett T3检验。对于非正态分布的计量资料则采用P50(P25~P75)表示,多组间的比较采用独立样本Krusal-Wallis检验,之后进行成对比较。计数资料用例数(百分比)表示,多组间比较采用卡方检验,两两比较采用Bonferroni法Z检验。相关性分析采用Pearson及Spearman相关性分析;采用多元线性回归分析可能影响左心室GLS的因素。一致性检验采用Bland-Altman法分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组一般资料比较
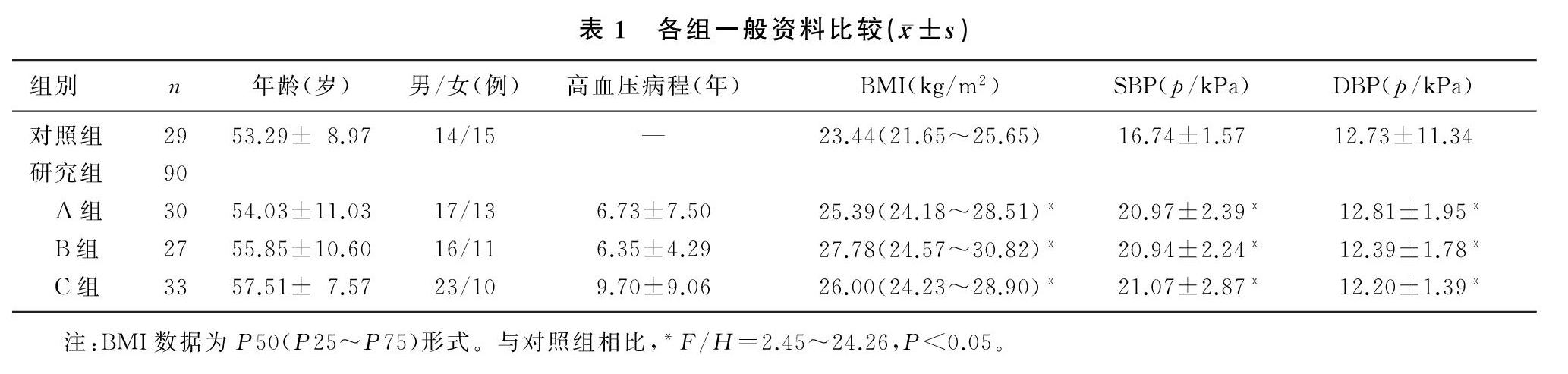
原发性高血压A组、B组、C组SBP、DBP、BMI均较对照组增高,差异均有显著性(F/H=2.45~24.26,P<0.05)。4组间年龄、性别、高血压病程差异无显著性(P>0.05)。见表1。
2.2 各组二维超声参数比较
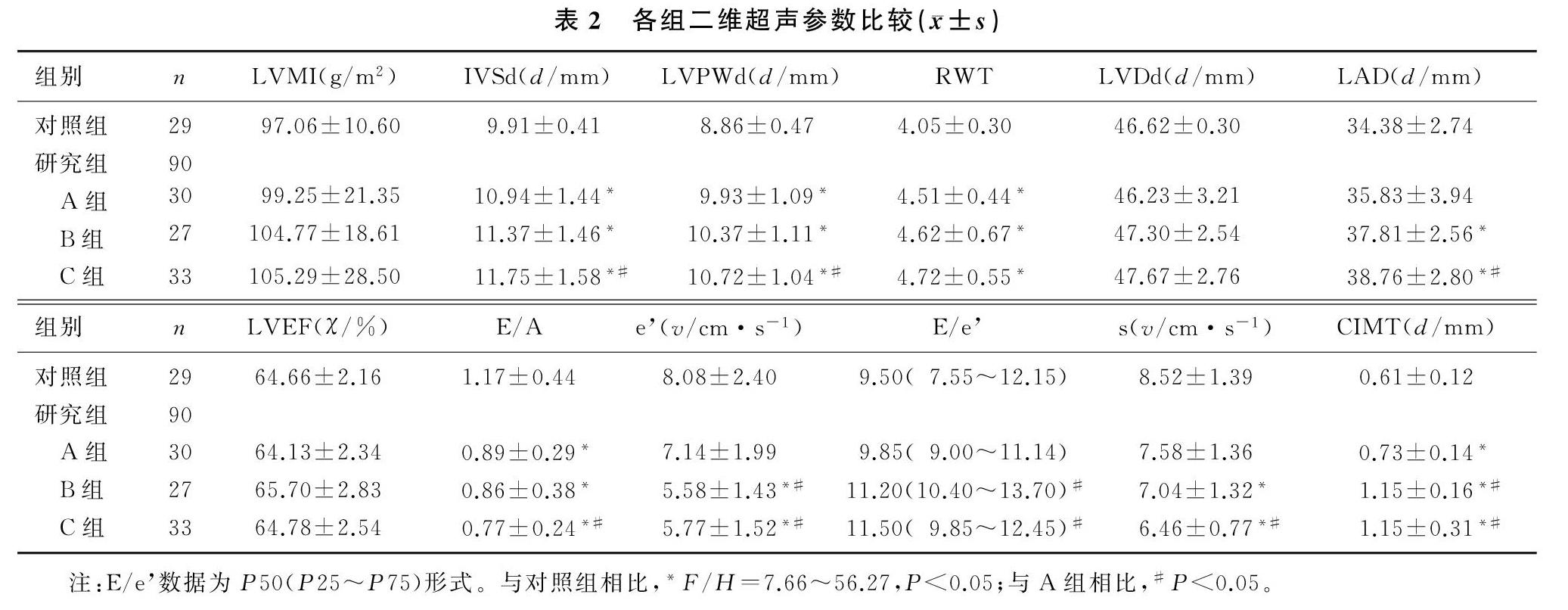
各组间LVMI、LVDd、LVEF比较差异无显著性(P>0.05)。与对照组比较,原发性高血压A组、B组、C组IVSd、LVPWd、RWT、CIMT增高,E/A减低;B组及C组LAD增高,e、s减低。与A组比较,B组及C组E/e、CIMT均增高,e均减低;C组IVSd、LVPWd、LAD增高,E/A、s減低,差异有显著性(F/H=7.66~56.27,P<0.05)。见表2。
2.3 各组三维超声参数比较
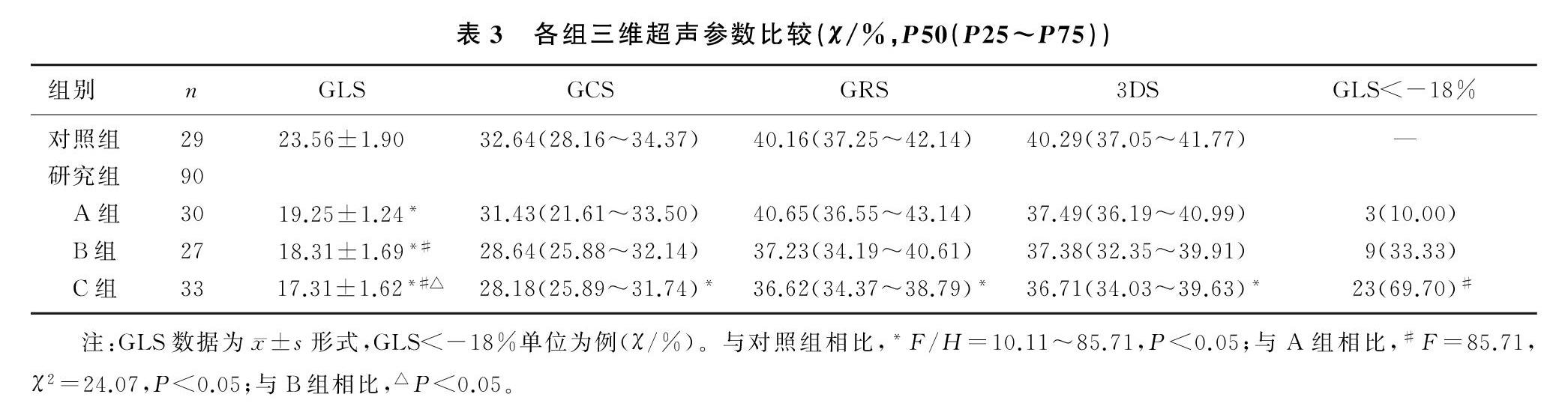
原发性高血压A组、B组、C组GLS较对照组均减低,C组GRS、GCS、3DS较对照组减低;B组、C组GLS较A组减低;C组GLS较B组减低,差异均有统计学意义(F/H=10.11~85.71,P<0.05)。原发性高血压各组GLS<-18%人数差异有显著性,其中C组人数较A组明显增多(χ2=24.07,P<0.05)。见表3。
2.4 原发性高血压病人三维超声参数相关性分析
原发性高血压病人GLS与CIMT、IVSd、颈动脉斑块中等程度均呈负相关(r=-0.560~-0.400,P<0.05);GCS、GRS、3DS与CIMT均呈弱负相关(r=―0.380~-0.270,P<0.05),与IVSd弱负相关(r=-0.260~-0.190,P<0.05);GRS与颈动脉斑块弱负相关(r=-0.210,P<0.05)。见表4。
2.5 原发性高血压病人左心室GLS影响因素的多元线性回归分析
以左心室GLS为因变量,综合既往文献中影响GLS的相关因素及本研究中的临床各相关因素,以CIMT、颈动脉斑块、SBP等参数为自变量,采用输入法进行多元线性回归分析可能影响原发性高血压病人左心室GLS的因素,结果显示CIMT、SBP、颈动脉斑块形成、LVMI对GLS有影响(β=-0.254~0.200,P<0.05,调整后R2=0.49)。见表5。
2.6 一致性检验
Bland-Altman分析GLS结果显示,同一检查者与不同检查者之间的偏移分别为-0.67、-0.78,平均差异分别为-0.67(-3.18,1.84)%、-0.87(-3.39,1.83)%,同一检查者与不同检查者检查结果一致性良好。
3 讨 论
有研究表明,高血压病人动脉硬化会导致局部心肌的收缩功能和舒张功能受损[5]。但是亚临床动脉粥样硬化时期原发性高血压病人LVEF通常处于正常水平,常规二维超声心动图难以发现左心室收缩功能的异常,难以提供有价值的信息;而3D-STI技术是斑点追踪技术与实时三维超声心动图相结合的成像技术,可通过追踪心肌的斑点运动,定量分析心肌功能,评估亚临床心肌损伤和功能障碍。另外,由于动脉粥样硬化极易累及颈动脉,并且颈部血管位置表浅,超声图像显示清晰,因此被作为观察全身动脉粥样硬化的窗口[6]。CIMT作为亚临床动脉粥样硬化的标志,可以识别早期的血管改变[7],而斑块则是动脉粥样硬化进展的特征性表现。颈部血管超声通过检测CIMT和颈动脉斑块,为诊断动脉粥样硬化存在及病变程度提供依据[8]。本研究应用3D-STI技术联合颈动脉超声评价原发性高血压亚临床动脉粥样硬化病人的心脏功能,以期辅助临床及时干预治疗。
左心室心肌结构复杂,由心内膜和心外膜的纵行心肌及中层的环形心肌组成。GLS反映了心内膜下层心肌及心外膜下层心肌的应变,中层心肌的应变指标主要为GCS和GRS。而3DS则是综合了GLS、GCS、GRS,反映了心肌在三维空间的应变能力。高血压病人由于左心室压力负荷过重,心内膜下层纵行心肌承受压力负荷最大,心肌供血易受损或不足,导致GLS最先下降。本研究中高血压各组与对照组相比GLS明显减低,而且高血压B组、C组GLS较A组减低,说明早在颈动脉尚未出现亚临床动脉粥样硬化时,高血压病人左心室的收缩功能已经减低,与既往研究结果一致[9]。动脉粥样硬化致动脉僵硬度增高,动脉僵硬度的增高和动脉粥样硬化的进展密切相关[10]。本文原发性高血压B组、C组病人随着动脉僵硬度增加,左心室后负荷加重,左心室心肌代偿性做功,导致心肌肥厚;在神经激素的刺激下,心肌纤维化[11-12],继而心肌僵硬度增加,心肌灌注受损,从而导致左心室功能障碍且逐渐加重。本研究显示B组及C组病人IVSd、LVPWd增大、GLS减低,说明随着动脉粥样硬化病情的进展,高血压病人左心室重构的同时左心室纵向收缩功能损伤逐渐加重,颈动脉斑块形成后尤为显著。另外,本文原发性高血压C组病人的GLS、GRS、GCS、3DS较对照组明显减低,提示颈动脉斑块形成病人全层心肌纤维受损,可能出现透壁性损伤[13],这与相关研究结果相符[14]。有研究显示,颈动脉斑块与冠状动脉粥样硬化病变支数强相关[15],因而不除外颈动脉斑块形成病人伴发隐性冠状动脉疾病的可能。以GLS<-18%作为亚临床左心室收缩功能异常的诊断标准[16],本文原发性高血压C组左心室收缩功能异常人数明显增多,也反映了随着颈动脉粥样硬化的进展高血压病人左心室收缩功能障碍加剧。EVENSEN等[17]利用二维斑点追踪技术研究显示,CIMT与左心室心肌应变的减低相关。本文结果与其一致。分析原因可能为:高血压病人动脉管壁平滑肌细胞增生及胶原蛋白沉积引起CIMT增大,管壁动脉僵硬度增加,最终导致心脏功能受损。本文多元线性回归分析可能影响原发性高血压病人GLS的因素,结果显示CIMT、SBP、LVMI、颈动脉斑块对GLS均有影响。分析原因,有以下几个方面。①LVMI是评价心脏重构的重要指标。高血压病人心脏重构,冠状动脉微循环障碍,首先影响心内膜下纵行心肌的收缩功能。②有研究表明,血压水平与心脑血管疾病的发病率及死亡率间存在密切的因果关系[18],而高的血压水平是高血压病人心脏收缩功能早期损伤的独立危险因素[19]。③有研究发现,GLS受动脉僵硬度的影响最大,而动脉粥样硬化与动脉僵硬度密切相关[20]。本文研究结果显示,CIMT、颈动脉斑块与GLS负相关。
高血压病人左心室僵硬度增加、心肌顺应性减低,左心室被动充盈受限,左心房被动排空功能及管道功能减弱[21],左心室舒张功能发生障碍。随着颈动脉粥样硬化的进展,动脉僵硬度增加,脉压差增大,加重左心室后负荷,导致LVMI增加及冠状动脉灌注受损,进一步降低舒张功能。本文原发性高血压B组和C组E/e、LAD较A组增高,说明颈动脉粥样硬化病人左心室舒张功能障碍程度重于颈动脉正常者,与相关研究结果一致[8]。有研究显示,动脉僵硬度增高、心肌灌注受损、左心室僵硬度增高都可能与左心室舒张功能减低的发生机制相关[22-23]。本研究从侧面证实了上述观点。另外,本文研究显示,原发性高血压C组s值较A组明显减低,提示颈动脉斑块形成病人左心室收缩功能受损。本文原发性高血压颈动脉亚临床动脉粥样硬化B组、C组病人左心室收缩功能受损迟于舒张功能下降,与相关研究结果一致[24-25]。
综上所述,应用3D-STI技术联合颈部血管超声检查可以早期发现原发性高血压亚临床动脉粥样硬化病人左心室的功能改变,以评估亚临床动脉粥样硬化不同时期心肌的损伤程度,为心血管疾病的防治提供参考。本研究的局限性:研究样本量小,颈动脉斑块及颈动脉僵硬度缺乏定量研究,有待日后完善。另外,由于3D-STI技術所限,在心肌大幅度及快速运动时可能存在信息丢失,从而影响结果的准确性。
[参考文献]
[1]刘力生. 中国高血压防治指南2010[J]. 中华高血压杂志, 2011,19(8):701-743.
[2]WEBER L A, CHEEZUM M K, REESE J M, et al. Cardiovascular imaging for the primary prevention of atherosclerotic cardiovascular disease events[J]. Current Cardiovascular Imaging Reports, 2015,8(9):1-13.
[3]王继业,江亚文. 亚临床动脉粥样硬化病变的无创检测及其临床意义[J]. 中华保健医学杂志, 2008,10(3):233-235.
[4]中华医学会健康管理学分会,中华医学会超声医学分会,中华医学会心血管病学分会,等. 中国健康体检人群颈动脉超声检查规范[J]. 中华健康管理学杂志, 2015,9(4):254-260.
[5]HWANG J W, KANG S J, LIM H S, et al. Impact of arterial stiffness on regional myocardial function assessed by speckle tracking echocardiography in patients with hypertension[J]. Journal of Cardiovascular Ultrasound, 2012,20(2):90-96.
[6]张辉,余舒杰,毛永江,等. 颈动脉内膜中层厚度测量和超声回 声跟踪技术检测高脂蛋白(a)血症家族成员颈动脉粥样硬化程度研究[J]. 中国全科医学, 2015,18(30):3759-3762,3768.
[7]AGHAYAN M, ASGHARI G, YUZBASHIAN E, et al. Association of nuts and unhealthy snacks with subclinical atherosclerosis among children and adolescents with overweight and obesity[J]. Nutrition & Metabolism, 2019,16:23.
[8]周滨瑜,王静,谢明星,等. 超声评价亚临床动脉粥样硬化患者颈动脉与左心室功能的初步研究[J]. 中华超声影像学杂志, 2017(5):381-386.
[9]李颖,丁明岩,赵含章,等. 三维斑点追踪成像评价射血分数正常的高血压病患者左室收缩功能[J]. 临床超声医学杂志, 2019,21(6):414-417.
[10]TOMIYAMA H, ISHIZU T, KOHRO T, et al. Longitudinal association among endothelial function, arterial stiffness and subclinical organ damage in hypertension[J]. International Journal of Cardiology, 2018,253:161-166.
[11]KIM D, SHIM C Y, HONG G R, et al. Differences in left ventricular functional adaptation to arterial stiffness and neurohormonal activation in patients with hypertension: a study with two-dimensional layer-specific speckle tracking echocardiography[J]. Clinical Hypertension, 2017,23:21.
[12]曾定尹,王永. 冠狀动脉微循环解剖、生理和病理学认识与展望[J]. 内科理论与实践, 2017,12(1):33-36.
[13]孙娟娟,王志斌,何香芹,等. 三维斑点追踪成像评价血压控制程度对高血压患者早期收缩功能的影响[J]. 中华高血压杂志, 2019,27(3):283-286.
[14]CHAHAL N S, LIM T K, JAIN P, et al. The distinct relationships of carotid plaque disease and carotid intima-media thickness with left ventricular function[J]. Journal of the American Society of Echocardiography, 2010,23(12):1303-1309.
[15]李景,张明智,张循,等. 颈动脉粥样斑块超声指标与冠状动脉粥样硬化的相关性分析[J]. 中国循证心血管医学杂志, 2018,10(5):581-584.
[16]LANG R M, BADANO L P, MOR-AVI V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging[J]. Journal of the American Society of Echocardiography: Official Publication of the American Society of Echocardiography, 2015,28(1):1-39.e14.
[17]EVENSEN K, SARVARI S I, RNNING O M, et al. Caro-
tid artery intima-media thickness is closely related to impaired left ventricular function in patients with coronary artery di-
sease: a single-centre, blinded, non-randomized study[J]. Cardiovascular Ultrasound, 2014,12(1):1-7.
[18]NCD RISK FACTOR COLLABORATION (NCD-RISC). Worldwide trends in blood pressure from 1975 to 2015: a pooled analysis of 1 479 population-based measurement studies with 19.1 million participants[J]. Lancet (London, England), 2017,389(10064):37-55.
[19]CHEN X J, SUN X L, ZHANG Q, et al. Uncontrolled blood pressure as an independent risk factor of early impaired left ventricular systolic function in treated hypertension[J]. Echocardiography (Mount Kisco, N Y), 2016,33(10):1488-1494.
[20]SILVESTRINI M, CAGNETTI C, PASQUALETTI P, et al. Carotid wall thickness and stroke risk in patients with asymptomatic internal carotid Stenosis[J]. Atherosclerosis, 2010,210(2):452-457.
[21]張淼,李一丹,吴小朋,等. 高血压合并左室舒张功能障碍患者左房时相功能及机械离散度的临床研究[J]. 中国超声医学杂志, 2020,36(5):417-420.
[22]MYUNG Y, SEO H S, JUNG I H, et al. The correlation of carotid artery stiffness with heart function in hypertensive patients[J]. Journal of Cardiovascular Ultrasound, 2012,20(3):134-139.
[23]KIM G, KIM J H, MOON K W, et al. The relationships between the arterial stiffness index measured at the radial artery and left ventricular diastolic dysfunction in asymptomatic high risk patients without atherosclerotic cardiovascular disease[J]. International Heart Journal, 2016,57(1):73-79.
[24]陈晓栋,王璎瑛. 老年人颈动脉内中膜厚度及斑块与左心室功能的相关性研究[J]. 实用老年医学, 2018,32(12):1134-1137.
[25]KHOURI S J, MALY G T, SUH D D, et al. A practical approach to the echocardiographic evaluation of diastolic function[J]. Journal of the American Society of Echocardiography, 2004,17(3):290-297.
(本文编辑 黄建乡)

