雷公藤乙素对糖尿病肾病大鼠肾组织p-p38MAPKTNF-α及IL-1β表达的影响
杨 朔,胡俊华,王亚娟,王吉娜,胡 蕾
(舟山市中医院肾内科·浙江 舟山 316000)
雷公藤又名断肠草,因其副作用较大,临床应用较为局限。现代药理学研究表明其具有消炎、抗肿瘤、抗菌、止痛和免疫抑制等作用[1-3]。相关研究证明雷公藤中的雷公藤甲素、雷公藤红素等成分对风湿免疫系统疾病及肾脏疾病有良好治疗作用,尤其在糖尿病肾病[4]、急慢性肾小球肾炎[5]等方面疗效显著。笔者前期研究发现,雷公藤乙素能影响减少转化生长因子β1(TGF-β1)表达,减少蛋白尿,修复和保护肾脏[6]。为进一步探讨其对肾功能损伤信号传递机制的影响,本文观察了雷公藤乙素对糖尿病肾病模型大鼠肾组织p-p38MAPK、TNF-α及IL-1β的影响。报道如下。
1 实验材料
1.1 实验动物 健康雄性SD大鼠30 只,8 周龄,体质量180~200 g,由上海中医药大学实验动物中心提供,动物生产许可证号:SCXK(沪)2017-0005。保持室温为(22±2)℃,模拟昼夜每12 h更换一次光照条件,动物自由摄食与饮水。
1.2 药物及试剂 雷公藤乙素:上海保藏生物科技中心,CAS编号:38647-10-8,20mg/支;制成浓度为0.025g/L溶液,4℃冰箱密封存放。链状佐菌素(STZ):美国Sigma公司;大鼠p-p38MAPK抗体:美国Cell Signaling Technology 公司;RIPA 裂解液、磷酸盐缓冲液:上海碧云天公司;尿蛋白含量检测试剂盒:宁波美康生物科技股份有限公司;TNF-α及IL-1β免疫组织化学试剂盒:北京博奥森公司。
1.3 主要仪器 血糖仪(Accu-chek Active Modle GB):罗氏公司;7600全自动生化分析仪:日本HITACHI;InfiniteM200 Pro多功能酶标仪:瑞士 Tecan;,倒置显微镜:日本 Olympus;凝胶成像分析仪:美国UVP;MRZ14M010型高速冷冻离心机:美国Beckman公司。
2 实验方法
2.1 动物分组、模型制作与给药 雄性SD大鼠30只,随机分为正常对照组、模型组、雷公藤乙素组,各组均为10 只。正常对照组予普通饲料喂养,其余予高脂高糖饲料(普通饲料中加20%葡萄糖、10%猪油、2.5%胆固醇及1%胆酸钠)。喂饲4 周后,禁食不禁水12 h,大鼠一次性腹腔内注射STZ(40 mg/kg),建立糖尿病肾病大鼠模型,正常对照组一次性腹腔内注射等体积的柠檬酸缓冲液。继续喂养4 周后,检测血糖和24 h尿蛋白定量,以连续3次随机血糖≥16.7 mmol/L,24 h尿蛋白定量大于30 mg[7],表示DN建模成功。造模成功后,雷公藤乙素组予雷公藤乙素溶液200μg/(kg·d)灌胃,模型组、正常组大鼠等容积生理盐水灌胃,每日1 次,连续灌胃8 周。
2.2 观察指标及检测方法
2.2.1 24 h尿蛋白定量 各组大鼠末次给药后,收集24 h尿液,测定各组24 h尿蛋白量。
2.2.2 空腹血糖及BUN、SCr 各组大鼠末次给药12 h后,利用血糖仪尾静脉取血检测其空腹血糖。水合氯醛腹腔麻醉后,腹主动脉取血离心处理后,全自动生化分析仪测定大鼠血清BUN及SCr水平。
2.2.3 肾组织病理学变化观察 取肾组织10%福尔马林固定24 h后,常规石蜡包埋,切片厚度5μm,经脱蜡、复水、染色、封片,光镜观察肾小管、肾小球、肾间质。
2.2.4 肾组织TNF-α、IL-1β表达的免疫组化检测 按程序制作玻璃切片后,脱蜡、脱水,PBS缓冲液冲洗,3%双氧水灭活过氧化酶,使用稀释的山羊血清封闭液,处理完毕后再向切片中滴加缓冲液稀释的一抗(一抗的稀释:TNF-α、IL-1β与灭菌蒸馏水分别按比例进行充分溶解,进行分装),再次二抗稀释,处理后按程序冲洗、染色,制作中性树脂封片。棕褐色颗粒表面为阳性结果。于40×视野下摄影,每组每张切片随机选取5个视野,用 ImageJ图像分析软件进行分析,测定每视野中平均光密度值。
2.2.5 肾组织p-p38MAPK蛋白表达的Western Blot检测 肾组织称重后加入组织裂解液(RIPA)及蛋白酶抑制剂制备组织匀浆,离心后收集上清液,提取细胞总蛋白,测定蛋白浓度。组织蛋白经分离,将蛋白电转移至硝酸纤维膜,0.5%的牛血清白蛋白非特异封闭,加入抗大鼠p-p38MAPK抗体,37 ℃孵育2 h后4 ℃孵育过夜,再IgG二抗室温孵育1 h,PBS缓冲液冲洗,化学发光剂进行曝光。凝胶图像分析系统扫描分析条带的面积,内参蛋白选用GAPDH。
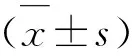
3 结果
3.1 各组大鼠24 h尿蛋白定量、血糖、BUN、SCr检测结果 见表1。
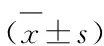
表1 各组大鼠24 h尿蛋白定量、血糖、BUN、SCr比较
3.2 各组大鼠肾组织病理观察结果 正常对照组:肾脏皮髓质界限清楚,肾小球和肾小管结构正常。模型组:肾脏皮质变薄,皮髓质界限不清,肾小球系膜细胞和基质弥漫增生,部分毛细血管腔狭窄,肾小管灶状萎缩,间质炎性细胞浸润伴纤维化。雷公藤乙素组:肾脏皮质厚度较模型组明显改善,肾小球系膜细胞及基质增生好转,毛细血管襻未见缺血皱缩,肾小管上皮细胞轻度水肿,间质纤维增生明显好转。见图1。
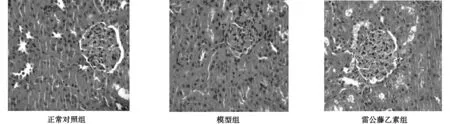
图1 各组大鼠肾组织病理观察(HE,×400)
3.3 各组大鼠肾组织TNF-α、IL-1β蛋白表达的免疫组化结果 正常对照组TNF-α、IL-1β在肾小球系膜细胞、肾小球或肾小管上皮细胞内表达极少;模型组TNF-α、IL-1β在肾小球系膜细胞、肾小球或肾小管上皮细胞内表达显著增强;雷公藤乙素组TNF-α、IL-1β在肾小球系膜细胞、肾小球或肾小管上皮细胞内表达程度明显低于模型对照组。见表2,图2~图3。
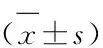
表2 各组大鼠肾组织TNF-α、IL-1β蛋白表达平均光密度值比较
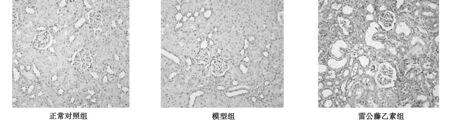
图2 各组大鼠肾组织TNF-α蛋白表达的免疫组化检测结果(×400)
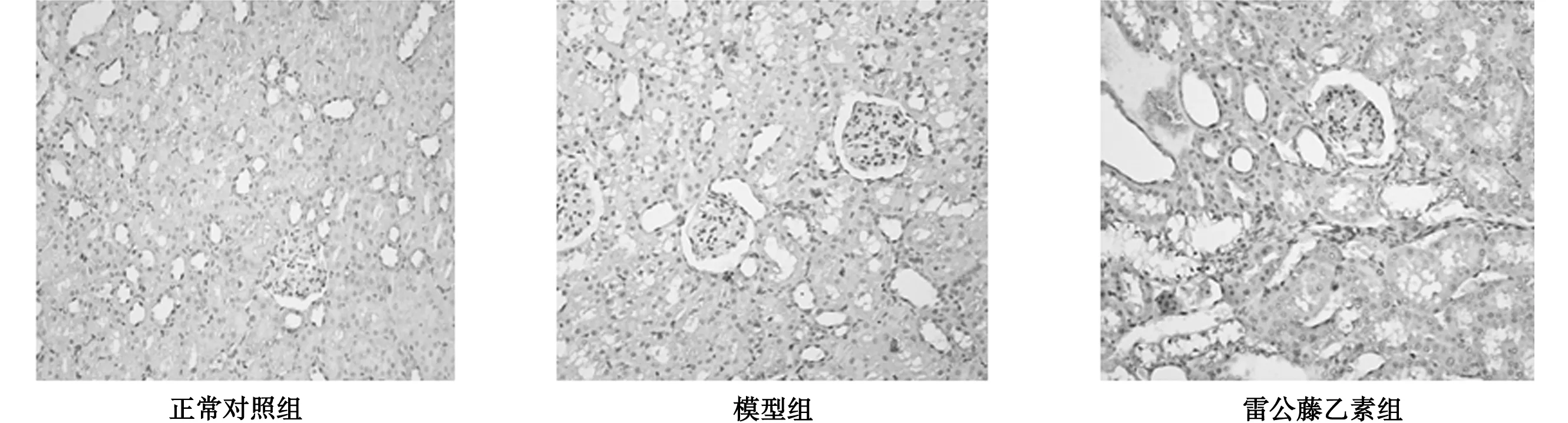
图3 各组大鼠肾组织IL-1β蛋白表达的免疫组化检测结果(×400)
3.4 各组大鼠肾组织p-p38MAPK蛋白表达的Western blot检测结果 与对照组比较,模型组肾组织p-p38MAPK表达显著增强,雷公藤乙素组较模型组表达有所减弱。见图4,表4。

图4 各组大鼠肾组织p-p38MAPK蛋白表达的Western blot检测结果

组别动物数(只)p-p38MAPK正常组100.24±0.018模型组100.66±0.036**雷公藤乙素组100.41±0.038*▲
4 讨论
糖尿病肾病的发生是一个漫长的病理过程,机制较为复杂,最终导致大量蛋白尿、肾小球硬化、肾功能衰竭。众多临床及实验研究都提示炎症是肾功能恶化的重要因素。在高血糖的状态下,肾组织的炎症通过多种信号途径启动,其中p38MAPK信号通路是较为经典的炎症信号通路,一旦此信号通路被激活,就会加速糖尿病肾病的病程。p38MAPK信号传导通路被活化后,可以通过磷酸化不同的转录因子,包括核因子κB(NF-κB)等,能够间接或直接导致炎症因子(如白细胞介素-1(IL-1)、TNF-α)等的产生,参与疾病炎症反应[8]。在DN中,TGF-β1通过TAK1-MKK6途径活化下游P38MAPK-NF-κB 通路,使 TNF-α、IL-1、白介素6(IL-6)、白介素8(IL-8)等炎性因子表达增多,同时这些炎性因子又可激发p38MAPK信号通路,形成恶性循环,引发肾脏炎症反应,促进DN发展。在肾损伤早期,IL-1β能够通过提高白细胞CD11/CD18的表达水平、促进内皮细胞ICM-1表达等方式召集炎症细胞进入肾间质[9]。祝胜郎[10]等发现,在糖尿病小鼠肾组织和高糖刺激下的肾小管上皮细胞中,磷酸化p38MAPK、TGF-β1在蛋白表达和mRNA转录水平均显著增强,而且在肾小球肥大、肾小管-间质纤维化损害的病理过程中都发挥着重要作用;提示p38MAPK信号转导通路可能通过与TGF-β1的相互作用共同参与了糖尿病肾病肾小管上皮间质化和肾脏组织纤维化的发生发展。研究发现通过抑制p38MAPK磷酸化,可抑制促炎因子的释放,延缓糖尿病肾病的进展[11]。因此阻断其在关键过程p-p38MAPK磷酸化的表达、抑制炎症因子是当前研究的热点。
本研究发现给药8 周后,雷公藤乙素组肾功能指标及蛋白尿较模型组均有明显好转;光镜观察提示肾小球系膜细胞增生及肾小管水肿均减轻;肾组织TNF-α、IL-1β表达明显弱于模型组,肾组织p-p38MAPK蛋白表达较模型组下降。综上所述,雷公藤乙素降低尿蛋白排泄,保护肾功能、延缓肾损害可能与其抑制炎性因子TNF-α、IL-1β的表达及抑制p-p38MAPK信号通路活化有关。雷公藤乙素有望成为下一个潜在治疗糖尿病肾病的药物。

