龙胆苦苷对H22 肝癌小鼠肿瘤生长抑制及抗血管生成的分析
张志恒,贾海燕,崔朝初,张莹雪
(1.聊城市中医医院肿瘤科,山东聊城 252000;2.河南科技大学医学院,河南洛阳 471000;3.山东中医药大学药学院, 济南 250355)
肝癌在我国高发,具有预后差、易转移复发、生存时间较短及恶性程度高等特点,在肿瘤引起的相关死亡中高居第2 位[1]。 化学治疗是治疗肝癌的常用手段,但常导致消化道及肝、肾损伤、骨髓抑制,并出现白细胞减少、便秘、腹痛腹泻、食欲不振、恶心呕吐等不良反应[2]。 龙胆苦苷是我国传统中药龙胆草及秦艽中的主要活性物质,属于环烯醚萜苷类化合物,具有健胃利胆、抗病原微生物、抗炎及保肝等多种药理作用[3]。 体外实验发现[4-7],龙胆苦苷对人卵巢癌及肝癌细胞等的增殖有抑制作用,但关于龙胆苦苷的体内抗肿瘤作用研究未见报道。因此,本研究以H22肝癌小鼠为研究对象,主要探讨龙胆苦苷对H22肝癌小鼠肿瘤生长抑制及抗血管生成分析,以期为进一步的临床应用奠定基础。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF 级 KM 雄性小鼠 60 只,体重 20~22 g,来源于北京维通利华公司[SCXK(京) 2017-0033]。 无菌手术在山东大学实验动物中心进行[SYXK(鲁)2019-0005]。 本实验获我院伦理委员会审批通过(LCZYYY2020012707),并按实验动物使用的3R 原则给予人道的关怀。
1.1.2 细胞
肝癌H22细胞,购于中国科学院上海细胞库。
1.2 主要试剂与仪器
龙胆苦苷为南京道斯夫公司产品,批号181116A,纯度>95%;干扰素-γ(IFN-γ)、白细胞介素-2(IL-2)酶联免疫吸附法(ELISA)检测试剂盒,购于深圳达科为生物公司,批号分别为20180516、20180427;兔抗鼠碱性成纤维生长因子(bFGF)、转化生长因子-β(TGF-β)、血管内皮生长因子(VEGF)、磷脂酰肌醇-3 激酶(PI3K)、磷酸化PI3K(p-PI3K)、蛋白激酶B(Akt)及磷酸化Akt(p-Akt)抗体均购于美国 Abcam 公司, 批号分别为ab246354、ab229856、ab69479、ab154598、ab182651、ab8805、ab38449。 Epoch 型酶标仪,美国 Bio-tek 公司;蛋白电泳及转膜仪,美国Bio-Rad 公司。
1.3 实验方法
1.3.1 H22肝癌小鼠模型的建立
将培养至对数生长期的H22细胞接种于KM 小鼠,7 d 后抽取腹水,经D-Hanks 液洗涤后离心,并调整细胞悬液密度为每毫升5.0×106个。 在小鼠右腋皮下注射上述细胞悬液0.2 mL,建立H22肝癌小鼠模型。
1.3.2 分组及给药
造模后将小鼠按体重随机分为4 组,分别为模型组、龙胆苦苷低、高剂量组(50 mg/kg、100 mg/kg)及阳性药物环磷酰胺组(20 mg/kg),每组10 只;另选取10 只健康小鼠,作为正常组。 分组后第2 天开始给药,龙胆苦苷低、高剂量组灌胃给药,每天一次;环磷酰胺组腹腔注射给药,隔天一次;正常组及模型组灌胃等体积的生理盐水。 给药周期为14 d,记录造模前及治疗14 d 后的各组小鼠体重。
1.3.3 瘤重、抑瘤率、胸腺指数和脾指数测定
在末次给药后24 h,各组小鼠采用颈椎脱臼法处死。 剥离肿瘤组织及胸腺、脾,滤纸拭去表面残余血液后,电子天平精密称重。 按下式分别计算抑瘤率、胸腺指数和脾指数。

1.3.4 ELISA 法测定各组小鼠血清 IFN-γ 及 IL-2含量
各组小鼠在处死前,取血,分离血清。 按照ELISA 检测试剂盒说明书中的操作步骤,分别检测各组小鼠血清IFN-γ 及IL-2 含量。
1.3.5 蛋白免疫印迹法测定各组小鼠瘤组织相关蛋白表达
采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳进行目的蛋白的分离。 电泳完成后,常规操作转膜,其中兔抗鼠 bFGF、TGF-β、VEGF、PI3K、p-PI3K、Akt、p-Akt 及 β-actin 抗体,均为 1 ∶1000 倍稀释,二抗为1 ∶2000 倍稀释。 采用电化学发光法显色并拍照,蛋白条带灰度值经Image J 软件分析后,计算各组目的蛋白相对表达量。
1.4 统计学方法
采用SPSS 19.0 软件进行分析与统计,所得数据均用“平均数±标准差()”表示,独立样本t检验用于两组数据比较,单因素方差分析用于多组数据比较。P<0.05,差异具有统计学意义。
2 结果
2.1 龙胆苦苷对各组小鼠体重变化的影响
造模前各组小鼠体重无明显变化(P>0.05);治疗14 d 后,与正常组及H22肝癌模型组比较,龙胆苦苷低、高剂量组小鼠体重无明显变化(P>0.05),而环磷酰胺组小鼠体重明显降低(P<0.01)。 结果见表1。
表1 龙胆苦苷对各组小鼠体重变化的影响(,n=10)Table 1 Effects of gentiopicroside on body weight of mice in each group

表1 龙胆苦苷对各组小鼠体重变化的影响(,n=10)Table 1 Effects of gentiopicroside on body weight of mice in each group
注:与正常组比较,bP<0.01;与模型组比较,dP<0.01。Note. Compared with the normal group, bP<0.01. Compared with the model group, dP<0.01.
组别Groups剂量(mg/kg)Dose体重(g)Body weight造模前Before model establishment治疗14 d 后After 14 d treatment正常组Normal group / 20.04±2.42 32.72±3.57模型组Model group / 19.86±2.39 33.53±4.06龙胆苦苷低剂量组Gentiopicroside low does group 50 19.67±1.87 31.61±3.32龙胆苦苷高剂量组Gentiopicroside high does group 100 20.25±2.18 30.87±3.13环磷酰胺组Cyclophosphamide group 20 20.13±1.95 22.41±2.86b,d
2.2 龙胆苦苷对各组小鼠瘤重及抑瘤率的影响
与H22肝癌模型组比较,龙胆苦苷低、高剂量组及环磷酰胺组小鼠瘤重均明显降低(P<0.01),龙胆苦苷低、高剂量组及环磷酰胺组小鼠的抑瘤率分别为30.43%、42.93%及69.2%。 结果见表2。
表2 龙胆苦苷对各组小鼠瘤重及抑瘤率的影响(,n=10)Table 2 Effects of gentiopicroside on tumor weight and tumor inhibition rate of mice in each group
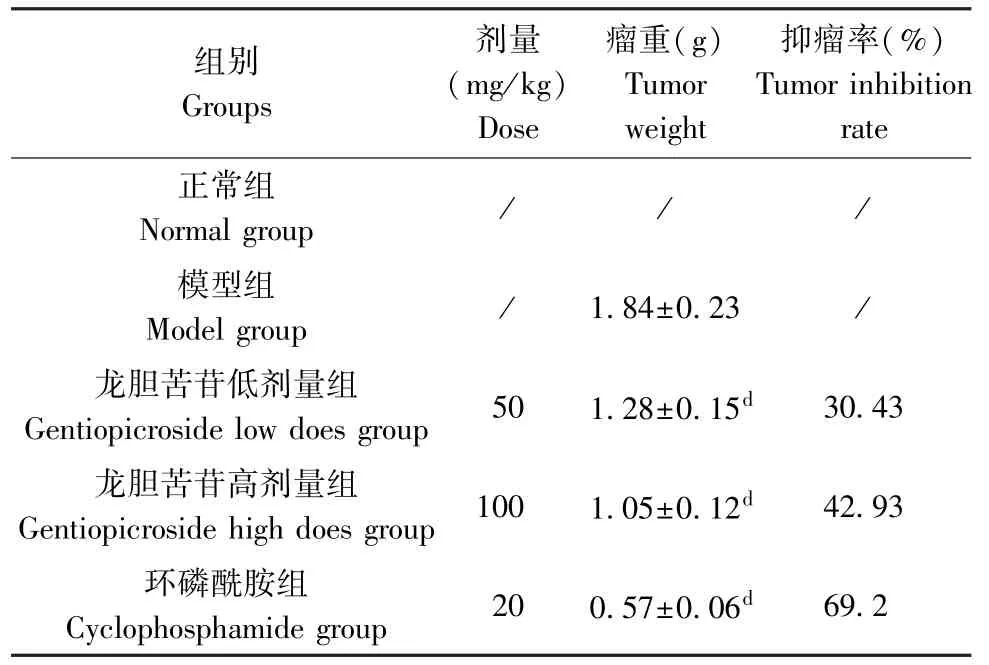
表2 龙胆苦苷对各组小鼠瘤重及抑瘤率的影响(,n=10)Table 2 Effects of gentiopicroside on tumor weight and tumor inhibition rate of mice in each group
注:与模型组比较,dP<0.01。Note. Compared with the model group, dP<0.01.
组别Groups剂量(mg/kg)Dose瘤重(g)Tumor weight抑瘤率(%)Tumor inhibition rate正常组Normal group / / /模型组Model group / 1.84±0.23 /龙胆苦苷低剂量组Gentiopicroside low does group 50 1.28±0.15d 30.43龙胆苦苷高剂量组Gentiopicroside high does group 100 1.05±0.12d 42.93环磷酰胺组Cyclophosphamide group 20 0.57±0.06d 69.2
2.3 龙胆苦苷对各组小鼠胸腺指数和脾指数的影响
与正常组比较,H22肝癌模型组小鼠胸腺指数及脾指数无明显变化(P>0.05),龙胆苦苷低、高剂量组小鼠胸腺指数及脾指数明显升高(P<0.01),而环磷酰胺组小鼠胸腺指数及脾指数明显降低(P<0.01);与H22肝癌模型组比较,龙胆苦苷低、高剂量组小鼠胸腺指数及脾指数明显升高(P<0.01),而环磷酰胺组小鼠胸腺指数及脾指数明显降低(P<0.05或P<0.01)。 结果见表3。
表3 龙胆苦苷对各组小鼠胸腺指数和脾指数的影响(,n=10)Table 3 Effects of gentiopicroside on thymus index and spleen index of mice in each group
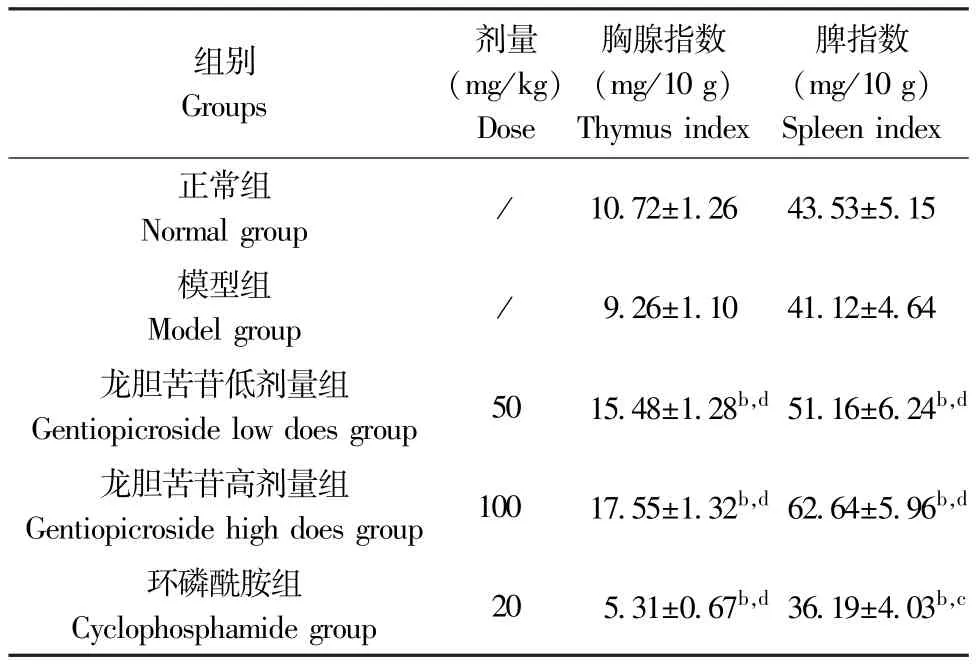
表3 龙胆苦苷对各组小鼠胸腺指数和脾指数的影响(,n=10)Table 3 Effects of gentiopicroside on thymus index and spleen index of mice in each group
注:与正常组比较,bP<0.01;与模型组比较,cP<0.05,dP<0.01。Note. Compared with the normal group, bP<0.01. Compared with the model group, cP<0.05, dP<0.01.
组别Groups剂量(mg/kg)Dose胸腺指数(mg/10 g)Thymus index脾指数(mg/10 g)Spleen index正常组Normal group / 10.72±1.26 43.53±5.15模型组Model group / 9.26±1.10 41.12±4.64龙胆苦苷低剂量组Gentiopicroside low does group 50 15.48±1.28b,d 51.16±6.24b,d龙胆苦苷高剂量组Gentiopicroside high does group 100 17.55±1.32b,d 62.64±5.96b,d环磷酰胺组Cyclophosphamide group 20 5.31±0.67b,d 36.19±4.03b,c
2.4 龙胆苦苷对各组小鼠血清IFN-γ 及IL-2 含量的影响
与正常组比较,H22肝癌模型组、龙胆苦苷低、高剂量组及环磷酰胺组小鼠血清IFN-γ、IL-2 含量均明显降低(P<0.05 或P<0.01);与H22肝癌模型组比较,龙胆苦苷低、高剂量组小鼠血清IFN-γ、IL-2 含量明显升高(P<0.05 或P<0.01),而环磷酰胺组小鼠血清IFN-γ、IL-2 含量明显降低(P<0.01)。 结果见表4。
表4 龙胆苦苷对各组小鼠血清IFN-γ 及IL-2 含量的影响(,n=10)Table 4 Effects of gentiopicroside on serum IFN-γ and IL-2 contents of mice in each group
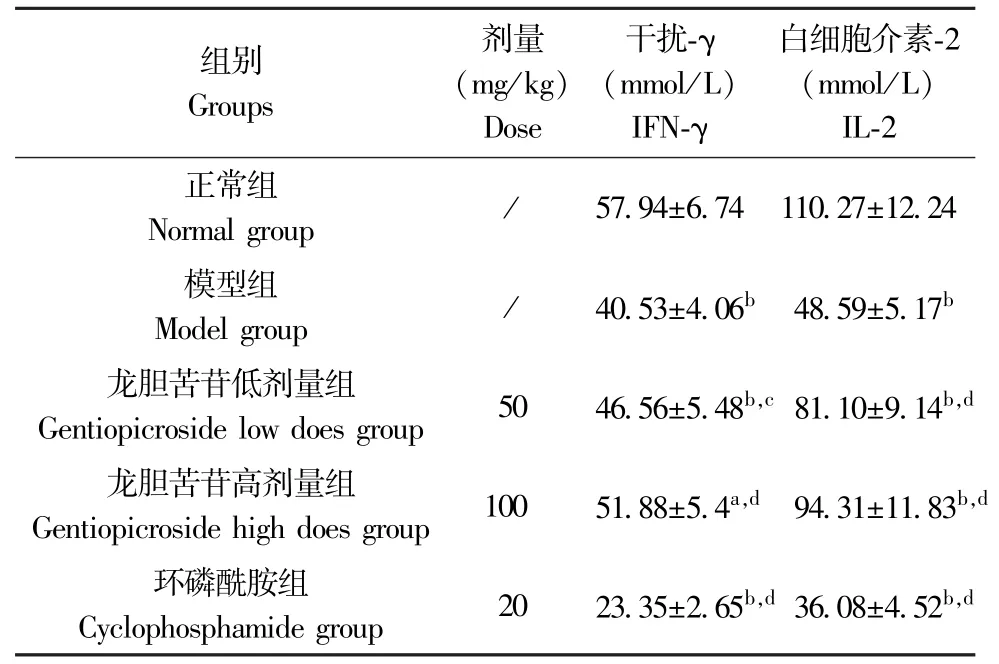
表4 龙胆苦苷对各组小鼠血清IFN-γ 及IL-2 含量的影响(,n=10)Table 4 Effects of gentiopicroside on serum IFN-γ and IL-2 contents of mice in each group
注:与正常组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01。Note. Compared with the normal group, aP<0.05,b P<0.01. Compared with the model group, cP<0.05, dP<0.01.
组别Groups剂量(mg/kg)Dose干扰-γ(mmol/L)IFN-γ白细胞介素-2(mmol/L)IL-2正常组Normal group / 57.94±6.74 110.27±12.24模型组Model group / 40.53±4.06b 48.59±5.17b龙胆苦苷低剂量组Gentiopicroside low does group 50 46.56±5.48b,c 81.10±9.14b,d龙胆苦苷高剂量组Gentiopicroside high does group 100 51.88±5.4a,d 94.31±11.83b,d环磷酰胺组Cyclophosphamide group 20 23.35±2.65b,d 36.08±4.52b,d
2.5 龙胆苦苷对各组小鼠瘤组织bFGF、TGF-β 及VEGF 表达的影响
与H22肝癌模型组比较,龙胆苦苷低、高剂量组及环磷酰胺组小鼠瘤组织bFGF、TGF-β 及VEGF 表达均明显降低(P<0.01)。 结果见图1 和表5。

图1 蛋白免疫印迹法检测龙胆苦苷对各组小鼠瘤组织 bFGF、TGF-β 及 VEGF 表达的影响Note. A, Model group. B, Gentiopicroside low does group.C, Gentiopicroside high does group. D, Cyclophosphamide group.Figure 1 Effects of gentiopicroside on the expressions of bFGF,TGF-β and VEGF in tumor tissues of mice in each group by Western blot
表5 龙胆苦苷对各组小鼠瘤组织bFGF、TGF-β 及VEGF 表达的影响(,n=10)Table 5 Effects of gentiopicroside on the expressions of bFGF,TGF-β and VEGF in tumor tissues of mice in each group
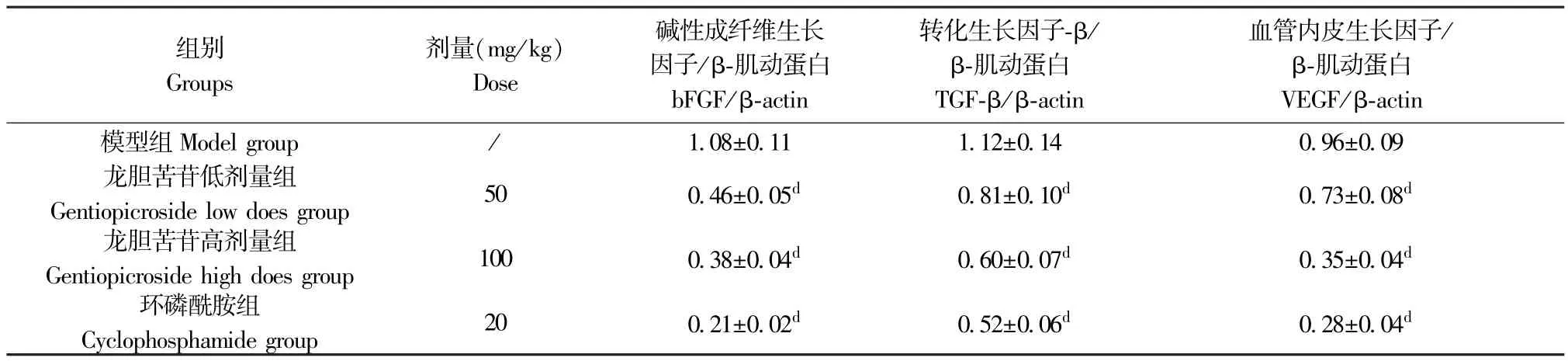
表5 龙胆苦苷对各组小鼠瘤组织bFGF、TGF-β 及VEGF 表达的影响(,n=10)Table 5 Effects of gentiopicroside on the expressions of bFGF,TGF-β and VEGF in tumor tissues of mice in each group
注:与模型组比较,dP<0.01。Note. Compared with the model group, dP<0.01.
组别Groups剂量(mg/kg)Dose碱性成纤维生长因子/β-肌动蛋白bFGF/β-actin转化生长因子-β/β-肌动蛋白TGF-β/β-actin血管内皮生长因子/β-肌动蛋白VEGF/β-actin模型组 Model group / 1.08±0.11 1.12±0.14 0.96±0.09龙胆苦苷低剂量组Gentiopicroside low does group 50 0.46±0.05d 0.81±0.10d 0.73±0.08d龙胆苦苷高剂量组Gentiopicroside high does group 100 0.38±0.04d 0.60±0.07d 0.35±0.04d环磷酰胺组Cyclophosphamide group 20 0.21±0.02d 0.52±0.06d 0.28±0.04d
2.6 龙胆苦苷对各组小鼠瘤组织p-PI3K 及p-Akt表达的影响
与H22肝癌模型组比较,龙胆苦苷低、高剂量组及环磷酰胺组小鼠p-PI3K 及p-Akt 表达均明显降低(P<0.05 或P<0.01)。 结果见图 2 和表 6。
表6 龙胆苦苷对各组小鼠瘤组织p-PI3K 及p-Akt 表达的影响(,n=10)Table 6 Effects of gentiopicroside on the expressions of p-PI3K and p-Akt in tumor tissues of mice in each group

表6 龙胆苦苷对各组小鼠瘤组织p-PI3K 及p-Akt 表达的影响(,n=10)Table 6 Effects of gentiopicroside on the expressions of p-PI3K and p-Akt in tumor tissues of mice in each group
注:与模型组比较,cP<0.05,dP<0.01。Note. Compared with the model group, cP<0.05, dP<0.01.
组别Groups剂量(mg/kg)Dose磷酸化磷脂酰肌醇-3 激酶/磷脂酰肌醇-3 激酶p-PI3K/PI3K磷酸化蛋白激酶B/蛋白激酶B p-Akt/Akt模型组Model group / 0.84±0.09 1.27±0.14龙胆苦苷低剂量组Gentiopicroside low does group 50 0.72±0.08c 0.95±0.11d龙胆苦苷高剂量组Gentiopicroside high does group 100 0.43±0.05d 0.56±0.06d环磷酰胺组Cyclophosphamide group 20 0.31±0.03d 0.35±0.04d
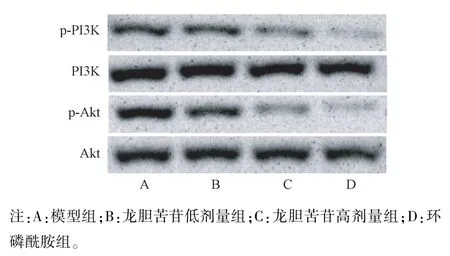
图2 蛋白免疫印迹法检测龙胆苦苷对各组小鼠瘤组织p-PI3K 及p-Akt 表达的影响Note. A, Model group. B, Gentiopicroside low does group. C,Gentiopicroside high does group. D, Cyclophosphamide group.Figure 2 Effects of gentiopicroside on the expressions of p-PI3K and p-Akt in tumor tissues of mice in each group by Western blot
3 讨论
肝癌起病隐匿,多数患者被确诊时已处于晚期,失去了手术治疗的最佳机会。 传统中药由于毒副作用低、疗效确切,具有多靶点、多途径等优势,在肝癌治疗领域逐渐引起了人们的关注[8]。 本研究选择的阳性药物环磷酰胺为临床治疗肝癌常用的化疗药物,具有抑制肿瘤生长及抗血管生成作用,免疫抑制、骨髓抑制等毒副作用较常见[9]。 本研究结果发现,与H22肝癌模型组比较,龙胆苦苷低、高剂量组及环磷酰胺组小鼠的瘤重均降低,提示龙胆苦苷对H22肝癌小鼠的肿瘤生长具有抑制作用;同时,龙胆苦苷低、高剂量组小鼠胸腺指数及脾指数升高,而环磷酰胺组小鼠胸腺指数及脾指数降低,提示龙胆苦苷的抗肿瘤作用与提高免疫力有关。 IFN-γ 与IL-2 等细胞因子在调节免疫以及肿瘤免疫反应调节中起重要作用,与非特异性免疫系统中的 NK 细胞关系密切[10]。 INF-γ 具有广泛的免疫调节作用,是一种高效的抗肿瘤生物活性物质,可由活化的T 淋巴细胞产生[11]。 IL-2 能诱导机体抗肿瘤免疫反应,是肿瘤免疫治疗的重要细胞因子;IL-2 也可以直接使瘤体消退或停止生长,从而达到抗肿瘤作用[12]。 H22肝癌小鼠经治疗后,与H22肝癌模型组比较,龙胆苦苷组小鼠血清IFN-γ 及IL-2 含量均升高,而环磷酰胺组小鼠血清IFN-γ 及IL-2 含量降低,上述结果进一步表明,龙胆苦苷对H22肝癌小鼠肿瘤生长的抑制作用与增加血清IFN-γ、IL-2含量有关。
新生血管的生成一方面可以为肿瘤细胞的转移提供通道,另一方面也可以为肿瘤的持续生长提供营养支持,对肿瘤的发生、发展及转移具有重要意义[13]。 血管生成是一个多因子参与的复杂调控过程,抑制血管生成是抗肿瘤药物研究的重要方向,羟基红花黄色素A 及人参皂苷Rg3 等均可以抑制H22肝癌小鼠血管生成,进而发挥抗肝癌作用[14-15]。 bFGF、TGF-β 及 VEGF 等是肿瘤新生血管形成的标志蛋白,其中bFGF 能够刺激内皮细胞内纤维蛋白酶和胶原蛋白酶的生成,进而促进新血管的生成;TGF-β 主要的作用为促进内皮细胞的增殖与分化,是肿瘤恶化的重要指标;VEGF 是最有效的促血管生成因子,对淋巴管的形成、血管的渗漏以及内皮细胞的增殖均有促进作用[16-17]。 多项研究已证实[18-19],降低 bFGF、TGF-β 及 VEGF 表达可以有效抑制血管生成。 本研究结果同样发现,与H22肝癌模型组比较,龙胆苦苷低、高剂量组及环磷酰胺组小鼠瘤组织 bFGF、TGF-β 及 VEGF 表达均降低,提示龙胆苦苷对H22肝癌小鼠血管生成具有抑制作用。 PI3K/Akt 信号通路是细胞内重要的信号转导途径,阻断该通路的激活可以下调bFGF、TGF-β 及 VEGF 的表达,进而抑制血管新生[20-22]。 本研究结果发现,与H22肝癌模型组比较,龙胆苦苷低、高剂量组及环磷酰胺组小鼠瘤组织p-PI3K 及p-Akt表达均降低,表明龙胆苦苷对H22肝癌小鼠血管生成的抑制作用与抑制PI3K/Akt 信号通路的活化有关。
综上所述,本研究证实龙胆苦苷对H22肝癌小鼠肿瘤生长及血管生成均有抑制作用,该作用与提高免疫力,增加血清IFN-γ、IL-2 含量及抑制PI3K/Akt 信号通路的活化有关。

