LncRNA MIAT在卵巢癌中表达及对肿瘤侵袭能力的影响
刘明盛 张勇
(1成都市第五人民医院妇产科,四川 泸州 611130;2西南医科大学附属医院妇产科)
卵巢癌是女性常见的生殖系统恶性肿瘤之一。卵巢癌的病理类型较多,临床上以上皮细胞来源的浆液性卵巢癌最为常见〔1〕。长链非编码RNA(LncRNA)是一种长度大于200 bp,但不具有编码蛋白质功能的RNA〔2〕。LncRNA的异常表达与卵巢癌发生及发展密切相关,且其机制多为负向调控了某种抑癌微小RNA(miRNA)的表达。例如,LncRNA NEAT1在卵巢癌中呈高表达且这部分患者预后较差〔3〕,分子研究证实LncRNA NEAT1通过下调miR-194的表达进而促进EMT转录因子ZEB1的表达而促进肿瘤EMT转化和侵袭转移〔4〕;经典的促癌性PI3K/AKT通路则可以被LncRNA MALAT1负性调节,进而逆转卵巢癌细胞多重耐药表型〔5〕。LncRNA MIAT是近年来鉴定出的一种新的LncRNA,本研究旨在探索LncRNA MIAT对卵巢癌侵袭的影响,以期对LncRNA MIAT成为卵巢癌分子治疗靶标提供理论依据。
1 材料和方法
1.1组织标本 本研究选取2014年1月至2015年1月成都市第五人民医院50例卵巢癌与对应癌旁组织。
1.2细胞来源及主要试剂 SKOV3细胞由我科实验室保存;LncRNA MIAT siRNA及阴性对照siRNA由美国Santa Cruz公司设计并合成;miR-150(MQPS0000665-1)及U6(MQP-0201)引物购自广州锐博生物科技有限公司;IGFBP1引物(上游5′-TCACAGCAGACAGTGTGAGAC-3′;下游5′-CCCAG GGATCCTCTTCCCAT-3′),GAPDH引物(上游5′-AAGCCTGCCGGTGACTAAC-3′;下游5′-GCGCCCA ATACGACCAAATC-3′)、Trizol试剂(15596-026)、RT-PCR试剂盒、qPCR试剂盒及转染试剂Lipofectamine 2000(11668-027)均购自美国Invitrogen公司;Transwell小室购自美国康宁公司,兔抗人IGFBP1单克隆抗体(#31025)及兔抗人GAPDH单克隆抗体(#5174)均购自美国CST公司;胎牛血清(FBS)购自Gibco公司;DMEM液体细胞培养基购自Mediatech公司;基质胶购自美国BD公司。
1.3qRT-PCR 标本及细胞RNA由Trizol试剂提取。反转录PCR条件设定为:50℃ 30 min,94℃ 2 min,循环次数1;94℃ 15 s,60℃ 30 s,68℃ 3 min,循环40次;72℃ 10 min。通过2-△△Ct法以GAPDH为内参计算LncRNA MIAT及IGFBP1 mRNA的相对表达量;以U6为内参计算miR-150的相对表达量。
1.4细胞培养及siRNA转染 SKOV3细胞于适宜条件下培养至稳定传代。将SKOV3细胞按适宜密度接种6孔板。实验分组:LncRNA MIAT组(si-MIAT)每孔加入100 pmol的LncRNA MIAT siRNA、2 ml完全培养基及5 μl Lipofectamine 2000;阴性对照组(si-control)每孔加入100 pmol的阴性对照siRNA、2 ml完全培养基及5 μl Lipofectamine 2000。转染24 h后进行下一步实验。
1.5Transwell小室 按1∶8比例采用无血清DMEM培养液稀释基质胶后,按每孔100 μl包被Transwell小室膜的上室面,制作侵袭小室模型;无基质胶包被的Transwell小室用于细胞迁移实验。取对数生长期的SKOV3细胞以无血清培养基按每孔2万个接种于上室,下室内加入750 μl含10%血清的完全培养基。培养24 h后移除培养基,甲醛固定细胞,结晶紫染色。倒置白光显微镜下观察细胞侵袭,计数迁移或侵袭细胞数目。
1.7Western印迹 RIPA试剂提取细胞总蛋白,凝胶垂直电泳分离蛋白,70 V恒压转膜150 min,5% 牛血清白蛋白封闭1 h后将条带孵育于1∶1 000比例稀释的相应一抗中。4℃过夜后,使用1∶5 000稀释的辣根过氧化物酶标记二抗孵育条带1 h。ECL曝光条带。
1.8统计学方法 采用SPSS13.0软件进行χ2检验、t检验、Kaplan-Meier生存曲线。
2 结 果
2.1LncRNA MIAT在卵巢癌组织中的表达情况 卵巢癌组织中LncRNA MIAT的表达(1.581±0.063)与对应癌旁组织(0.438±0.026)差异有统计学意义(t=2.438,P=0.026)。
2.2LncRNA MIAT表达与卵巢癌临床病理特征的关系 以卵巢癌组织中LncRNA MIAT在卵巢癌组织中平均表达水平为界值,将50例卵巢癌组织分为LncRNA MIAT高表达组(n=33)及低表达组(n=17)。LncRNA MIAT高表达与卵巢癌患者存在淋巴结转移相关(χ2=6.269,P=0.017),提示LncRNA MIAT可能与肿瘤侵袭转移相关。见表1。
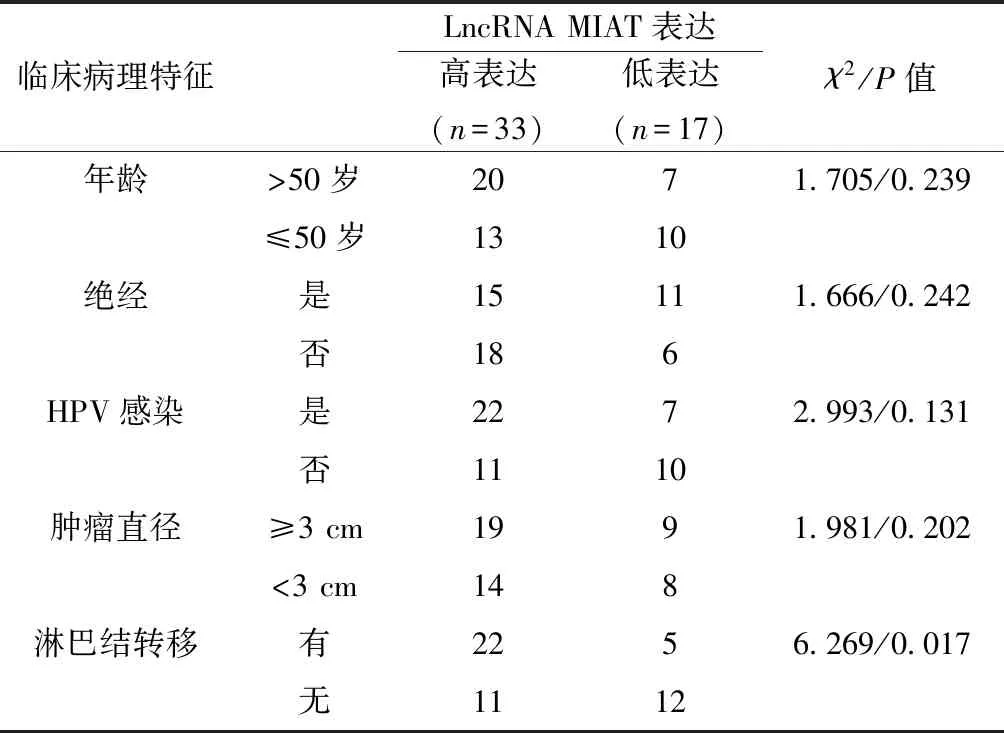
表1 LncRNA MIAT表达的临床病理意义
2.3LncRNA MIAT表达与卵巢癌患者预后的关系 LncRNA MIAT高表达组患者的3年总体生存率(HR=2.392,P=0.004)及无病生存率(HR=1.639,P=0.023)较LncRNA MIAT低表达组更低。LncRNA MIAT高表达是卵巢癌患者预后不良的独立危险因素之一(HR=3.318,P=0.009;HR=2.551,P=0.012)。见图1和表2。
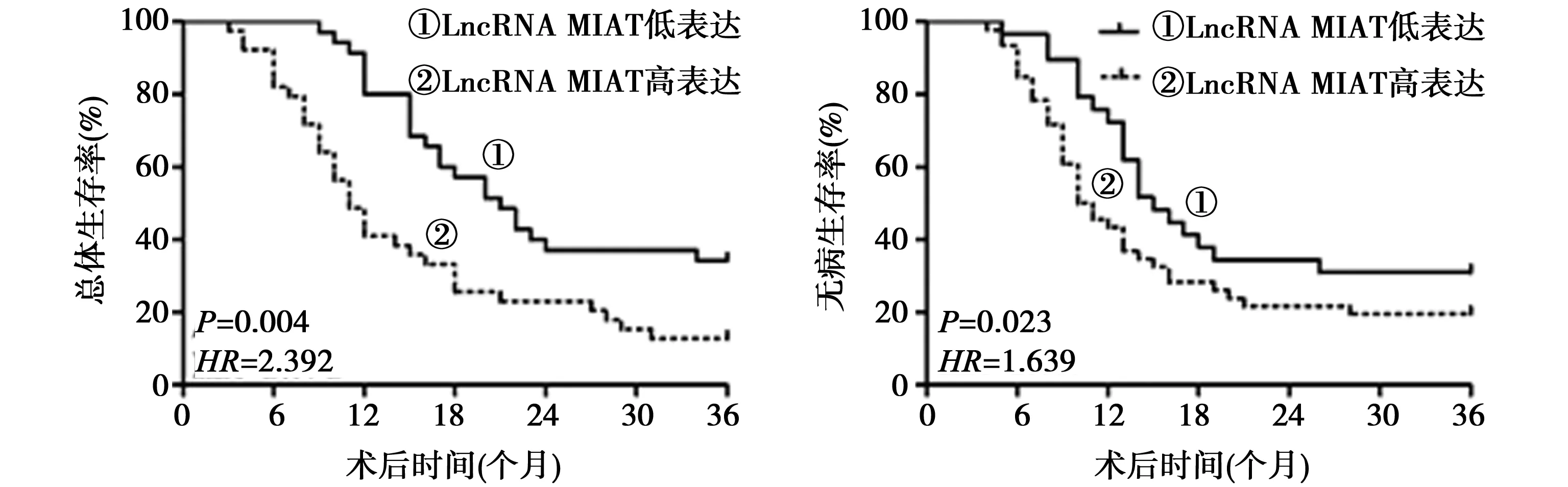
图1 LncRNA MIAT异常表达对患者预后的影响
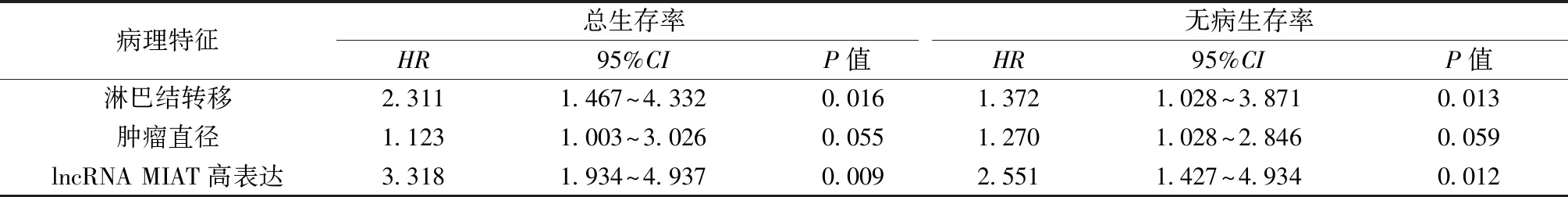
表2 卵巢癌患者术后3年生存率相关因素的COX比例风险回归分析
2.4LncRNA MIAT对卵巢癌细胞迁移及侵袭能力的影响 转染LncRNA MIAT特异性siRNA的细胞内LncRNA MIAT表达水平为(0.257±0.028),转染阴性对照siRNA的细胞内LncRNA MIAT表达水平为(0.884±0.035),差异有统计学意义(t=10.375,P=0.008)。si-MIAT组迁移细胞数量〔(95.112±8.254)个〕显著低于si-control组迁移细胞数量〔(150.381±9.013)个;t=6.223,P=0.021〕。si-MIAT组侵袭细胞数量(68.291±6.364)显著低于si-control组侵袭细胞数量〔(98.462±7.128)个;t=3.328,P=0.035〕。见图2。

图2 LncRNA MIAT对卵巢癌细胞迁移、侵袭的影响(结晶紫,×200)
2.5过表达LncRNA MIAT对下游靶点miR-150表达的调节作用 si-MIAT组miR-150表达水平(0.632±0.051)显著高于si-control组(0.231±0.103;t=3.881,P=0.027)。si-MIAT组细胞内IGFBP1 mRNA的表达水平(0.231±0.042)显著低于si-control组(0.528±0.095;t=2.168,P=0.036)。si-MIAT组细胞内IGFBP1蛋白的表达水平(0.331±0.026)显著低于si-control组为(0.582±0.014;t=2.275,P=0.032)。见图3。

图3 沉默LncRNA MIAT表达抑制SKVO3细胞内IGFBP1蛋白的表达水平
3 讨 论
LncRNA MIAT作为一种新发现的长链非编码RNA,其临床意义尚不完全清楚〔6〕。在缺血性脑卒中患者的血液标本中,LncRNA MIAT的表达水平显著升高,并与患者的神经功能缺损评分呈明显正相关,高表达LncRNA MIAT的脑卒中患者死亡率较低表达者显著升高〔7,8〕。在肝细胞癌〔9〕和胰腺癌〔10〕中,高表达LncRNA MIAT预示着患者术后早期复发和较短的总体生存期。本研究表明在LncRNA MIAT在卵巢癌中的异常高表达导致了肿瘤生物学功能发生的变化,导致肿瘤早期复发和患者死亡。从目前的研究证据来看,在不同类型的恶性肿瘤中的生物学功能并不完全相同。在乳腺癌〔11〕中,高表达LncRNA MIAT能促进乳腺癌细胞增殖并抑制细胞凋亡的发生;在非小细胞肺癌〔12〕中,LncRNA MIAT不仅能够促进细胞增殖,同时还有增强细胞侵袭转移能力的作用。LncRNA发挥生物学功能的机制主要是作为分子海绵吸附某些miRNA〔13〕,microRNA主要通过结合靶基因3′-UTR区而发挥负向调控作用〔14〕。文献〔15〕证实IGFBP1在卵巢癌中能发挥促肿瘤转移的作用,提示LncRNA MIAT发挥促癌作用的分子途径可能是通过下调miR-150进而促进癌基因IGFBP1的表达来实现的。
综上,LncRNA MIAT在卵巢癌高表达,lncRNA MIAT促进卵巢癌侵袭的作用可能是通过调控miR-150/IGFBP1信号通路的活化来实现的。

