局部应用脂源性间充质干细胞促进瘘管的愈合的相关动物研究 ①
朱晓文,倪 健,邹玉梅,陈福军
(佳木斯大学附属第一医院普外四科, 黑龙江 佳木斯 154003)
肛瘘是一种慢性疾病,需要手术治疗。如果同时伴有克罗恩病(CD)[1],则治疗更为困难和延长。保守治疗的有效率低于40%,瘘管通常不会完全愈合。保守治疗与手术治疗相结合已被证实疗效提高约40%~60%。最近相关研究报道,使用局部应用间充质干细胞(MSCs)可能成为一种新的、更有效治疗方法[2]。MSCs的特点是快速扩张、多效性、免疫调节作用以及通过刺激局部修复过程和血管生成来支持愈合。最近的几项研究评估了MSCs在克罗恩病(CD)患者小群体中应用的效果。使用脂肪源干细胞(ADSCs)以及与骨髓分离的同种异体细胞。在干预后,治愈率在第24周达到85%。然而,在随访数年之后,只有37%~58%的患者出现了长期的影响[4,5]。在第一个大的多中心随机试验(212例患者)中,短期内在完成了ADSCs的异体应用后46%的患者中病情得以缓解[7]。治疗的临床效果不仅受到肛周区域的局部检查的影响,还受到临近疾病活动和保守治疗反应的影响[8,9]。
生物发光(BLI)成像技术是一种强大的技术,它允许在接受者的身体内对移植的细胞进行实时的非侵入性追踪。基质的管理(D -荧光素)在供体细胞中引发酶反应,导致光子的发射。考虑到这种反应只能发生在有活力的细胞中,故BLI可以识别出细胞的分布和数量[11]。这项研究的目的是评估ADSCs在动物模型上应用ADSCs对瘘管愈合的影响。
1 材料与方法
1.1 实验动物
32只250~350g的Lewis雄性大鼠。所有动物在实验前至少2周都在动物中心的目标设施的上进行了驯化。在研究过程中,维持了12h的阳光和黑暗循环,并提供了大量的食物和液体。实验结束后,动物被安乐死,注射了致命剂量的硫喷妥钠。
所有的实验都是在佳木斯大学临床医学院和基础医学院所认可的实验工作场所进行的,经过伦理委员会的批准,并根据关于动物使用的指导方针进行。
1.2 方法
1.2.1 瘘的模型建立
32只大鼠均于计划干预前4周建立瘘管模型。用布尔特曼等方法描述了一种改进的结肠造瘘术[10]。动物通过肌内注射盐酸替利他胺,佐拉西泮和甲苯噻嗪混合麻醉药物,用5mL的佐拉西泮+ 7mL的甲苯噻嗪和生理盐水(8mL)在手术前30min用0.1mL/200g动物体重的比例使用。在背部固定后,做了一个2~2.5cm的剖腹手术。盲肠区依次切开皮肤、筋膜和肌层进入腹腔。通过皮下隧道从腹腔镜下模拟瘘道暴露出盲肠。然后,打开肠壁,在它的边缘固定有4个0的缝线直到皮肤。在这一端模拟了一个外部开口。在止血处理后,剖腹手术的所有层次都依次缝合关闭,动物被放置在生物室。在随机化之前,所有的瘘管都经过证实有粪便分泌和探针检查,可以自由地通过瘘道。此外,对前3只大鼠进行了瘘管造影,以验证该技术的准确性。
1.2.2 ADSCs的隔离和培养
自交供体Lewis大鼠脂肪组织中表达荧光素酶基因。采集腹股沟脂肪垫(0.5 1cm3),同时使用2%异氟醚短时间吸入麻醉(异氟醚)。随后将其切成小块,在添加10%牛血清的H-MEM中消化一整夜,溶解于0.05%或0.1%的胶原酶溶液中。在5mL移液管中反复移液分离组织,用培养基稀释悬浮液,800G离心8min。丢弃上清;将含有细胞的托盘接种到25cm2细胞培养皿中,加入完全培养基(含所有非必需氨基酸的H-MEM;2.5ng/mL表皮生长因子;0.12g/L丙酮酸钠;1g/L nahco3;1g/L谷氨酰胺;10%牛血清;1%胎牛血清,200U/mL青霉素和100lg/mL链霉素),在3.5%的CO2孵育箱中,设定温度为37℃。培养基每2、3天更换一次。台盼蓝染色后,在B urker室检测细胞计数和活力。
1.2.3 分组、ADSCs治疗及疗效评估
瘘验证后,使用2%的异氟醚吸入性麻醉后,这些动物随机分组。治疗组(A组)和对照组(B组)。A组(n=16), 2mL浓度为2×106细胞/mL的ADSCs悬液注入在瘘口周围。B组(n=16),适量的盐水(安慰剂)注入同一区域。然后将动物放回容器中。
使用已建立的瘘管引流评估方法,在使用ADSCs后的第7、14、30天在同一短麻醉下内对瘘管治疗进行评估。在轻度受压后的外开口出现脓性或粪便样分泌物,瘘管则被认为是开放的[12]。此外,还使用了一个2mm的探针来验证整个瘘道是否闭合。
监测ADSCs的可行性和分布情况情况则在第2、7、14和30天进行。首先,用150mg/kg D-荧光素溶液给动物注射。然后,老鼠被放置在摄像机的房间里-IVIS Lumina XR,在2min的曝光中检测了酶反应释放的光子数量。随后,BLI被量化到瘘管周围的固定兴趣区域。在一个直径2.5cm的圆内,以每秒每平方厘米每立体视界的光子数p(s·cm2·sr)使用生活图像软件(PerkinElmer)分析。在与BLI强度相关的基础上,评估了可行ADSCs的相对含量。应用程序后立即测量的信号作为参考(100%)。
1.3 统计学方法
采用SPSS25.0统计软件分析,检测数据,组间均数比较采用单因素方差分析检验方法,资料服从正态性和方差齐性,P<0.05为差异有统计学意义。
2 结果
2.1 治疗效果分析
在A组或B组中使用ADSCs或安慰剂后无并发症或不良反应,无任何动物死亡。这些动物茁壮成长并获得足够的重量。干预后7天,A组5例(31%)瘘管和B组1例(6.3%)瘘管关闭。另有1只A组大鼠在第2周内痊愈。干预后第30天, A组和B组分别有6只(38%)和1只(6.3%)大鼠瘘管被关闭,分别(P=0.033)。见图1。
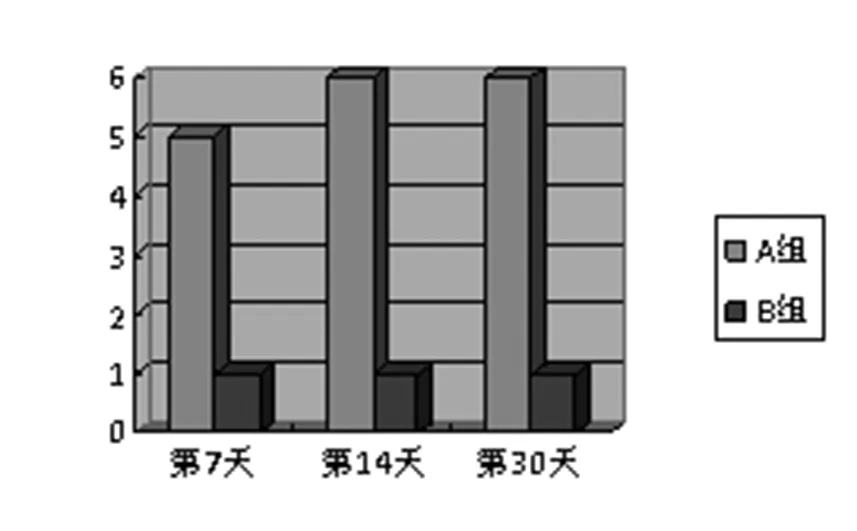
图1 给药后瘘管愈合的大鼠数量情况
2.2 BLI(荧光辐射强度)及干细胞存活比率变化
在应用ADSCs后,BLI的高活性只被记录在周围区域。这种信号在动物身体的任何其他部位都无法检测到。A组的BLI值在植入后立即达到最高—31.2×104(6.09~111×104)p(s·cm2·sr)。信号强度下降最快的是在前两天,数值下降了50.2%。在第30天,辐射强度为2.77×104(0.156~16.9×104),代表其原始值的8.87%。见表1。B组BLI的水平在整个期间为零。比较A组大鼠愈合样本和未愈合瘘管样本之间的值,在A组中,从第7天开始,成功治疗的动物中BLI的趋势逐渐升高。这一差异在第30天有显著差异,分别为8.23×104(1.18~16.9×104)和1.74×104(0.156~6.88×104)p(s·cm2·sr),分别为17.1%和5.54%(P=0.0393),见表2。

表1 A组大鼠(16只)随访期间BLI(荧光辐射强度)及干细胞存活比率变化

表2 A组大鼠随访期间愈合样本(6只)与未愈合样本(10只)间BLI(荧光辐射强度)及干细胞存活比率变化比较
3 讨论
尽管目前进行了联合手术和保守药物联合治疗的方法,但克罗恩病(CD)的肛周瘘管仍然是一种严重影响患者生活质量的破坏性疾病。有几项研究报道了局部治疗MSCs的疗效。然而,发表的临床结果具有很高的可变性,主要是由非随机试验的小群体。因此,作者决定在实验中验证这种方法的可能性。
应用ADSCs导致愈合率要明显高于安慰剂(38%vs6.3%,P=0.033)。在仅有的一项类似的实验研究中证实了局部治疗ADSCs的疗效。它的主要目的不是治疗瘘管病,而是减少肠经皮瘘和改良的无瘘道的简单盲肠造瘘的区域。在我们的研究中,在干预组中有38%的动物被观察到完全愈合。与临床试验相比,这一成功率较低。然而,大多数试验都使用联合治疗报告结果。在局部应用MSCs之前,可先切除或切除瘘道,或最终缝合内部开口。最大的多中心随机试验的初步结果(212例乳糜泻患者)报告了异基因ADSC管理与第24周的安慰剂相比对瘘愈合的显著影响49.5%。所有患者均继续服用药物,并在治疗前进行瘘道刮治术,这本身导致了安慰剂组34.3%的瘘管闭合 。我们的结果显示了纯细胞治疗对瘘管愈合的真正影响。共使用了4×106个细胞(2mL悬浮)。在最初的人体试验中也使用了类似的剂量[3]。在先前提到的经皮瘘大鼠的实验研究中,使用相同数量的细胞。高剂量不会导致更好的效果,这在国外的基础试验中已经被证实描述[6]。 使用了周围的腹股沟脂肪组织作为MSCs的来源。然而,一些已发表的人体试验选择了从骨髓中分离出来的细胞。骨髓源异基因细胞的优势在于,当与年轻的健康捐赠者分离时,可能会有冷冻保存和更高的再生和免疫调节的可能性。另一方面,皮下脂肪组织是MSCs的一种容易且不易侵入的来源。事实上,ADSCs保留了它们的多线性发育可塑性,根据一些研究,与从骨髓中分离出来的细胞相比,它们在免疫表型上的异质性更小[13]。
由于光发射强度和活细胞数量的相关性,BLI技术提供了一种非侵入性的植入ADSCs体外监测的可能性。在我们的研究中,BLI的动力学显示了在细胞质量在前2d损失最大,约下降了一半。随后,还原率趋于减慢,14和30d后,可检测的细胞分别占其初始量的21%和8.87%。在对大鼠骨盆底损伤治疗的研究中也发现了类似的趋势。在前7d之后,只有1/4的应用细胞在现场被检测到。一个月后达到稳定的细胞量,在随访2个月后仍维持在3%。这种快速减少的细胞质量可能是由于在发炎的周围组织中缺乏基质或免疫反应。
BLI信号只在应用区域中检测到,而细胞没有迁移到其他区域或器官。一个可能的原因可能是ADSCs被由炎症的周围空间组织释放的趋化因子所吸引。在我们的研究中,干预组A组的BLI和未愈合的动物表现出在第一周内具有较大变异性的可存活细胞的可比性降低。然而,从第14天开始,当闭合和打开瘘管的数量稳定后,在已愈合的大鼠中,BLI的值更高。这一差异在第30天具有统计学意义。这一结果表明ADSCs分化为单个细胞株,并在愈合过程中融合,从而解释了瘘管愈合与存在的相关性。在第14天的非显著性差异也可以用少量的实验对象来解释(6个愈合的和10个未愈合的动物)。根据我们在接种后早期观察到的快速细胞减少,可以通过重复的应用来获得更高数量的可行的ADSCs。这项措施可以提高治疗效果,这应该在临床试验中得到反映和评估。应用接种之间的最佳间隔时间似乎<7d。在相对较短的随访中,可能不会注意到最终的瘘管复发。这通常发生在克罗恩病(CD)患者的炎症性肠活动[5]。考虑到我们模型中的瘘管是人工造成的,没有慢性肠炎症的背景,在最初愈合后,这种复发不太可能发生。关于术后并发症及其他不良事件,30d的观察期根据经典定义是可以被接受的。
综上所述,在动物模型中,在瘘管周围组织局部应用脂肪间充质干细胞后,瘘管闭合率明显高于对照组。

