慢性乙型肝炎和乙型肝炎肝硬化患者胃粘膜病变研究
韩利畴,许 望,韩 丹,邢增珀
乙型肝炎是由HBV感染引起的一种传染性疾病。HBV具有明显的“嗜肝性”。当HBV侵入人体感染后,与肝组织细胞表面的受体结合,在肝细胞内大量复制,继而不断侵袭,诱发肝细胞损伤[1,2]。同时,研究还发现HBV具有轻度的“泛嗜性”,比如侵犯胆管上皮细胞引起HBV相关性胆管疾病[3]、侵犯肾小管细胞[4]引起HBV相关性肾炎、侵犯血液单核细胞[5]引起造血功能不良、侵犯胃粘膜细胞引起相关性胃病[6]等。有研究在胃粘膜病变组织发现有HBV DNA的存在,证实了HBV对胃粘膜的侵犯[7]。胃蛋白酶原(PG)包括PGI和PGII两个亚单位,作为胃蛋白酶原的前体,可经过毛细血管进入外周血,其水平和两者比值的变化可用于评估胃粘膜病变的程度[8,9]。本研究通过检测慢性乙型肝炎(CHB)和乙型肝炎肝硬化患者血清PGI和PGII水平,并在胃镜下观察了胃粘膜病变,以探讨这类疾病患者胃粘膜病变的特点。
1 资料与方法
1.1 病例来源 2017年1月~2019年1月海南医学院附属海南医院收治的CHB患者70例,男45例,女25例,年龄为18~65岁,平均年龄为(33.4±6.2)岁;乙型肝炎肝硬化患者56例,男40例,女16例,年龄为35~70岁,平均年龄为(45.5±10.7)岁。参照《慢性乙型肝炎防治指南》[10]的标准诊断。排除标准:药物性或酒精性肝病、心源性肝硬化、存在心、肺、脑等严重的功能障碍、合并有肿瘤、4周内应用过护胃或抑制胃酸的药物。另选择同期于该院体检的健康人50例作为对照组,男38例,女12例,年龄为30~60岁,平均年龄为(40.3±9.4)岁。受试者签署知情同意书,本研究经我院医学伦理委员会审核。
1.2 血清PG水平检测 清晨抽取空腹外周血5 ml,采用ELISA法检测血清PGI和PGII水平(河南美凯生物科技)。
1.3 胃镜检查 使用Olympus GIF-Q40型纤维胃镜检查,将胃粘膜表现分为正常胃黏膜、浅表性胃炎和萎缩性胃炎[11]。萎缩性胃炎的病理学表现分为轻度:粘膜皱襞表浅,小红色的斑点呈剥脱样,粘膜呈现细白网状,类似蛇皮样表现;中度:外周呈白色的网状样,内部是在蛇皮样的基础上有樱桃样的红斑,少见出血;重度:在黏膜处可见大片弥漫性樱桃红样斑点,有明显的出血点,有些甚至已融合成片状。
1.4 外周血淋巴细胞亚群检测 使用贝克曼库尔特商贸(中国)有限公司提供的 CytoFLEX流式细胞仪检测外周血CD3+、CD4+和CD8+细胞百分比[抗人CD3+检测试剂盒(R&D Systems,Abnova);抗人CD4+检测试剂盒(莱尔生物);抗人CD8+检测试剂盒(上海纪宁)],计算CD4+/CD8+细胞比值。
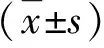
2 结果
2.1 三组血清PG水平比较 肝硬化组血清PGI水平显著低于健康人和乙型肝炎组,血清PGII水平显著升高,血清PGI/PGII比值显著降低(P<0.05,表1)。

表1 三组血清PG水平比较
2.2 三组胃粘膜变化比较 在胃镜下,三组人群胃粘膜表现见图1;肝硬化组萎缩性胃炎发生率显著高于健康人或慢性乙型肝炎组(P<0.05,表2)。
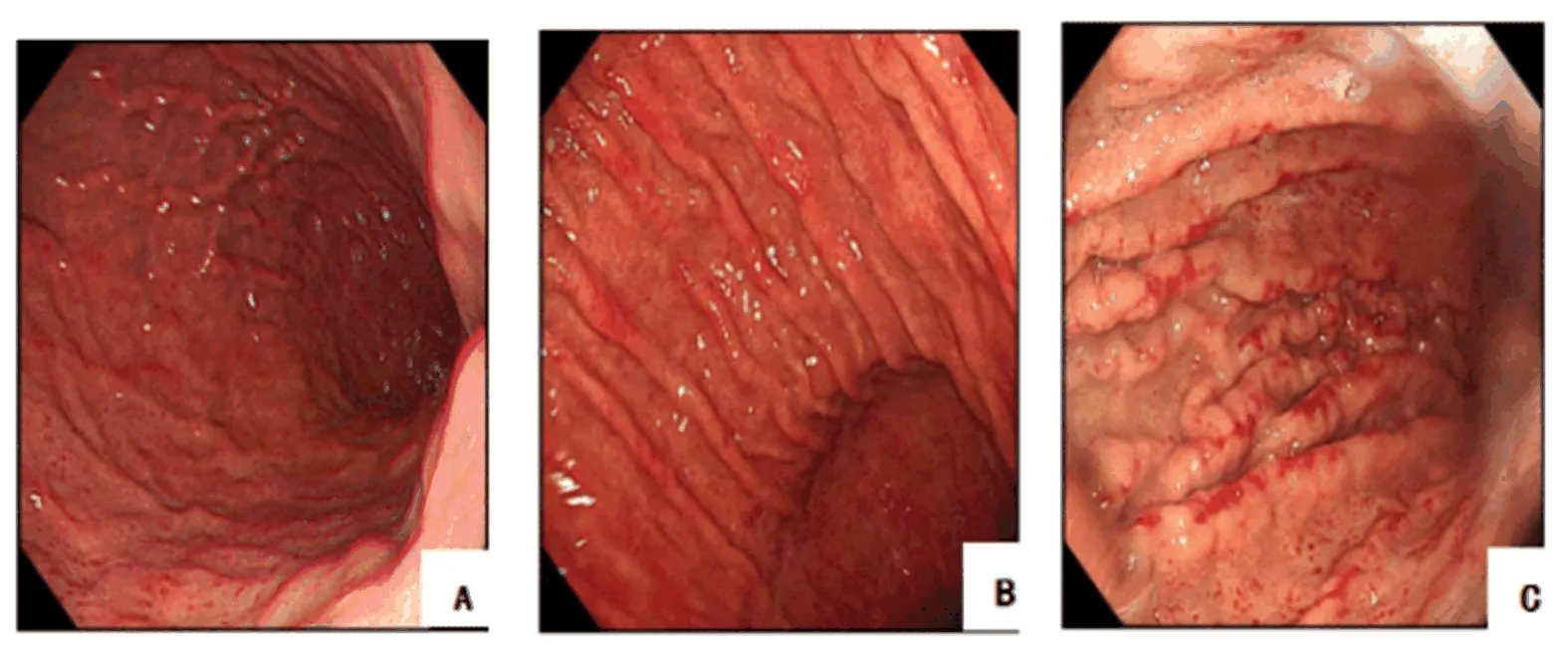
图1 三组胃粘膜表现A:健康体检者胃粘膜表现,粘膜皱襞表浅,小红色的斑点呈剥脱样,粘膜呈现细白网状,类似蛇皮样表现,为轻度萎缩性胃炎;B:慢性乙型肝炎患者胃粘膜表现,胃粘膜外周呈白色的网状样改变,内部是在蛇皮样的基础上有樱桃样的红斑,少见出血,为中度萎缩性胃炎;C:肝硬化患者胃粘膜表现,胃粘膜可见大片弥漫性樱桃红样斑点,有明显的出血点,有些甚至已融合成片状,为重度萎缩性胃炎

表2 三组胃粘膜病变(%)比较
2.3 三组外周血淋巴细胞亚群比较 肝硬化组外周血CD3+和CD4+细胞百分比显著低于健康人,乙型肝炎和肝硬化患者外周血CD8+细胞百分比显著高于,而CD4+/CD8+细胞比值显著低于健康人(P<0.05,表3)。

表3 三组外周血淋巴细胞亚群比较
3 讨论
乙型肝炎的发生主要是机体对病毒发动免疫攻击,主要是细胞免疫功能对HBV的清除而引发的一系列肝组织病理学改变。由于未被体内的免疫细胞清除的HBV在肝脏组织内大量复制,继而引发免疫应答反应,故外周血T淋巴细胞亚群可在一定程度上反映肝脏被HBV侵袭的程度[3]。本研究乙型肝炎肝硬化组外周血淋巴细胞亚群百分比发生了显著的变化,影响了机体免疫功能的发挥,病毒感染造成严重的肝组织损伤。
研究表明,慢性乙型肝炎患者出现胃粘膜损伤的可能性较大,主要表现为慢性胃炎、消化性溃疡类疾病,也有发生胆汁反流性胃炎、浅表性胃炎或萎缩性胃炎等[12,13]。一般胃组织被侵犯的部位较弥漫且广泛,尤其见于胃体和胃底部位。研究表明[14-16],机体受HBV侵犯后引发并启动自身免疫功能的激活,继而病毒也同时侵犯了胃粘膜组织,造成胃粘膜组织损伤。肝组织自身损伤导致对雌激素的灭活程度降低,血清白蛋白水平下降,致使胃粘膜组织的恢复能力减弱。当慢性肝炎迁延不愈造成肝硬化和门静脉高压时,全身血液流动性减弱,胃组织血管血流缓慢易发生淤血,致使组织缺血缺氧等而引发胃粘膜损伤。慢性乙型肝炎患者因长期服用不同类型的药物治疗,存在一定的消化道不良反应,也会对胃粘膜造成损伤。慢性乙型肝炎患者较健康人能分泌更多的胃酸,可能也对胃粘膜有不利的影响。
胃蛋白酶原在胃液中被酶催化和活化成胃蛋白酶,其中PG1主要在胃底部位分泌,分泌PGII的细胞弥散在胃组织各部位,包括十二指肠,仅少数会穿透胃粘膜,故血清PGI和PGII水平发生改变能反映胃粘膜的病理学变化[17,18]。研究表明[19,20],萎缩性胃炎是因为胃粘膜上的主细胞数量减少,致使PGI水平随之减少。同时,若胃粘膜发生肠化生,可导致PGII水平升高,PGI/PGII比值同时发生相应的变化。故低水平的PGI和(或)PGI/PGII比例降低是萎缩性性胃炎进展为癌前胃粘膜病变的指征,即PG是萎缩性胃炎的标志物,虽不是直接的肿瘤标志物,但血清PGI和(或)PGI/PGII比值明显下降对检测早期胃癌具有重大的临床意义。
在本研究中,通过检测血清PGI和PGII水平,计算PGI/PGII比值,结果显示与健康人相比,乙型肝炎和肝硬化组血清PGI水平和PGI/PGII比值显著降低,而PGII水平显著升高,且肝硬化组较乙型肝炎组表现更加显著,说明肝硬化患者胃功能有显著的变化。
进一步检测三组外周血淋巴细胞亚群结果显示,乙型肝炎组和肝硬化组变化明显。T细胞是主导免疫功能的主要效应细胞,T细胞亚群可反映患者的免疫功能状态。淋巴细胞包括CD3+细胞、CD8+细胞毒性T细胞和CD4+辅助T细胞,其中CD8+细胞可杀灭特殊的抗原靶细胞,也可启动凋亡途径杀灭乙型肝炎病毒。另CD4+细胞可识别抗原,参与信号的传递,可促进CD8+细胞、B淋巴细胞和多种免疫细胞增殖分化,使机体的细胞免疫功能和体液免疫功能达到均衡调节作用,故CD4+/CD8+细胞比值可直接反映机体的免疫平衡状态[21]。本研究通过观察胃粘膜病变程度,结果显示乙型肝炎和肝硬化患者均有胃粘膜的病理学变化,且肝硬化组萎缩性胃炎发生率更高。
综上所述,乙型肝炎肝硬化患者胃粘膜发生了显著的病理学变化,其萎缩性胃炎发生率高,血清PGI和PGII水平或PGI/PGII比值发生了显著的变化,外周血淋巴细胞亚群也表现出明显的功能紊乱。这些变化是病毒感染的结果还是门脉高压导致的,需要进一步明确。

