多种预后评分系统预测慢加急性肝衰竭并发真菌感染患者短期预后价值分析*
刘积庆,于国英,杨生森,黄 群,保成兰
ACLF是指在慢性肝病的基础上出现新的肝细胞坏死性病变引起的肝衰竭,多由乙型肝炎病毒(HBV)感染、酒精中毒或药物性肝损伤(DILI)等因素引起,全身炎症反应水平高,病情可能迅速恶化,短期病死率较高[1-4]。随着广谱抗生素、糖皮质激素和各种侵入性诊治方法的广泛应用,肝病患者并发侵袭性真菌感染(invasive fungal infection,IFI)的发病率不断上升[5]。ACLF患者并发IFI后,真菌在体内繁殖可引起炎症反应,对机体器官功能造成严重的损害,对预后造成不良的影响,极大地增加了临床治疗的难度[6,7]。因此,寻找一种受治疗因素干扰小、可量化的病情和预后评估指标,对于ACLF并发IFI患者进行早期预警、合理分配医疗资和改善预后都意义重大。本研究应用4种预后评分系统预测了ACLF并发IFI患者预后情况,以期能发现较准确的短期预后评估系统。
1 资料与方法
1.1 研究对象 2018年1月~2020年10月我院收治的ACLF并发IFI患者60例,男41例,女19例;年龄为33~63岁,平均年龄为(50.2±5.8)岁。ACLF诊断符合《肝衰竭诊治指南(2018年版)》的诊断标准[8],其中49例为乙型肝炎,2例为丙型肝炎,9例为酒精性肝炎。ACLF并发IFI符合《重症患者侵袭性真菌感染诊断与治疗指南(2007年)》[9]的诊断标准,16例为口咽部感染,25例为肺部感染,10例为肠道感染,5例为尿道感染,4例为血液感染。排除标准:并发血液病,如急性或慢性髓系/淋巴母细胞白血病、多发性骨髓瘤等;行肝移植、骨髓移植和有恶性肿瘤史;妊娠或哺乳期妇女。所有受试者签署知情同意书,本研究经我院医学伦理委员会审核。
1.2 血清指标 使用日本东芝TBA—FX8型全自动生化分析仪检测血生化指标,包括血清肌酐(serum creatinine,sCr)、乳酸(lactate,Lac)和血钠(sodium,Na);使用日本希森美康CS—5100型全自动血凝分析仪及其配套试剂检测凝血酶原时间,计算国际标准化比值(international normalized ratio,INR)。
1.3 预后评分系统 终末期肝病模型评分(model for end-stage liver disease,MELD)[10]=3.78×ln [TBIL(mg/dl)]+11.2×ln[INR]+9.57×ln[sCr(mg/dl)]+6.43×病因,其中病因为胆汁性和酒精性记为1,其余记为0;MELD-Na+模型评分[11]=MELD+1.59×(135-Na+),其中血Na+≥135 mmol/L均按照135 mmol/L计算,血Na+<120 mmol/L则按照120 mmol/L计算,血Na+为120~135 mmol/L,则按照具体数值代入计算;亚太肝脏研究协会慢加急性肝衰竭研究小组评分(APASL-ACLF research consortium score,AARC-ACLF)[12]涉及TBIL、INR、Lac、Cr和肝性脑病分期5个因素,每个因素以0~3分评价,最后进行累加,量表最终得分为5~15分,分数越高表示肝衰竭越严重;慢性肝衰竭-序贯器官衰竭评分(chronic liver failure-sequential organ failure assessment,CLIF-SOFA)[13]涉及呼吸、肝脏、凝血、循环、神经、肾脏6个系统的器官评估,共监测10个因素,每个因素以0~4分评价,最后进行累加,量表最终得分为0~40分,分数越高表示器官衰竭越严重。
1.4 肝性脑病分期标准 按照West-Haven标准[14]进行肝性脑病分期,0期:无特殊行为或性格变化;Ⅰ期,轻度认知障碍、抑郁或兴奋,较短的集中时间和较低的加法计算能力,病理反射多为阴性,脑电图多期:为正常;Ⅱ期:倦怠或冷漠,轻度方向性异常,轻度人格改变,行为障碍,语言不清,减法运算能力异常,可伴有明显的神经症状,如肌肉张力增加、高渗肌腱反射、踝阵挛、扑翼样震颤阳性,Babinski征阳性,脑电图可显示特征性的θ波改变;Ⅲ期:昏睡期,可醒来,无外界刺激易入睡,意识模糊,方向性明显障碍,神经体征进一步加重,脑电图出现明显异常波形;Ⅳ期:昏迷,对强烈刺激和言语无反应。在浅昏迷时,体检不配合,肌腱反射亢进,肌肉张力增加。当进入深度昏迷时,对各种刺激无反应,瞳孔扩大,各种反射消失,脑电图出现δ波。
1.5 治疗方法 在本院接受一般综合治疗和内科综合治疗,包括吸氧、营养支持,给予抗病毒药物治疗,促肝细胞再生、退黄、降血氨、调节肠道菌群等。对并发IFI患者,根据病情给予积极的抗真菌感染治疗,必要时给予人工肝支持系统治疗。
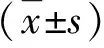
2 结果
2.1 预后情况 在治疗观察12 w末,本组ACLF并发IFI患者死亡41例(68.3%)。
2.2 不同转归的ACLF并发IFI患者肝功能指标比较 死亡组ACLF并发IFI患者血清TBIL、INR、sCr和Lac水平显著高于生存组,而血清ALB水平显著低于生存组(P<0.05,表1)。

表1 不同转归的ACLF并发IFI患者肝肾功能指标比较
2.3 不同转归的ACLF并发IFI患者肝性脑病分期比较 死亡组ACLF并发IFI患者肝性脑病发生率和严重程度显著高于生存组(P<0.05,表2)。

表2 不同转归的ACLF并发IFI患者肝性脑病分期(%)比较
2.4 不同转归的ACLF并发IFI患者预后评估模型得分比较 死亡组ACLF并发IFI患者MELD评分、MELD-Na+评分、CLIF-SOFA评分和AARC-ACLF评分均显著高于生存组(P<0.05,表3)。

表3 不同转归的ACLF并发IFI患者预后评估模型得分比较
2.5 四种评估模型预测ACLF并发IFI患者12 w死亡风险的效能分析 以MELD评分>22.0分为截断点,预测ACLF并发IFI患者12 w死亡风险高的曲线下面积(area under the curve,AUC)为0.687,约登指数为0.200,其敏感度为60.0%,特异性为60.0%;以MELD-Na+评分>23.0分为截断点,预测ACLF并发IFI患者12 w死亡风险高的AUC为0.716,约登指数为0.330,其敏感度为82.3%,特异性为50.7%;以AARC-ACLF评分>8.0分为截断点预测ACLF并发IFI患者12 w死亡风险高的AUC为0.893,约登指数为0.681,其敏感度为96.0%,特异性为72.1%;以CLIF-SOFA评分>8.0分为截断点预测ACLF并发IFI患者12 w死亡风险高的AUC为0.884,约登指数为0.707,其敏感度为96.3%,特异性为74.4%,提示CLIF-SOFA评分和AARC-ACLF评分对ACLF并发IFI患者12 w死亡风险的预测价值显著优于MELD评分和MELD-Na+评分预测(P<0.05,图1)。
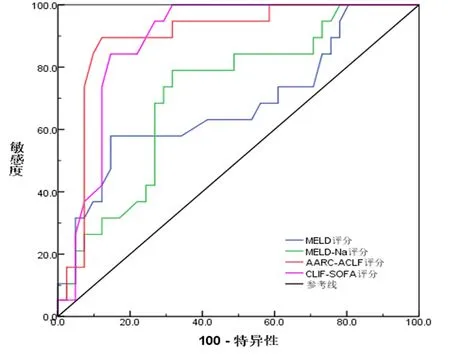
图1 四种评估模型预测ACLF并发IFI患者12 w死亡风险的ROC曲线分析
3 讨论
由于病情进展、长期住院,条件致病菌成为肝衰竭患者感染的主要致病菌,细菌感染后广谱抗生素的应用则容易引起体内菌群失调,导致IFI的发生[15,16]。ACLF是肝衰竭中最常见的类型,鉴于该病的发病机制尚未被阐明,故无针对ACLF的特异性治疗方法。研究[17]指出,白色念珠菌是ACLF并发IFI患者最常见的菌株,不仅能抑制淋巴细胞增殖,还能附着于宿主细胞上,具有极强的治病能力。经抗真菌药物治疗后,念珠菌感染情况可以得到控制,但由于ACLF本身致死率较高,并发IFI会促使患者进入“临终感染状态”。本组68.3%(41/60)的患者在12 w内死亡,也证明并发IFI将对ACLF患者预后造成不良影响。本研究中,死亡组ACLF并发IFI患者入院时和峰值血清胆红素、INR、肌酐和Lac水平显著升高,而血清白蛋白水平显著低于生存组,研究结果提示,ACLF患者病情严重将导致IFI的发生,严重影响预后,这是因为真菌入侵引起ACLF患者体内炎症反应加剧,Lac增多,同时基础疾病加重可能引起肝肾功能损伤[18,19]。
本研究应用四种模型对ACLF并发IFI患者12 w死亡风险进行了预测。MELD评分是一种经典的终末期肝病评价模型,是基于欧美人群建立的模型,但未考虑感染和肝细胞再生等因素;Meld-Na+评分则是在MELD评分基础上加入血钠指标;CLIF-SOFA评分是根据SOFA评分衍变而来的,更针对肝脏引起的多脏器衰竭情况;AARC-ACLF是基于亚太人群,注重肝衰竭本身的表现,纳入与肝功能相关的TBIL、INR和与肾功能相关的Cr、Lac,并加入了肝性脑病作为预测变量,计算过程较上述3种模型更加便捷[20]。本研究提示CLIF-SOFA评分和AARC-ACLF评分的预测价值接近且优于其他两种评分,而相比较于CLIF-SOFA评分,AARC-ACLF评分的应用更为简单。本研究为回顾性研究,结果可能存在一定的偏差。进一步探讨AARC-ACLF和CLIF-SOFA等评分模型对ACLF并发IFI患者短期预后的预测价值将有助于临床尽早作出判断。

